耕层土层交换对土壤氮素关键转化过程和玉米氮素利用的影响*
2019-10-15金文俊黄海蒙周得宝赵阳阳董召荣
杨 硕, 金文俊, 黄海蒙, 王 军, 周得宝, 赵阳阳, 董召荣, 宋 贺**
耕层土层交换对土壤氮素关键转化过程和玉米氮素利用的影响*
杨 硕1, 金文俊1, 黄海蒙1, 王 军1, 周得宝2, 赵阳阳1, 董召荣1, 宋 贺1**
(1. 安徽农业大学农学院 合肥 230036; 2. 宿州市农业科学院 宿州 234000)
翻耕会使耕层土壤发生显著位置交换。耕层土壤位置交换会通过影响土壤物理、化学和生物性状, 改变氮素转化过程。本文研究了土层交换对黄淮海平原南端砂姜黑土硝化、反硝化过程和玉米生长及氮素利用的影响, 为该区域选择合理的耕作方式、减少氮素损失及提高氮素利用效率提供理论依据。试验在人工气候室条件下, 以土壤(0~35 cm)田间原位分层作为常规土层处理(CK), 以原位0~10 cm和10~20 cm土层交换后作为土层交换处理(SE), 并用20 μm的尼龙网区分非根际和根际土壤。于玉米小喇叭口期利用荧光定量PCR技术测定土壤氨氧化微生物和反硝化菌群丰度, 并结合非根际和根际土壤的硝化潜势、土壤呼吸、反硝化能力、反硝化潜势、土壤理化性质和玉米总氮含量及根系形态的测定, 探讨土层交换对土壤氮素转化和玉米生长及氮素利用的影响。结果显示, SE处理的玉米植株氮吸收量比CK处理显著降低8.9%(<0.05)。土层交换显著影响根际而不是非根际土壤的硝化潜势, 使其显著降低13.5%(<0.05); 并使非根际和根际土壤的反硝化能力分别提高36.6%(<0.05)和8.4%(<0.05)。土层交换使非根际和根际土壤的可溶性有机碳含量分别提高11.7%(<0.05)和5.2%。相关分析显示硝化潜势与氨氧化细菌(AOB)丰度呈显著正相关(=0.91**), 与氨氧化古菌(AOA)丰度无显著相关关系; 反硝化能力与土壤可溶性有机碳和呼吸速率呈显著正相关(=0.89**和0.93**), 与、拷贝数无显著相关性; 玉米植株氮吸收量与根际土壤的硝化潜势、根表面积×AOB拷贝数都呈显著正相关(=0.83*和0.86*), 而与反硝化能力呈显著负相关(=-0.88**)。以上结果表明砂姜黑土土壤硝化速率的降低和反硝化速率的增强, 是土层交换后玉米氮素利用效率低的重要原因。AOB是硝化速率的主要驱动微生物。土层交换后土壤可溶性有机碳是反硝化能力的关键主导因子。在翻耕条件下, 有效调节土壤可溶性有机碳含量是提高作物氮肥利用效率的关键。
土层交换; 玉米; 根际; 硝化; 反硝化; 氮素利用
氮素转化是土壤养分循环的重要组成部分, 不仅影响土壤质量, 还会对农田生态系统生产力和持续性产生影响[1]。硝化和反硝化是土壤氮素转化的关键过程[2]。硝化过程是NH3在好氧微生物作用下氧化成NO2-, 随后再氧化成NO3-的过程。NH3氧化成NO2-是该过程的限速步骤, 由氨氧化细菌(AOB)和氨氧化古菌(AOA)共同推动[3-4]。反硝化过程则是把NO3-和NO2-作为微生物电子受体, 在无氧或微氧条件下, 经过多种酶催化逐步还原为气态产物(NO、N2O和N2)的过程。其中, 亚硝酸还原酶将水溶态氮转化成作物无法利用的气态氮, 是土壤氮素损失的关键过程, 由和基因编码[5-6]。
硝化和反硝化过程受到土壤含氧量、有机碳和无机氮等环境因素的调控[7-10]。例如氧分压的增加会促进硝化过程, 而反硝化过程在厌氧条件下更加有利于氮素转化成气态产物[11]。有机碳富集会刺激细菌的生长, 增加土壤呼吸和氮同化需求, 加剧氨氧化菌与需氮异养微生物对铵和氧的竞争, 不利于硝化过程; 相反, 有机碳作为反硝化微生物的电子供体和细胞能源物质, 且其分解过程中消耗了土壤中的氧利于营造厌氧环境, 会直接或间接地促进反硝化过程[12-14]。硝态氮和铵态氮是土壤无机氮的主要存在形式。在没有其他环境因素制约的情况下, 一定范围内无机氮浓度的升高会加快硝化和反硝化过程。其中, 硝态氮作为反应底物会直接影响反硝化过程; 而铵态氮也会促进硝化过程, 并对AOB和AOA的丰度和群落结构产生影响[15-16]。
土壤耕作是作物生产的重要环节, 通过机械物理作用, 调节耕层土壤内部位置和物理结构, 会对土壤水、肥、气、热等环境条件产生显著影响[17-18]。翻耕可使耕层土壤发生显著的位置交换, 使下层土壤被翻到表层后变得疏松, 可能会促进硝化过程; 而上层土壤被翻到底层后会使大孔隙的体积减少, 造成土壤的空气和透气性降低。且上层土壤的有机碳和底物氮含量较高, 在被翻到底层后, 可能为反硝化过程创造了更好的环境条件。耕层土壤的位置交换会深刻改变上、下两层土壤的触氧面和微生物的生长环境, 同时也引起耕层土壤理化性状的改变。耕层土层交换后的这些改变与作物根系之间会产生相互作用, 改变根际的氮素转化过程, 并可能对作物的氮素吸收产生影响。但是, 目前关于耕层土壤氮素关键转化过程的改变对玉米()植株吸氮有何影响的研究鲜有报道。本研究假设: 相比常规土层, 土层交换可能会降低耕层土壤的硝化作用, 但会促进反硝化作用。由于反硝化作用会增加土壤有效态氮的损失, 作物对氮素的吸收可能会减少。
黄淮海平原是我国粮食的主产区, 约占全国耕地面积的1/6, 其玉米产量占全国总产的35%~ 40%[19]。本试验选择黄淮海平原南部典型的砂姜黑土作为供试土壤, 在人工气候室中用根箱培养玉米。利用分子微生物学和生物化学等方法, 重点研究土层交换对土壤氮素转化和玉米生长及氮素利用的影响, 并通过土壤理化性状、氮素转化过程及氮素关键转化微生物丰度的分析, 剖析其中的机理过程, 为该区域选择合理的耕作方式、减少氮素损失及提高氮素利用效率提供理论依据。
1 材料与方法
1.1 试验设计
试验土壤取自安徽省宿州市安徽农业大学皖北综合试验站(33°41′N, 117°04′E), 为黄淮海平原南部典型的砂姜黑土。0~20 cm土层土壤基础理化性状: 有机质18.8 g∙kg-1, 全氮1.3 g∙kg-1, 碱解氮96.5 mg∙kg-1, 全磷0.9 g∙kg-1, 全钾20.7 g∙kg-1, 有效磷3.1 mg∙kg-1, 速效钾200.0 mg∙kg-1, pH 7.9, 容重1.4 g∙cm-3。
分3层(0~10 cm、10~20 cm、20~35 cm)挖取的大田土壤, 在室内过2 mm筛并混匀后置于阴凉处晾干, 分层放入一组根箱(长45 cm、宽3.5 cm、高35 cm)中, 并保证土壤的上、中、下位置顺序及容重与田间原位相同, 将此组作为常规土层处理(CK, 图1)。把0~10 cm和10~20 cm土层, 分别视作A和B层土壤(图1)。将原位A层和B层分别放入另外一组根箱的10~20 cm和0~10 cm处, 20~35 cm土层土壤仍按照田间原位填充, 该组视做土层交换处理(SE, 图1)。根箱由20 μm的尼龙网分成3个隔室(中央隔室长为15 cm, 外侧隔室长为15 cm, 宽和高均为3.5 cm×35 cm)以使根系不能通过, 中央隔室为根际土壤, 而外侧隔室则为非根际土壤[20]。本研究土层交换为主因素, 根际和非根际土壤为2种副因素, 共4个处理, 每个处理5个重复。
根箱置于充满细沙的托盘(重力水位满足在沙层上1 mm水平)上, 转移至人工气候室(35 ℃光照14 h/25 ℃黑暗10 h循环交替, 空气湿度70%), 并在培养过程中往根箱中加水保持土壤含水量(WFPS)为40%~60%。待土壤稳定后, 在中央隔室播种2粒‘郑单958’玉米种子, 在三叶期间苗, 每个根箱留玉米苗1株。从玉米播种时起, 每周向根箱中加入KNO3和KH2PO4溶液, 4周后土壤累积施入的氮素含量达到每公顷120 kg, 磷素含量达到每公顷50 kg。
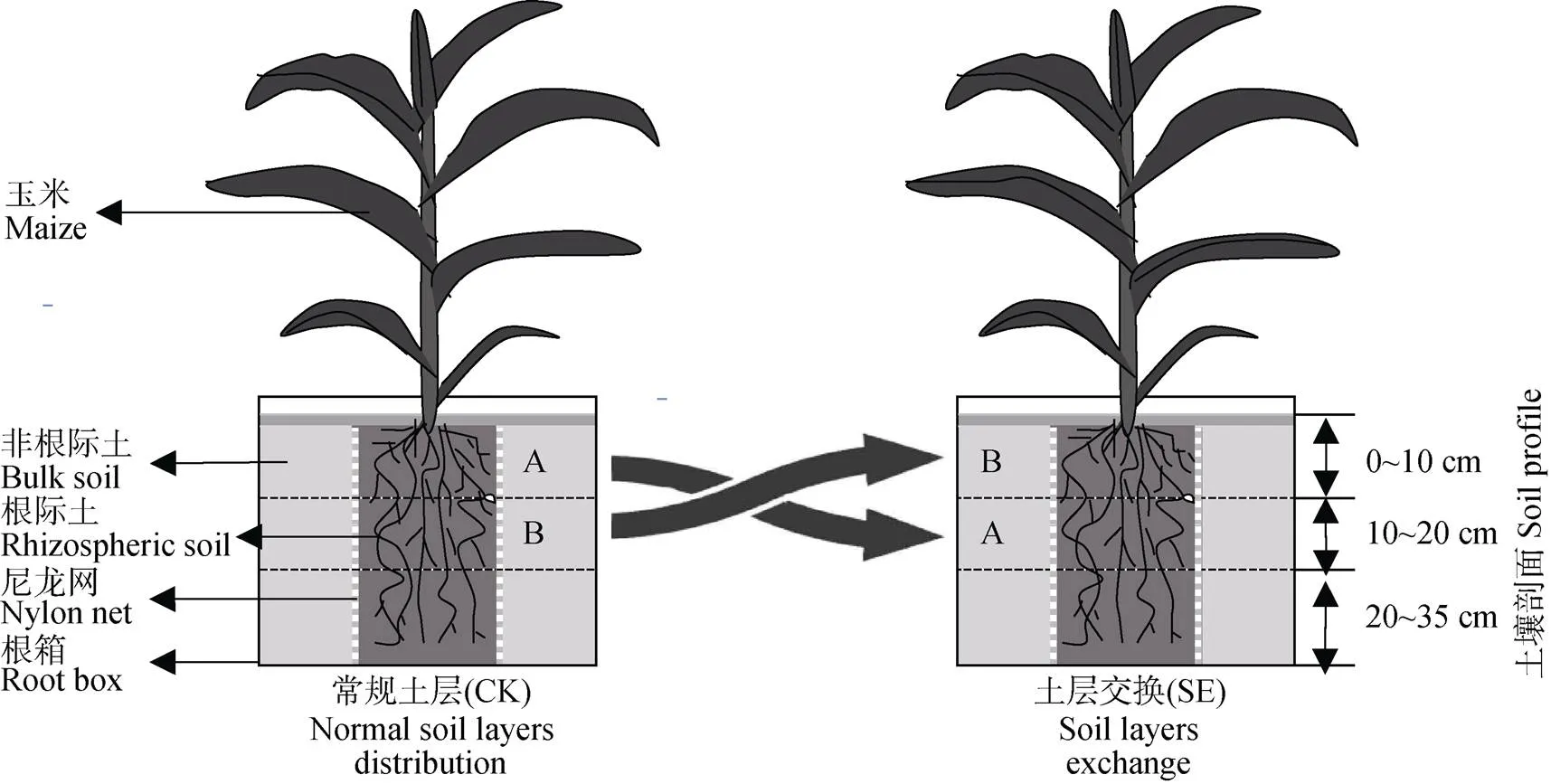
图1 不同处理(常规土层、土层交换)玉米-根箱装置
1.2 样品采集
玉米出苗后第5周, 对根箱中土壤和玉米植株样品进行破坏性取样。从根系密集的中央隔室中分层取出土壤并仔细去除与土壤黏附根系, 收集起来作为根际土壤; 非根际土从两侧隔室分层收集。随后将收集好的土壤装入带有冰袋的保温箱中, 带回实验室。已采集的根际土壤和非根际土壤样品在过2 mm筛并混匀后, 根据检测项目进行如下分装与贮藏: 其中200 g放在–20 ℃冰箱中, 主要用于硝化和反硝化功能基因分子定量试验和无机氮、可溶性碳氮与pH等土壤化学性状的测定; 300 g保存于4 ℃冰箱中, 进行土壤呼吸、反硝化能力、反硝化潜势和硝化潜势的测定。同时, 玉米的地上部植株和根系用自来水冲洗掉残余土壤后, 收集起来用于玉米组织的分析。
1.3 玉米组织的分析
玉米出苗后第5周, 在破坏性取样前采用手持式叶绿素仪(SPAD 502, 日本)测定根箱中玉米叶片叶绿素含量(SPAD)。检测时选取玉米最上部完全展开叶, 并以叶片的叶尖、中间和靠近茎部位的平均读数来代表叶片叶绿素含量。之后, 玉米叶片在1 500 μmol∙m-2∙s-1光合有效辐射的红色/蓝色LED源、叶室温度25 ℃、叶-气蒸汽压力差(1.7±0.1) kPa和环境CO2浓度条件下用光合速率仪(LI-6400, 美国)检测。测定完成后, 分地上部和地下部取出整株玉米, 用于测定根系形态和全氮含量。先把待测的根际土壤从中央隔室分层取出, 将其置于筛子中用清水反复冲洗至根系与土壤分离, 已筛选出的根系采用WINRHIZO根系分析系统测定根长、根表面积、根平均直径、根体积和根尖数等根系形态指标。玉米地上部和地下部样品在烘箱中105 ℃杀青15 min, 80 ℃恒温烘干, 粉碎并过筛后, 采用硫酸-双氧水消煮, 凯氏定氮法测定样品全氮含量。
1.4 土壤理化性质的分析
对玉米出苗后第5周从根箱中收集的根际和非根际土壤进行土壤化学性质的分析。土壤硝态氮(NO3--N)和铵态氮(NH4+-N)含量采用连续流动分析仪(AA3, 德国)测定。鲜土置于烧杯中, 加入浸提液, 磁力搅拌器搅拌30 min, 静置或离心后, 获取的滤液置于冰箱中贮藏。硝态氮和铵态氮的浸提液为1 mol·L-1KCl溶液(水土比5∶1)。可溶性有机碳(DOC)和有机氮(DON)含量采用Multi 3100 C/N分析仪(Jena Analytik, 德国)检测。DOC和DON测定选用0.5 mol·L-1K2SO4溶液(水土比2.5∶1)做为浸提液。土壤pH的测定采用pH计(STARTER, 3100)电位计法(水土比5∶1)。
1.5 硝化潜势的测定
硝化潜势(NP)的测定采用悬浮液法[21]。先称量5 g鲜土样品于120 mL血清瓶中, 然后加入1.5 mmol∙L-1NH4+的液体培养基(水土比10∶1), 置于恒温震荡培养箱(30 ℃, 200 r∙min-1)中培养2 d。培养期间, 每间隔12 h取样一次, 共获得5份液体样品。每次取样量为4 mL, 悬浮液离心后, 将取得的上清液置于冰箱中贮藏, 连续流动分析仪(AA3, 德国)检测。硝化潜势按NO3--N、NO2--N在单位时间内形成的总量来计算。
1.6 反硝化作用和土壤呼吸的测定
反硝化能力和反硝化潜势的测定参考Šimek等[22]和Yeomans等[23]的方法。反硝化能力(DC)和反硝化潜势(DP)是以单位时间内N2O+N2的产生率来表示, 土壤呼吸(SR)是根据CO2气体变化率计算。简要的试验步骤: 各样品称取两份10 g鲜土放入120 mL血清瓶, 随后加入42.9 mmol∙L-1KNO3溶液5 mL。加盖密封后反复用真空泵抽真空-氦气清洗3~4次, 并使瓶内处于厌氧状态。向其中一组血清瓶中注入10 mL乙炔进行培养, 其N2O气体变化率代表了单位时间内反硝化总量(N2O+N2)的产生率。另一组不添加乙炔培养的血清瓶中CO2气体变化率表征土壤呼吸。用装有少量水、没有活塞的注射器插入瓶塞来平衡瓶内气压后, 将血清瓶置于人工气候箱恒温25 ℃条件下培养。在培养24 h和48 h后, 用注射器从血清瓶中抽取5 mL气体样品, 并立即用气相色谱仪(GC-7890A, 美国)检测N2O和CO2浓度。反硝化潜势(DP)的测定, 除用含42.9 mmol∙L-1KNO3外, 另外添加8.3 mmol∙L-1葡萄糖, 其他试验步骤同反硝化能力的测定。
1.7 土壤微生物总DNA提取和功能基因荧光定量
土壤微生物总DNA提取按照DNA提取试剂盒(Fast DNASPIN Kit for Soil, 美国Q-BIO gene公司)提供的操作步骤进行。称取0.5 g土壤样品, 用试剂盒提取后获得80 μL DNA样品并立即贮藏于–20 ℃冰箱中。采用Mx3000P实时荧光定量PCR系统(Stratagene, USA)对氨氧化细菌和古菌的功能基因进行定量PCR, 选择的PCR反应体系(25 μL)包括12.5 μL的2×SG Green qPCR Mix, 0.5 μL的DNA模板和上下游引物各0.5 μL(10 μmol∙L-1), 其余的用无菌水补齐。氨氧化细菌的扩增引物选用/[24], PCR反应程序为95 ℃预变性3 min; 35个循环: 95 ℃变性30 s, 57 ℃退火30 s, 72 ℃延伸60 s。氨氧化古菌扩增引物选用/[25], PCR反应程序为95 ℃预变性3 min; 30个循环: 95 ℃变性45 s, 53 ℃退火60 s, 72 ℃延伸60 s。反硝化菌功能基因和定量PCR, 选择的反应体系(50 μL)包括25 μL的SYBR Premix Ex Taq(TaKaRa, 日本), 1 μL的DNA模板和上下游引物各1 μL(10 μmol∙L-1), 剩余的用无菌水补齐至50 μL。的扩增引物选用[26], PCR反应程序为95 ℃预变性3 min; 35个循环: 95 ℃变性30 s, 58 ℃退火45 s, 72 ℃延伸45 s。的扩增引物选用[27], PCR反应程序为94 ℃预变性3 min; 35个循环: 94 ℃变性45 s, 55 ℃退火45 s, 72 ℃延伸1 min。质粒和标准曲线的制作按照王晓辉[28]的方法。
1.8 数据采集与分析
数据用SPSS 19分析软件进行单因素方差分析和相关性分析。文中数据为平均值±标准差。用Microsoft Excel 2007制作图表。
2 结果与分析
2.1 土层交换对玉米土壤化学性质的影响
从表1看出, 非根际土壤中, SE处理和CK处理之间, 土壤pH和可溶性有机氮含量无显著差异。但与CK处理相比, SE处理的可溶性有机碳含量和NH4+-N含量显著增加, NO3--N含量则显著降低。在根际土壤中, SE处理和CK处理的土壤基础化学性状各指标无显著差异。根际土壤NO3--N含量低于非根际, 这可能和作物根际的氮素吸收有关。
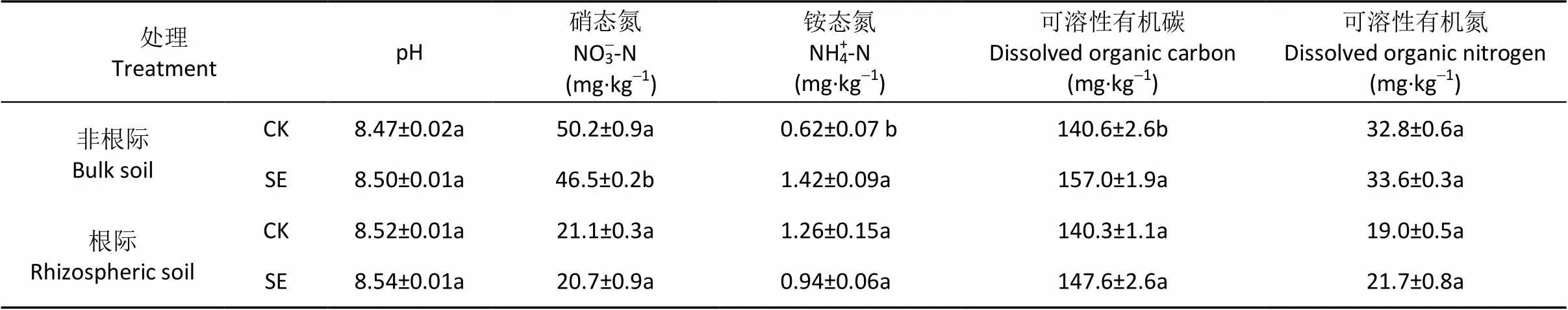
表1 土层交换对0~20 cm土层土壤化学性质的影响
CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示非根际或根际土土层交换与对照处理间具有显著性差异(<0.05)。CK: normal soil layers distribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments of bulk soil or rhizopsheric soil (< 0.05).
2.2 土层交换对土壤呼吸的影响
由图2A可知, SE处理0~20 cm土层非根际的土壤呼吸显著高于CK处理, 主要由于0~10 cm土层SE处理较CK处理显著增加。与非根际土壤相比, 根系刺激了土壤呼吸, 使0~10 cm CK和SE处理、10~20 cm CK和SE处理的根际土壤呼吸分别增加55.7%和23.5%、36.9%和48.6%, 根系对CK处理的刺激效果较强(图2A, 2B)。但0~20 cm土层根际CK和SE处理的土壤呼吸无显著差异(图2B)。
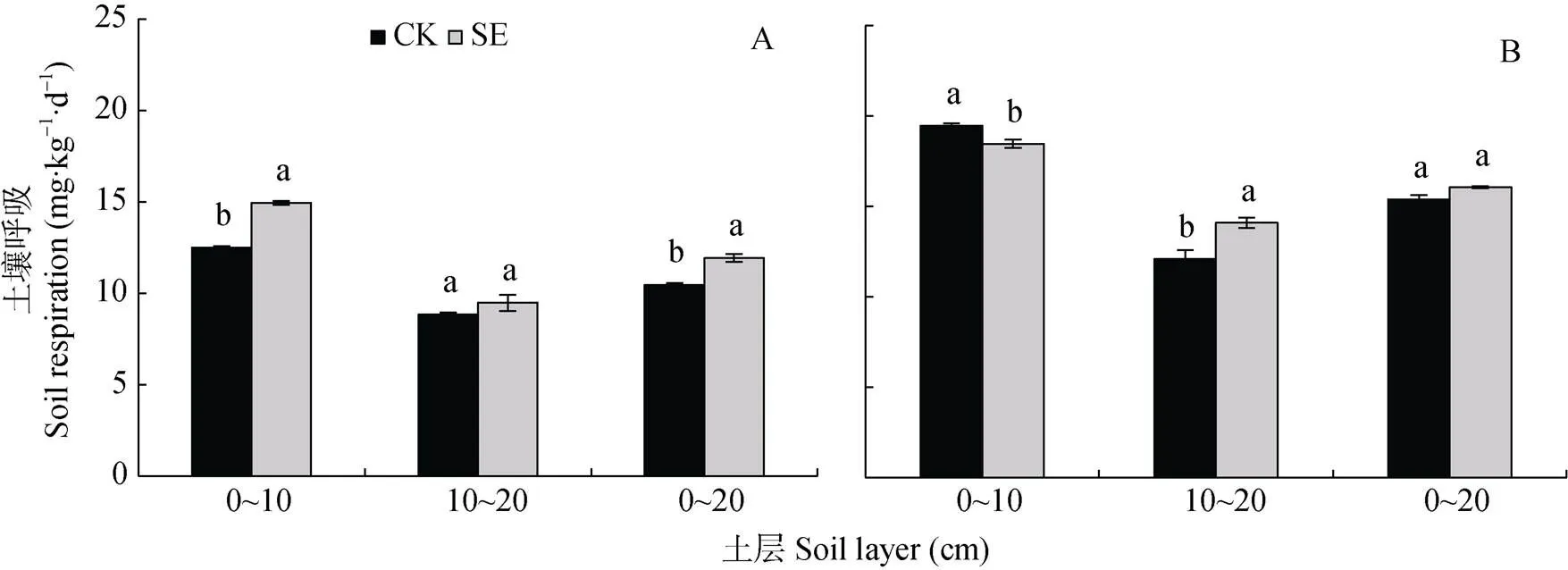
图2 土层交换对非根际(A)和根际(B)土壤呼吸速率的影响
CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示土层交换与对照处理间差异显著(<0.05)。CK: normal soil layersdistribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05).
2.3 土层交换对土壤硝化势和氨氧化细菌及古菌的影响
由图3可知, 0~20 cm土层非根际SE处理和CK处理的硝化潜势无显著差异, 而根际SE处理的硝化潜势显著低于CK处理。在根际和非根际, 0~10 cm土层SE处理的土壤硝化潜势较CK处理显著降低, 而10~20 cm土层SE处理的土壤硝化潜势较CK处理显著升高(图3A, 3B)。
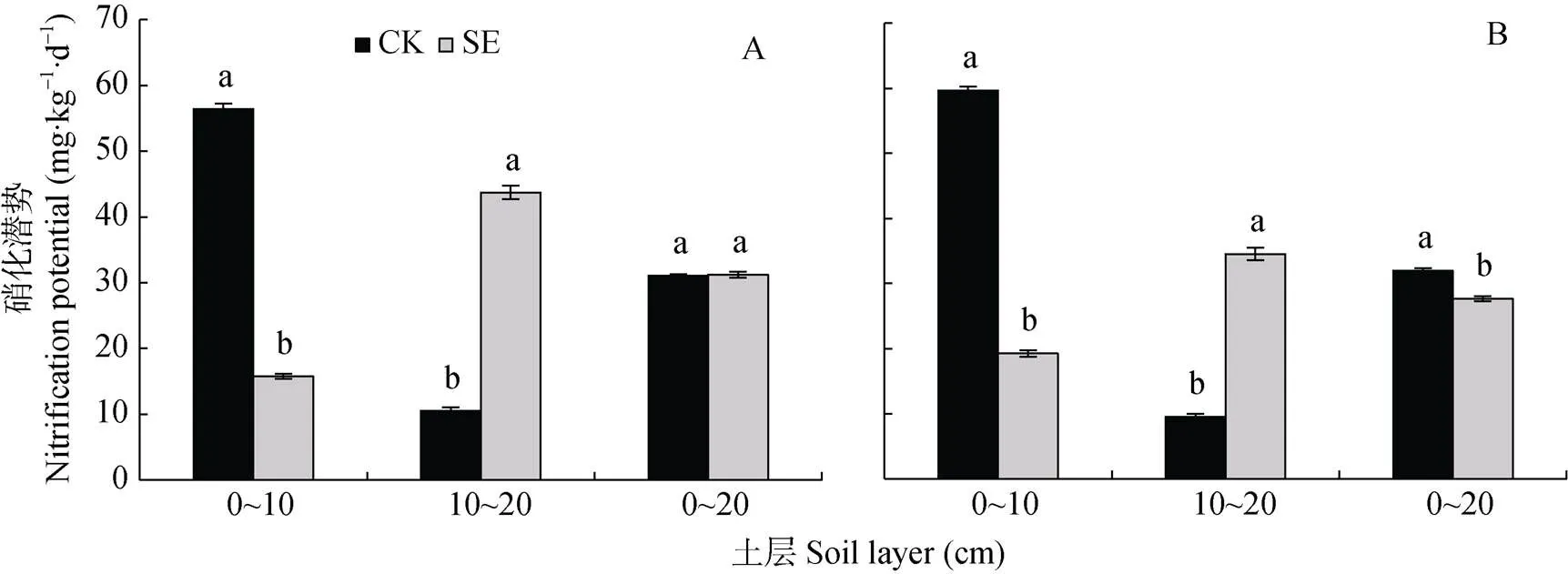
图3 土层交换对非根际(A)和根际(B)土壤硝化潜势的影响
CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示土层交换与对照处理间差异显著(<0.05)。CK: normal soil layersdistribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05).
如图4和图5所示, AOB-基因拷贝数是AOA-的64.4~231.4倍, 可见砂姜黑土的AOB占优势地位。在非根际和根际, 0~20 cm土层SE处理的AOB-基因拷贝数较CK处理显著降低, 主要由于0~10 cm土层SE处理的AOB-基因拷贝数较CK处理显著降低(图4A, 图4B)。
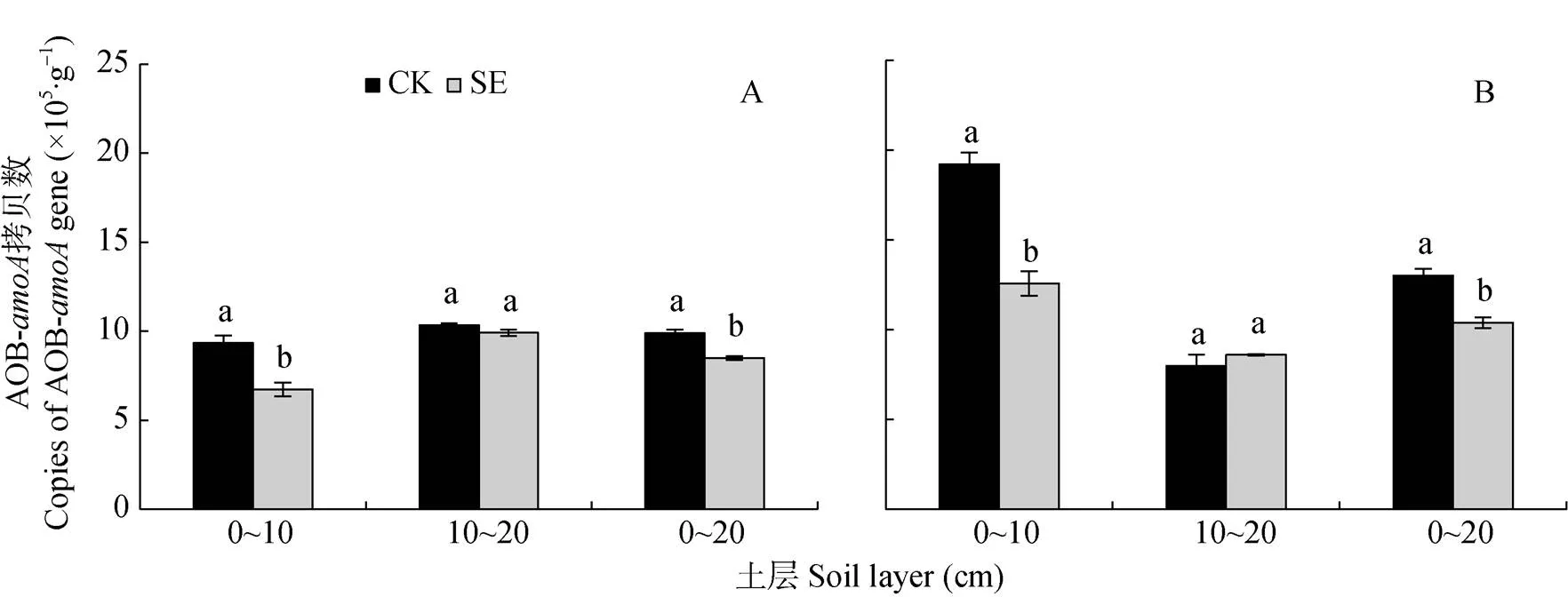
图4 土层交换对非根际(A)和根际(B)氨氧化细菌丰度的影响
CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示土层交换与对照处理间差异显著(<0.05)。CK: normal soil layersdistribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05).
由图5可知, 0~20 cm土层非根际SE处理的AOA-基因拷贝数较CK处理显著降低, 是因为0~10 cm和10~20 cm土层SE处理的AOA-基因拷贝数较CK处理均显著降低(图5A); 而根际SE处理的AOA-基因拷贝数较CK处理显著升高(图5B)。相比非根际, 根系使0~10 cm、10~20 cm土层CK和SE处理的根际AOA-基因拷贝数分别变化–27.0%和84.0%、–26.4%和47.9%。可见根际SE处理的AOA-基因拷贝数较CK处理显著升高, 是因为根系使CK处理的AOA-基因拷贝数显著降低、SE处理的AOA-基因拷贝数显著升高(图5A, 图5B)。
2.4 土层交换对土壤反硝化作用和反硝化菌群丰度的影响
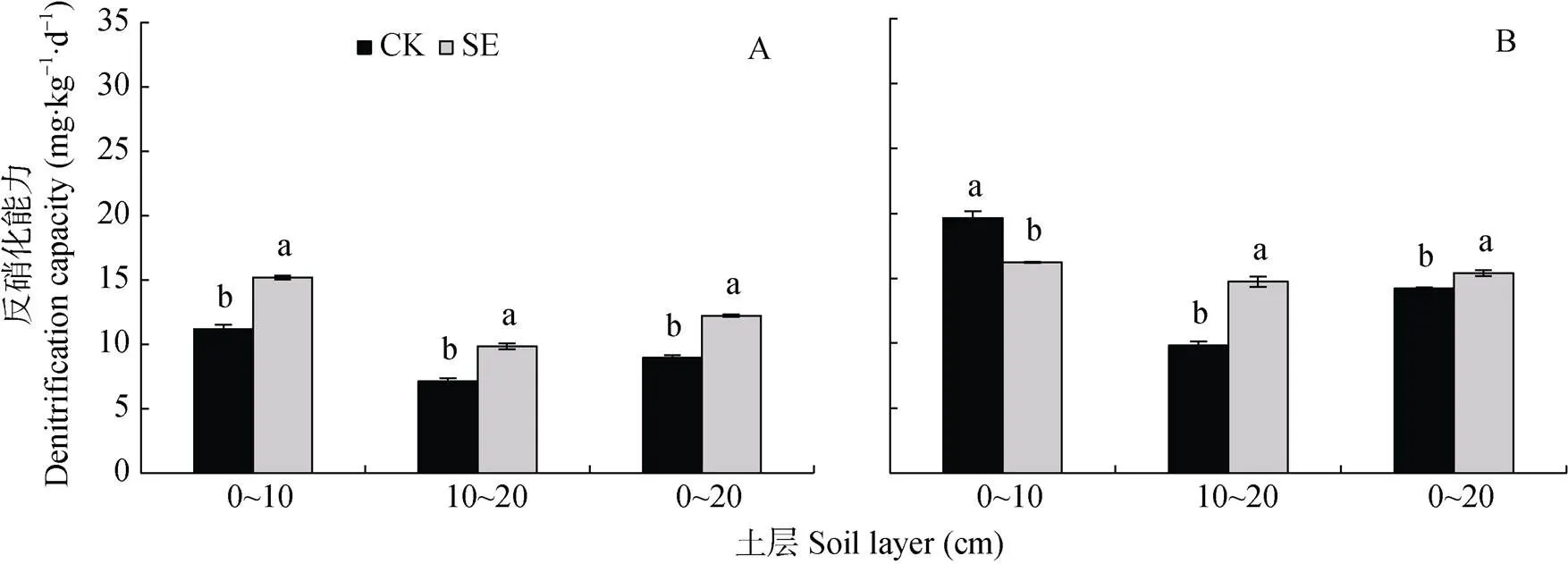
由图6可知, 0~20 cm土层非根际SE处理的土壤反硝化能力显著高于CK处理, 是因为0~10 cm和10~20 cm土层SE处理的土壤反硝化能力较CK处理都显著升高(图6A); 而根际SE处理的土壤反硝化能力较CK处理也显著升高(图6B), 是由于10~20 cm土层SE处理土壤反硝化能力显著高于对照。对比非根际, 根系刺激了土壤反硝化能力, 使0~10 cm、10~20 cm土层CK和SE处理根际的反硝化能力分别增加75.8%和6.9%、37.5%和49.9%, 可见根系对CK处理的反硝化能力刺激效果较强(图6A, 图6B)。
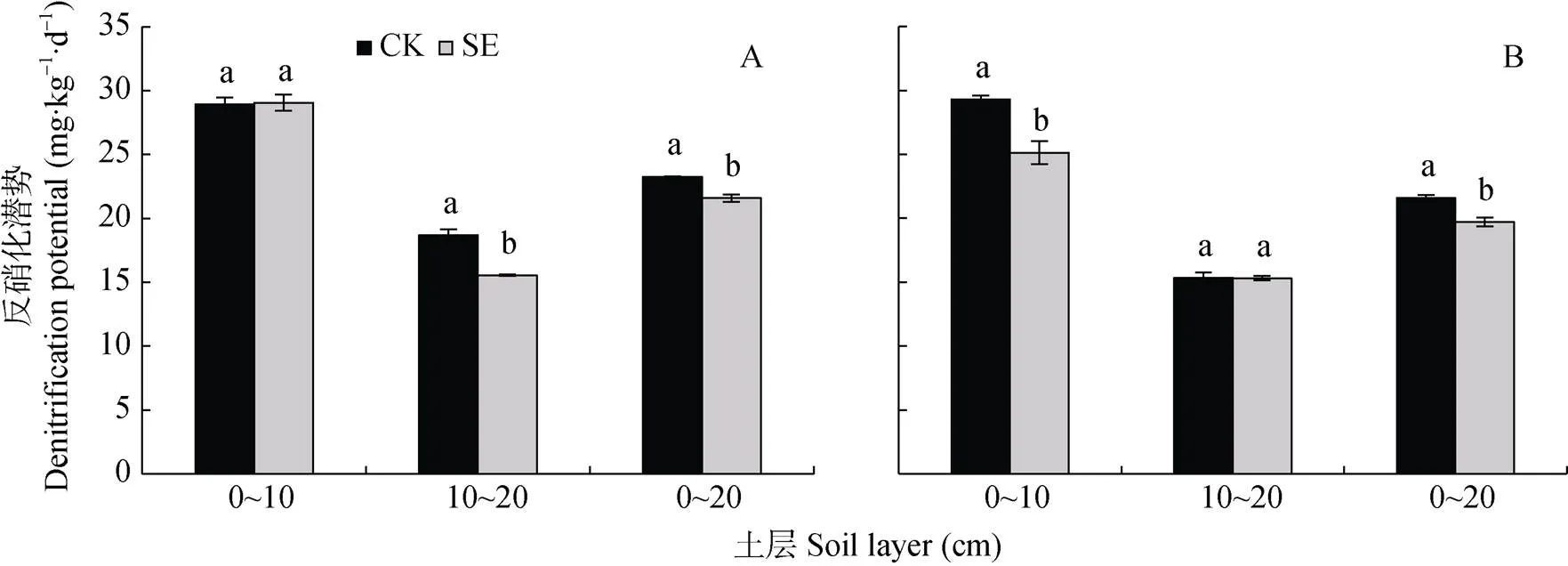
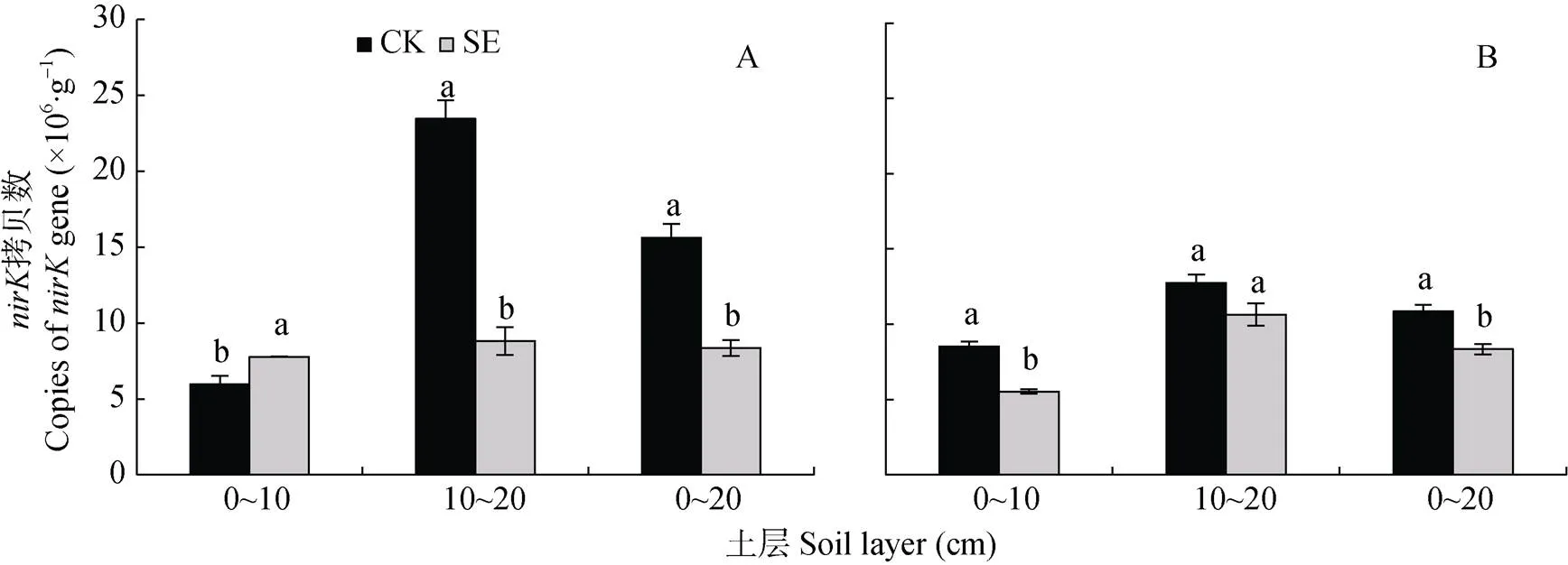
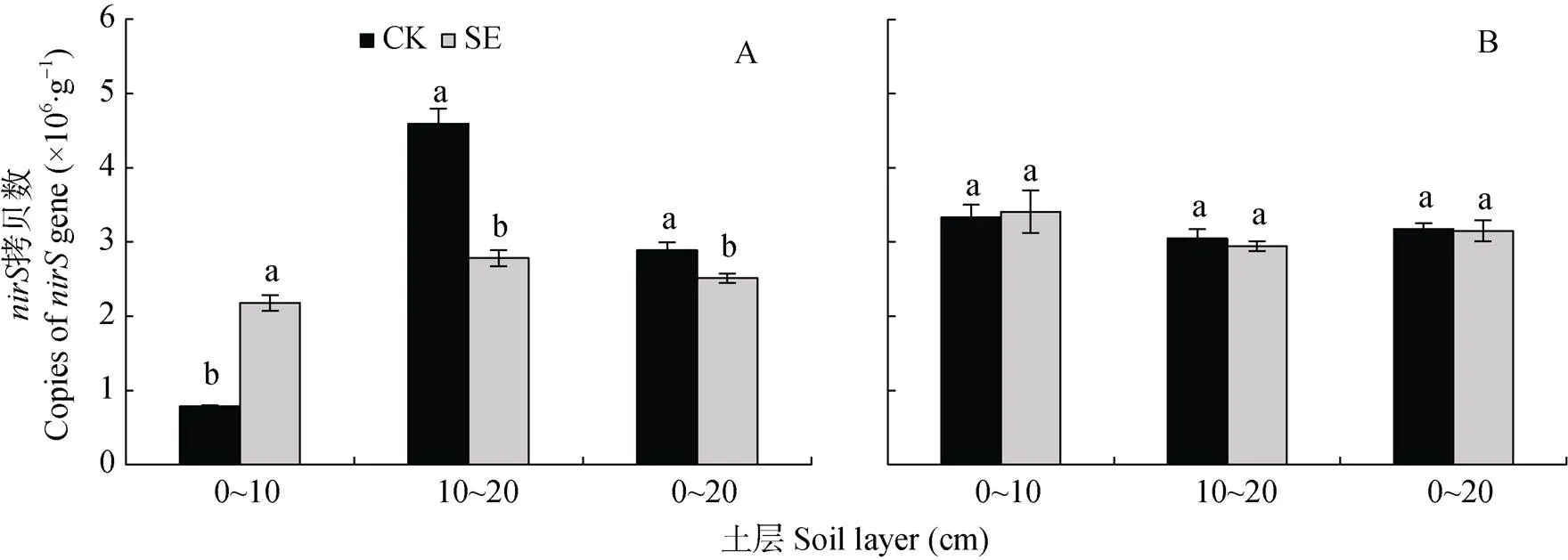
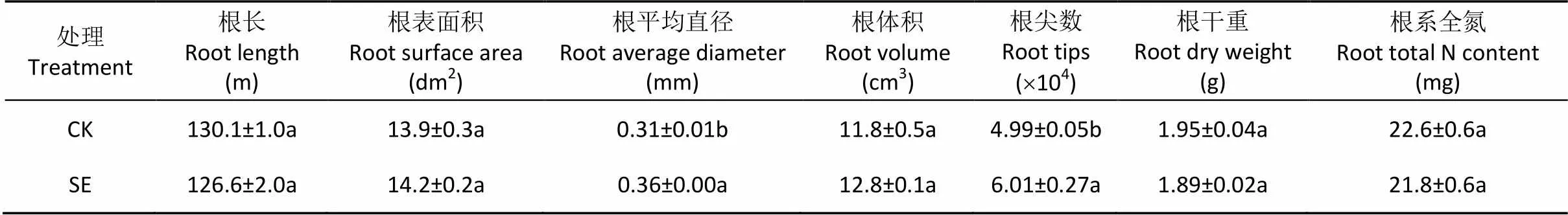
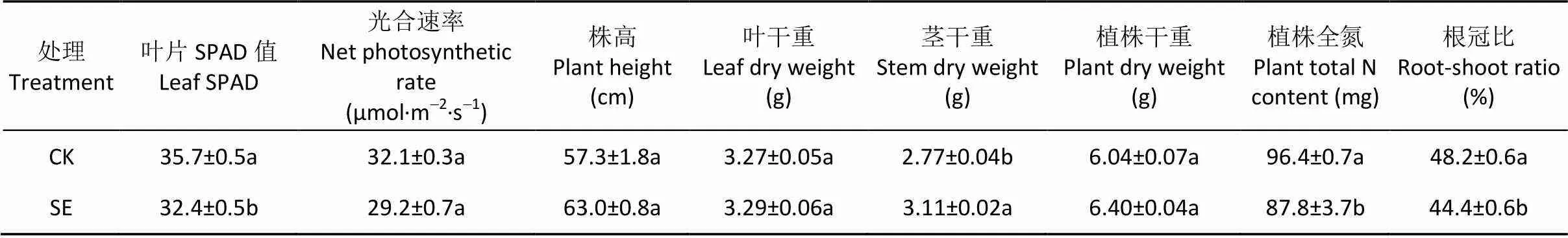
由图7可知, 根际和非根际, 0~20 cm土层的反硝化潜势大小为: SE处理 图5 土层交换对非根际(A)和根际(B)氨氧化古菌丰度的影响 CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示土层交换与对照处理间差异显著(<0.05)。CK: normal soil layers distribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05). 图6 土层交换对非根际(A)和根际(B)土壤反硝化能力的影响 CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示土层交换与对照处理间差异显著(<0.05)。CK: normal soil layers distribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05). 图7 土层交换对非根际(A)和根际(B)土壤反硝化潜势的影响 CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示土层交换与对照处理间差异显著(<0.05)。CK: normal soil layers distribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05). 由图8可知, 0~20 cm土层非根际SE处理的拷贝数较CK处理显著降低, 主要是因为10~20 cm土层SE处理的拷贝数较CK处理显著降低; 而根际SE处理的拷贝数较CK处理也显著降低。对比非根际, 根系使0~10 cm、10~20 cm土层CK和SE处理的根际拷贝数分别变化42.5%和–28.8%、–45.6%和20.5%(图8A, 图8B)。 图8 土层交换对非根际(A)和根际(B)土壤nirK拷贝数的影响 CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示土层交换与对照处理间差异显著(<0.05)。CK: normal soil layers distribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05). 由图9可知, 0~20 cm土层非根际SE处理的拷贝数显著低于CK处理, 而根际SE处理的拷贝数和CK处理无显著差异。对比非根际, 根系使0~10 cm、10~20 cm土层CK和SE处理的根际拷贝数分别变化321.5%和56.4%、–33.6%和5.8%(图9A, 图9B)。 图9 土层交换对非根际(A)和根际(B)土壤nirS拷贝数的影响 CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示土层交换与对照处理间差异显著(<0.05)。CK: normal soil layers distribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05). 从表2可知, 与CK处理相比, SE处理显著增加根平均直径和根尖数。但两处理在根表面积和根系全氮含量等其他根系指标上均无显著差异。 由表3可知, 与CK处理相比, SE处理使玉米植株的SPDA值和根冠比显著降低, 植株全氮含量也降低8.9%(<0.05)。SE处理对植株干重无差异影响, 但显著提高了茎秆干重(<0.05)。 由表4可知, 非根际土硝化潜势与NO3--N和土壤可溶性有机氮呈极显著正相关(<0.01), 同时三者也与AOB-拷贝数呈极显著正相关(<0.01), 而AOA-拷贝数与硝化潜势的相关性不显著。反硝化能力与土壤可溶性有机碳和土壤呼吸呈极显著正相关(<0.01), 与和拷贝数的相关性未达到显著水平。但反硝化潜势与拷贝数呈极显著正相关(<0.01), 与拷贝数也达到显著相关水平(<0.05)。 表2 土层交换对玉米根系形态生理指标的影响 CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示非根际或根际土土层交换与对照处理间具有显著性差异(<0.05)。CK: normal soil layers distribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05). 表3 土层交换对玉米植株形态生理指标的影响 CK: 常规土层处理; SE: 土层交换处理。不同小写字母表示非根际或根际土土层交换与对照处理间具有显著性差异(<0.05)。CK: normal soil layers distribution; SE: soil layers exchange. Different lowercase letters represent significant difference between CK and SE treatments (< 0.05). 表4 土层交换后非根际土壤硝化、反硝化过程中测定变量之间的相关性 DOC: 可溶性有机碳; DON: 可溶性有机氮; SR: 土壤呼吸速率; NP: 硝化潜势; DC: 反硝化能力; DP: 反硝化潜势; AOB-: AOB拷贝数; AOA-: AOA拷贝数::拷贝数;:拷贝数。*:< 0.05; **:< 0.01. DOC: dissolved organic carbon; DON: dissolved organic nitrogen; SR: soil respiration; NP: nitrification potential; DC: denitrification capacity; DP: denitrification potential; AOB-: copies of AOB-gene; AOA-: copies of AOA-gene;: copies ofgene;: copies ofgene. 由表5可知, 根系全氮与根平均直径和根表面积呈极显著正相关(<0.01), 而植株全氮与根平均直径和根表面积则无显著相关性。根尖数与植株全氮呈显著负相关(<0.05)。根际土硝化潜势与植株全氮呈显著正相关(<0.05), 与根系全氮呈极显著正相关(<0.01)。根表面积×AOB拷贝数与根系全氮和植株全氮呈显著正相关(<0.05)。非根际土壤的反硝化能力与植株全氮呈显著负相关(<0.05), 根际土壤的反硝化能力与植株全氮呈极显著负相关(<0.01)。 土层交换通过改变土壤的物理、化学和生物性状, 影响作物的生长和氮素的利用[29-31]。本研究发现土层交换后, 玉米的植株氮素吸收会显著下降。土壤耕作可通过影响根系来控制个体和群体的发育[32]。土层交换后, 玉米根系的根尖数和根平均直径都显著增加。前人研究发现, 翻耕较免耕处理能显著增加玉米的根尖数, 但对根平均直径无显著影响[33-34]。本研究中, 根平均直径显著增加可能与两个处理下NH4+-N和NO3--N的含量和比例有关。一般来说NH4+-N会促进玉米中柱的发育, 有利于木质部形成, 进而促进根直径的增加[35]。本研究发现交换土层会显著降低根际的硝化潜势, 这将会相对增加NH4+-N的含量, 进而增加了根系的直径。玉米叶片SPAD值表征了叶片氮素含量[36]。土层交换后, 玉米叶片SPDA值显著降低, 可能是由土壤供氮能力显著降低导致的; 叶片光合性能的下降可能会进一步导致玉米吸氮效率的降低。但相关性分析发现, 它们与玉米植株氮素吸收相关性不显著。由此可见, 尽管土层交换会显著影响根系的根尖数、根平均直径和叶片SPAD, 但这些改变可能不是造成植株氮素吸收差异的主要原因。 表5 土层交换后玉米氮素吸收与土壤硝化、反硝化过程和植株及根系形态生理指标之间的相关性 NP: 硝化潜势; DC: 反硝化能力; DP: 反硝化潜势。*:< 0.05; **:< 0.01. NP: nitrification potential; DC: denitrification capacity; DP: denitrification potential. 比较土层交换后硝化潜势的改变发现, 尽管土层交换不会显著降低非根际土壤的硝化潜势, 但会显著降低根际土壤的硝化潜势。相关分析发现根际的硝化潜势与玉米的植株氮素吸收呈显著性正相关。可见, 土层交换会显著降低根际土壤硝化潜势, 进而降低作物的氮素利用效率。一般来说硝化作用降低会减少NO3-产生速率, 而NO3-作为阴离子, 迁移性较强, 容易造成淋洗和反硝化损失[37]。因此土层交换后硝化潜势降低, 应该有利于作物对氮素的吸收。但本研究中土壤的pH达到8.5, 将会增加氨的挥发损失[38]。这可能是硝化潜势下降, 而作物的氮素吸收显著降低的重要原因。AOB和AOA是硝化过程的主要执行者[25,39]。AOA是新的氨氧化微生物类群, 其广泛分布于各种生态系统中, 并且在诸多环境中其数量较AOB占明显优势, 在农田土壤中可能发挥着重要功能[40-42]。本研究发现土层交换后, AOA和AOB的种群丰度都会显著下降, 但在根际土壤中, AOB丰度显著下降, AOA反而上升。进行相关分析发现, 硝化潜势与AOB丰度呈显著正相关关系, 而与AOA没有显著相关关系。由此可以看出, AOB在根际土壤中发挥着重要功能。本研究进一步推测, 在根际环境中, AOB可能扮演着更为重要的角色。目前很多研究中, 常把根际土壤中的氮转化相关基因拷贝数直接与作物氮素吸收进行相关分析[43-44], 但是没有考虑作物的根表面积。因为根表面积和基因拷贝数相结合, 才更能代表真实的情况[45-46]。本研究发现, 根表面积和AOB拷贝数的乘积与作物的氮素吸收量呈现显著正相关关系, 可见AOB是影响作物氮素吸收的关键微生物。 除了硝化潜势发生改变外, 本研究注意到, 土层交换也会显著增加非根际和根际土壤的反硝化能力。反硝化是氮素损失的重要途径, 反硝化速率的提升, 意味着氮素气态损失加重。相关分析发现, 根际的反硝化能力与玉米的植株氮素吸收呈显著负相关关系。土层交换引起反硝化损失的加重, 可能受到土壤理化性状和反硝化微生物的影响。本研究发现, 与其他土壤环境因素相比, 土层交换会显著增加可溶性有机碳含量。可溶性有机碳是异养反硝化微生物的重要能量来源, 因此可溶性有机碳含量的富集会显著增加反硝化能力[47], 同时也增加了土壤呼吸速率。土壤呼吸速率的增加, 会升高土壤CO2浓度, 并进一步增进土壤厌氧环境, 促进反硝化的进行。当碳源充足条件下, 本研究发现土层交换后反而会导致反硝化潜势下降。由此可见可溶性有机碳是土层交换后反硝化速率的关键限制因子。除了受到可溶性有机碳和CO2浓度的影响外, 我们分析了和种群丰度的变化。研究发现土层交换后, 非根际土壤中和拷贝数都呈下降趋势, 而根际土壤中拷贝数保持显著下降趋势,却没有显著下降。相关分析表明,和拷贝数与反硝化潜势呈显著正相关的关系, 而与反硝化能力相关性不显著。这也进一步证实, 土层交换后可溶性有机碳而非或菌群丰度, 是反硝化能力的关键主导因子。 土层交换使玉米的氮素吸收率显著降低8.9%, 植株的叶片SPDA值和根冠比也都显著降低。土层交换后, 硝化速率的降低和反硝化速率的增强是玉米氮素利用效率降低的重要原因。AOB是硝化速率的主要驱动微生物, 在根际的氮素转化中发挥重要功能。土层交换导致的可溶性有机碳和土壤呼吸的增加, 可能是导致反硝化速率显著增高的主要原因。 [1] 张晶, 林先贵, 尹睿. 参与土壤氮素循环的微生物功能基因多样性研究进展[J]. 中国生态农业学报, 2009, 17(5): 1029-1034 ZHANG J, LIN X G, YIN R. Advances in functional gene diversity of microorganism in relation to soil nitrogen cycling[J]. Chinese Journal of Eco-Agriculture, 2009, 17(5): 1029-1034 [2] DAVIDSON E A, SWANK W T, PERRY T O. Distinguishing between nitrification and denitrification as sources of gaseous nitrogen production in soil[J]. Applied and Environmental Microbiology, 1986, 52(6): 1280-1286 [3] KOWALCHUK G A. Ammonia-oxidizing bacteria: a model for molecular microbial ecology[J]. Annual Review of Microbiology, 2001, 55(1): 485 [4] CAVAGNARO T R, JACKSON L E, HRISTOVA K, et al. Short-term population dynamics of ammonia oxidizing bacteria in an agricultural soil[J]. Applied Soil Ecology, 2008, 40(1): 13-18 [5] MILLER M N, ZEBARTH B J, DANDIE C E, et al. Crop residue influence on denitrification, N2O emissions and denitrifier community abundance in soil[J]. Soil Biology and Biochemistry, 2008, 40(10): 2553-2562 [6] ZUMFT W G. Cell biology and molecular basis of denitrification[J]. Microbiology and Molecular Biology Reviews: MMBR, 1997, 61(4): 533-616 [7] 范晓晖, 朱兆良. 旱地土壤中的硝化-反硝化作用[J]. 土壤通报, 2002, 33(5): 385-391 FAN X H, ZHU Z L. Nitrification and denitrification in upland soils[J]. Chinese Journal of Soil Science, 2002, 33(5): 385-391 [8] KHALIL K, MARY B, RENAULT P. Nitrous oxide production by nitrification and denitrification in soil aggregates as affected by O2concentration[J]. Soil Biology and Biochemistry, 2004, 36(4): 687-699 [9] BARRETT M, KHALIL M I, JAHANGIR M M, et al. Carbon amendment and soil depth affect the distribution and abundance of denitrifiers in agricultural soils[J]. Environmental Science and Pollution Research International, 2016, 23(8): 7899-7910 [10] 吕玉, 周龙, 龙光强, 等. 不同氮水平下间作对玉米土壤硝化势和氨氧化微生物数量的影响[J]. 环境科学, 2016, 37(8): 3229-3236 LYU Y, ZHOU L, LONG G Q, et al. Effect of different nitrogen rates on the nitrification potential and abundance of ammonia-oxidizer in intercropping maize soils[J]. Environmental Science, 2016, 37(8): 3229-3236 [11] BOLLMANN A, CONRAD R. Influence of O2availability on NO and N2O release by nitrification and denitrification in soils[J]. Global Change Biology, 1998, 4(4): 387-396 [12] BERNHARDT E S, LIKENS G E. Dissolved organic carbon enrichment alters nitrogen dynamics in a forest stream[J]. Ecology, 2002, 83(6): 1689-1700 [13] O'SULLIVAN C A, WAKELIN S A, FILLERY I R P, et al. Factors affecting ammonia-oxidising microorganisms and potential nitrification rates in southern Australian agricultural soils[J]. Soil Research, 2013, 51(3): 240-252 [14] KAMEWADA K. Vertical distribution of denitrification activity in an Andisol upland field and its relationship with dissolved organic carbon: Effect of long-term organic matter application[J]. Soil Science and Plant Nutrition, 2007, 53(4): 401-412 [15] 刘秋丽, 马娟娟, 孙西欢, 等. 土壤的硝化-反硝化作用因素研究进展[J]. 农业工程, 2011, 1(4): 79-83 LIU Q L, MA J J, SUN X H, et al. Research advancement on soil nitrification-denitrification and its influencing factors[J]. Agricultural Engineering, 2011, 1(4): 79-83 [16] 侯海军, 秦红灵, 陈春兰, 等. 土壤氮循环微生物过程的分子生态学研究进展[J]. 农业现代化研究, 2014, 35(5): 588-594 HOU H J, QIN H L, CHEN C L, et al. Research progress of the molecular ecology on microbiological processes in soil nitrogen cycling[J]. Research of Agricultural Modernization, 2014, 35(5): 588-594 [17] FUKA M M, BLAŽINKOV M, RADL V, et al. Effect of soil tillage practices on dynamic of bacterial communities in soil[J]. Agriculturae Conspectus Scientificus, 2015, 80(3): 147-151 [18] 赵亚丽, 郭海斌, 薛志伟, 等. 耕作方式与秸秆还田对土壤微生物数量、酶活性及作物产量的影响[J]. 应用生态学报, 2015, 26(6): 1785-1792 ZHAO Y L, GUO H B, XUE Z W, et al. Effects of tillage and straw returning on microorganism quantity, enzyme activities in soils and grain yield[J]. Chinese Journal of Applied Ecology, 2015, 26(6): 1785-1792 [19] 张雪靓, 孔祥斌. 黄淮海平原地下水危机下的耕地资源可持续利用[J]. 中国土地科学, 2014, 28(5): 90-96 ZHANG X L, KONG X B. Cropland sustainable use impacted by groundwater depletion in China’s HHH Plains[J]. China Land Sciences, 2014, 28(5): 90-96 [20] HAMONTS K, CLOUGH T J, STEWART A, et al. Effect of nitrogen and waterlogging on denitrifier gene abundance, community structure and activity in the rhizosphere of wheat[J]. FEMS Microbiology Ecology, 2013, 83(3): 568-584 [21] TAYLOR A E, ZEGLIN L H, DOOLEY S, et al. Evidence for different contributions of archaea and bacteria to the ammonia-oxidizing potential of diverse Oregon soils[J]. Applied and Environmental Microbiology, 2010, 76(23): 7691-7698 [22] ŠIMEK M, KALČÍK J. Carbon and nitrate utilization in soils: the effect of long-term fertilization on potential denitrification[J]. Geoderma, 1998, 83(3/4): 269-280 [23] YEOMANS J C, BREMNER J M, MCCARTY G W. Denitrification capacity and denitrification potential of subsurface soils[J]. Communications in Soil Science and Plant Analysis, 1992, 23(9/10): 919-927 [25] 王军, 申田田, 车钊, 等. 有机和无机肥配比对黄褐土硝化和反硝化微生物丰度及功能的影响[J]. 植物营养与肥料学报, 2018, 24(3): 641-650 WANG J, SHEN T T, CHE Z, et al. Effects of combination of organic and inorganic fertilizers on abundances of nitrifiers and denitrifiers and their function in yellow-cinnamon soil[J]. Plant Nutrition and Fertilizer Science, 2018, 24(3): 641-650 [26] KANDELER E, DEIGLMAYR K, TSCHERKO D, et al. Abundance of,,, andgenes of denitrifying bacteria during primary successions of a glacier foreland[J]. Applied and Environmental Microbiology, 2006, 72(9): 5957-5962 [27] THROBÄCK I N, ENWALL K, JARVIS A, et al. Reassessing PCR primers targeting,andgenes for community surveys of denitrifying bacteria with DGGE[J]. FEMS Microbiology Ecology, 2004, 49(3): 401-417 [28] 王晓辉. 生物炭对设施栽培土壤硝化和反硝化微生物群落的影响研究[D]. 北京: 中国科学院大学, 2013: 27-29 WANG X H. Effect of biochar on nitrifying and denitrifying microbe communities in greenhouse soils[D]. Beijing: University of Chinese Academy of Sciences, 2013: 27-29 [29] KATUPITIYA A, EISENHAUER D E, FERGUSON R B, et al. Long-term tillage and crop rotation effects on residual nitrate in the crop root zone and nitrate accumulation in the intemedlate vadose zone[J]. Transactions of the Asae, 1997, 40(5): 1321-1327 [30] 郑成岩, 于振文, 王东, 等. 耕作方式对冬小麦氮素积累与转运及土壤硝态氮含量的影响[J]. 植物营养与肥料学报, 2012, 18(6): 1303-1311 ZHENG C Y, YU Z W, WANG D, et al. Effects of tillage practices on nitrogen accumulation and translocation in winter wheat and NO3--N content in soil[J]. Plant Nutrition and Fertilizer Science, 2012, 18(6): 1303-1311 [31] 董文旭. 不同耕作措施对氮素总转化过程以及作物与环境影响[D]. 北京: 中国科学院遗传与发育生物学研究所, 2009 DONG W X. Effects of tillage practices on nitrogen transformation, crops and environment[D]. Beijing: University of Chinese Academy of Sciences, 2009 [32] 王玉贞, 李维岳. 玉米根系与产量关系的研究进展[J]. 吉林农业科学, 1999, 24(4): 6-8 WANG Y Z, LI W Y. Research progress on relationship between roots and yield of maize[J]. Jilin Agricultural Sciences, 1999, 24(4): 6-8 [33] 张音霄, 邹洪涛, 张玉龙, 等. 免耕年限对东北旱田土壤性质及玉米根系、产量的影响[J]. 土壤通报, 2015, 46(2): 433-437 ZHANG Y X, ZOU H T, ZHANG Y L, et al. Effects of no-tillage years on soil properties and maize growth[J]. Chinese Journal of Soil Science, 2015, 46(2): 433-437 [34] 邱红波, 何腾兵, 龙友华, 等. 免耕栽培对玉米根系性状及其产量的影响[J]. 贵州农业科学, 2011, 39(9): 55-57 QIU H B, HE T B, LONG Y H, et al. Effect of no-tillage cultivation on maize root characters and yield[J]. Guizhou Agricultural Sciences, 2011, 39(9): 55-57 [35] 杨丽琴, 夏小燕, 汪晓丽, 等. pH、氮素形态和Ca2+对玉米幼苗根系发育的影响[J]. 扬州大学学报: 农业与生命科学版, 2007, 28(4): 47-51 YANG L Q, XIA X Y, WANG X L, et al. Effects of pH levels, nitrogen forms and calcium ion on root development of maize seedlings[J]. Journal of Yangzhou University: Agricultural and Life Science Edition, 2007, 28(4): 47-51 [36] 党蕊娟, 李世清, 穆晓慧, 等. 施氮对半湿润农田夏玉米冠层氮素及叶绿素相对值(SPAD值)垂直分布的影响[J]. 中国生态农业学报, 2009, 17(1): 54-59 DANG R J, LI S Q, MU X H, et al. Effect of nitrogen on vertical distribution of canopy nitrogen and chlorophyll relative value (SPAD value) of summer maize in sub-humid areas[J]. Chinese Journal of Eco-Agriculture, 2009, 17(1): 54-59 [37] 范晓晖, 朱兆良. 我国几种农田土壤硝化势的研究[J]. 土壤通报, 2002, 33(2): 124-125 FAN X H, ZHU Z L. Potential of nitrification in the three soil profiles of China[J]. Chinese Journal of Soil Science, 2002, 33(2): 124-125 [38] 胡小凤, 王正银, 孙倩倩, 等. 缓释复合肥料在不同pH值紫色土中氨挥发特性[J]. 农业工程学报, 2009, 25(6): 100-103 HU X F, WANG Z Y, SUN Q Q, et al. Characteristics of ammonia volatilization of slow release compound fertilizer in different pH values of purple soils[J]. Transactions of the CSAE, 2009, 25(6): 100-103 [39] MINCER T J, CHURCH M J, TAYLOR L T, et al. Quantitative distribution of presumptive archaeal and bacterial nitrifiers in Monterey Bay and the North Pacific subtropical gyre[J]. Environmental Microbiology, 2007, 9(5): 1162-1175 [40] 刘晶静, 吴伟祥, 丁颖, 等. 氨氧化古菌及其在氮循环中的重要作用[J]. 应用生态学报, 2010, 21(8): 2154-2160 LIU J J, WU W X, DING Y, et al. Ammonia-oxidizing archaea and their important roles in nitrogen biogeochemical cycling: A review[J]. Chinese Journal of Applied Ecology, 2010, 21(8): 2154-2160 [41] 刘正辉, 李德豪. 氨氧化古菌及其对氮循环贡献的研究进展[J]. 微生物学通报, 2015, 42(4): 774-782 LIU Z H, LI D H. Ammonia-oxidizing archaea and their contribution to global nitrogen cycling: a review[J]. Microbiology China, 2015, 42(4): 774-782 [42] 贺纪正, 张丽梅. 氨氧化微生物生态学与氮循环研究进展[J]. 生态学报, 2009, 29(1): 406-415 HE J Z, ZHANG L M. Advances in ammonia-oxidizing microorganisms and global nitrogen cycle[J]. Acta Ecologica Sinica, 2009, 29(1): 406-415 [43] 周丽, 付智丹, 杜青, 等. 减量施氮对玉米/大豆套作系统中作物氮素吸收及土壤氨氧化与反硝化细菌多样性的影响[J]. 中国农业科学, 2017, 50(6): 1076-1087 ZHOU L, FU Z D, DU Q, et al. Effects of reduced N fertilization on crop N uptake, soil ammonia oxidation and denitrification bacteria diversity in maize/soybean relay strip intercropping system[J]. Scientia Agricultura Sinica, 2017, 50(6): 1076-1087 [44] LI Y L, FAN X R, SHEN Q R. The relationship between rhizosphere nitrification and nitrogen-use efficiency in rice plants[J]. Plant, Cell & Environment, 2008, 31(1): 73-85 [45] 王祎, 汤继华, 付延磊, 等. 不同氮水平下玉米苗期根系形态和氮吸收量的QTL定位[J]. 植物营养与肥料学报, 2017, 23(4): 942-956 WANG Y, TANG J H, FU Y L, et al. Mapping of QTLs for root morphology and nitrogen uptake of maize under different nitrogen conditions[J]. Plant Nutrition and Fertilizer Science, 2017, 23(4): 942-956 [46] ZHU S S, VIVANCO J M, MANTER D K. Nitrogen fertilizer rate affects root exudation, the rhizosphere microbiome and nitrogen-use-efficiency of maize[J]. Applied Soil Ecology, 2016, 107: 324-333 [47] 宋利娜. 农田施用可溶性有机碳源(葡萄糖)对土壤反硝化脱氮强度的影响[D]. 北京: 中国科学院大学, 2012 SONG L N. Effects of soluble organic carbon source (glucose) on denitrification and denitrification intensity in farmland[D]. Beijing: University of Chinese Academy of Sciences, 2012 Effects of soil layers exchange on key nitrogen transformation processes in soil and nitrogen utilization by maize* YANG Shuo1, JIN Wenjun1, HUANG Haimeng1, WANG Jun1, ZHOU Debao2, ZHAO Yangyang1, DONG Zhaorong1, SONG He1** (1. College of Agronomy, Anhui Agricultural University, Hefei 230036, China; 2. Suzhou Academy of Agricultural Sciences, Suzhou 234000, China) Soil layers are exchanged during tillage practices, which may change the nitrogen (N) transformation process by affecting the physicochemical and biochemical properties of the soil. In this study, the effects of soil layers exchange on the nitrification and denitrification of lime concretion black soil, maize growth, and N utilization were studied to provide a theoretical basis for selecting reasonable tillage methods, reducing N loss, and improving N use efficiency in the southern region of the Huang-Huai-Hai Plain.In an artificial climate chamber, a normal soil layer distribution (0-35 cm of soil placed in a root box according tosoil layers) was used as the control treatment (CK).0-10 cm and 10-20 cm soil layers were exchanged and placed in another group of root boxes, which were used as the soil layers exchange (SE) treatment group. A 20 μm nylon mesh was used to separate the rhizosphere and the bulk soil. To investigate the effects of soil layer exchange on soil N transformation, nitrification potential, respiration, denitrifying capacity, denitrification potential, physicochemical properties of the rhizosphere and bulk soil, as well as maize growth, and N use, total N content, and root morphology were investigated at the maize small trumpet stage. The results showed thatmaize N uptake in SE treatment was 8.9% lower than that of CK (0.05). Soil layer exchange significantly affected the rhizosphere rather than the bulk soil, which reduced its nitrification potential by 13.5% (< 0.05) and increased the denitrification capacity of the rhizosphere and the bulk soil by 36.6% (< 0.05) and 8.4% (< 0.05), respectively. Soil layers exchange increased the soluble organic carbon content of the rhizosphere and bulk soil by 11.7% (0.05) and 5.2%, respectively. Correlation analysis showed that nitrification potential was significantly positively correlated with the abundance of ammonia-oxidizing bacteria (AOB,= 0.91**), but was not significantly correlated with the abundance of ammonia-oxidizing archaea (AOA). Denitrification capacity was significantly positively correlated with soluble organic carbon and soil respiration (= 0.89**and 0.93**), but showed no correlation withorgene copy number. N uptake by maize plants was positively correlated with the nitrification potential of the rhizosphere and the total root surface area × AOB gene copy number (= 0.83*and 0.86*), but was significantly negatively correlated with denitrification capacity (= –0.88**). These results indicated that a decrease in the nitrification rate and an increase in the denitrification rate in lime concretion black soil could result in low N use efficiency by maize after soil layers exchange. The nitrification rate was driven more by AOB abundance. After soil layers exchange, soil soluble organic carbon was the key driving factor for denitrification capacity. Effective regulation of soil soluble organic carbon content is the key to improving crop nitrogen use efficiency under tillage conditions. Soil layer exchange; Maize; Rhizosphere; Nitrification; Denitrification; Nitrogen utilization , E-mail: songhesonghe@foxmail.com Apr. 8, 2019; May 20, 2019 S158.3 2096-6237(2019)10-1515-13 N E, LÓPEZ-GUTIÉRREZ J C, et al. Quantification of denitrifying bacteria in soils by nirK gene targeted real-time PCR[J]. Journal of Microbiological Methods, 2004, 59(3): 327-335 宋贺, 主要研究方向为低碳农业生产。E-mail: songhesonghe@foxmail.com 杨硕, 主要研究方向为低碳农业生产。E-mail: 1750372904@qq.com 2019-04-08 2019-05-20 * This study was funded by the National Key Research and Development Project of China (2017YFD0301307-05, 2016YFD0300205-03) and the Special Fund for Agro-scientific Research in the Public Interest of China (201503121-02). * 国家重点研发计划项目(2017YFD0301307-05, 2016YFD0300205-03)和公益性行业(农业)科研专项经费项目(201503121-02)资助 10.13930/j.cnki.cjea.190265 杨硕, 金文俊, 黄海蒙, 王军, 周得宝, 赵阳阳, 董召荣, 宋贺. 耕层土层交换对土壤氮素关键转化过程和玉米氮素利用的影响[J]. 中国生态农业学报(中英文), 2019, 27(10): 1515-1527 YANG S, JIN W J, HUANG H M, WANG J, ZHOU D B, ZHAO Y Y, DONG Z R, SONG H. Effects of soil layers exchange on key nitrogen transformation processes in soil and nitrogen utilization by maize[J]. Chinese Journal of Eco-Agriculture, 2019, 27(10): 1515-1527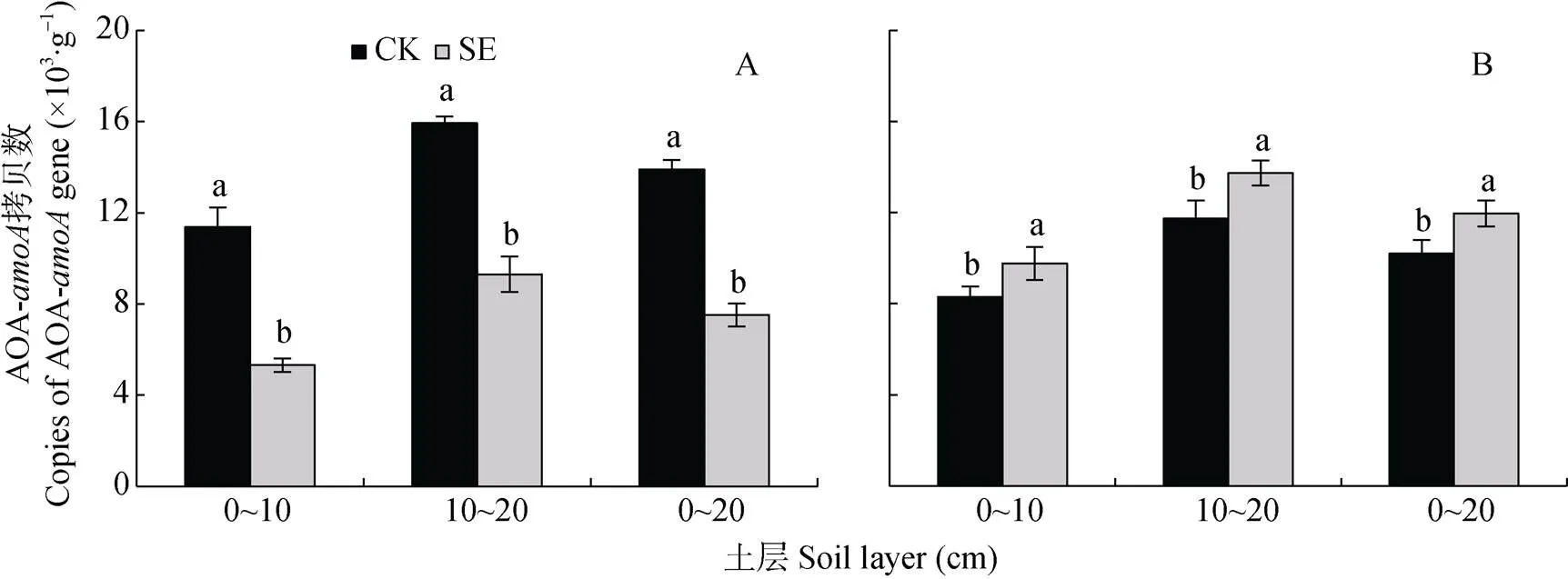
2.5 土层交换对玉米根系和植株形态生理指标的影响
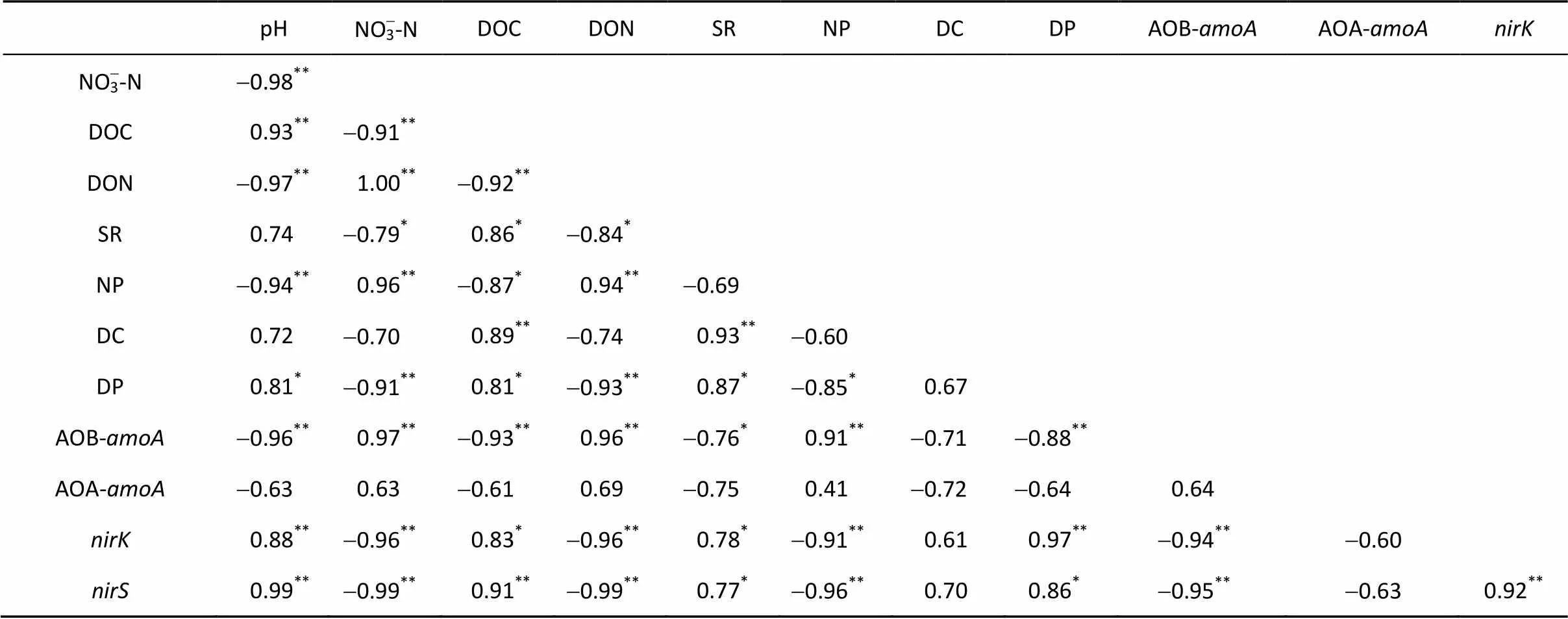
2.6 土层交换后土壤硝化、反硝化过程中测定变量之间的相关性
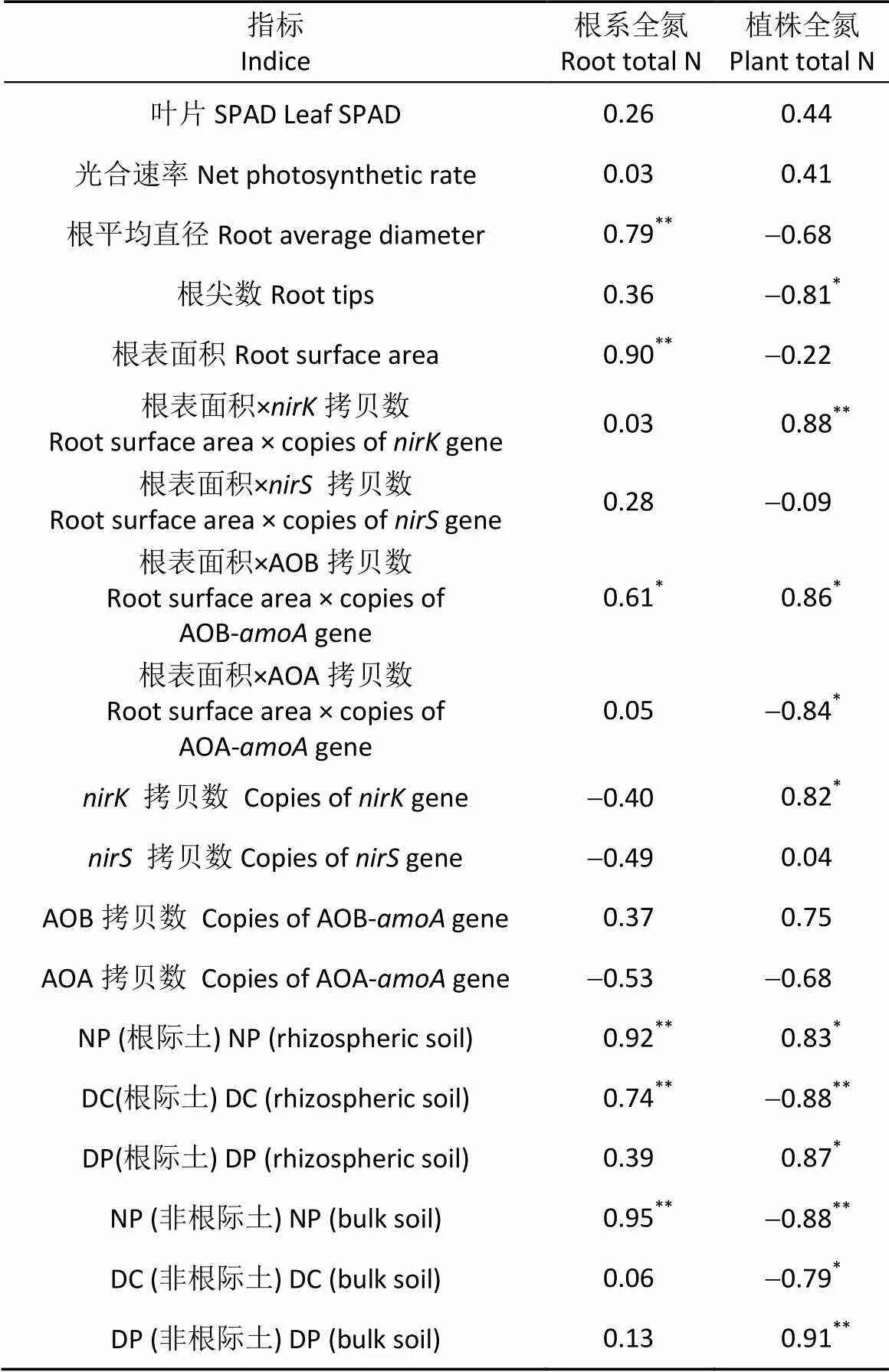
2.7 土层交换后玉米氮素吸收与土壤硝化、反硝化过程和植株及根系形态生理指标变量之间的相关性
3 讨论
4 结论
