植物乳杆菌素BM-1对大肠杆菌抑菌活性的研究
2019-10-14张含薇谢远红金君华张红星
张含薇,谢远红,金君华,张红星
(北京农学院食品科学与工程学院/食品质量与安全北京实验室/农产品有害微生物及农残安全检测与控制北京市重点实验室,北京102206)
乳酸菌是存在人和动物消化道中的益生菌,生长代谢过程中会产生乳酸、过氧化氢和细菌素等抑菌物质[1-2]。其中,细菌素是一类具有抑菌活性的蛋白质、多肽或前体多肽[3-4],它具有稳定、无毒、不改变食品本身的风味等特点,同时它可被机体消化道中一些蛋白酶降解,不会在体内堆积引起副作用[5]。根据化学结构,分子质量大小和稳定性将细菌素分为四类[6]:羊毛硫抗生素,分子量5 kD,含19~50个以上氨基酸分子[7];小分子的热稳定肽,其结构特征为N-末端信号肽序列长度为18~21个氨基酸,分为IIa、IIb、IIc类[7];热敏感的大分子蛋白,相对分子质量一般大于10 kD[7];复合型乳酸菌细菌素[7]。
其中IIa类乳酸菌细菌素是研究比较广泛及深入的一类乳酸菌细菌素[8]。它们是一类具有抑制革兰氏阳性单核增生李斯特菌活性、热稳定性未经修饰的小肽[8]。Jack RW等[9]在火腿中发现添加细菌素后单核增生李斯特菌的活菌数降低。岳喜庆等[10]发现BC-3细菌素可以抑制单核增生李斯特菌。马淑霞等[11]利用琼脂扩散法检测到片球菌素PA-1对单核增生李斯特菌有抑菌活性。现有的研究表明,大部分的IIa类乳酸菌细菌素具有对单核增生李斯特菌有抑菌活性,但对革兰氏阴性细菌的抑制作用研究较少。
前期研究中,课题组从传统发酵的肉制品中分离、鉴定得到1株植物乳杆菌BM-1的菌株。研究表明,植物乳杆菌BM-1能够代谢产生1种新型的IIa类乳酸菌细菌素BM-1,对部分革兰氏阳性细菌和革兰氏阴性细菌具有明显的抑菌活性,包括单核增生李斯特菌、金黄色葡萄球菌、沙门氏菌和大肠杆菌等[12]。在此基础上,本试验研究细胞和分子水平上植物乳杆菌素BM-1对大肠杆菌的作用。采用管碟法检测植物乳杆菌素BM-1对不同大肠杆菌的抑菌活性,并筛选出5株大肠杆菌通过生长曲线、活菌数、生物膜形成和实时荧光定量PCR的方法,多角度探究植物乳杆菌素BM-1对大肠杆菌的抑菌活性。
1 材料与方法
1.1 材料与试剂
单核增生李斯特菌(Listeriamonocytogenes)ATCC54003,大肠杆菌(Escherichiacoli)CGMCC1.2527,大肠杆菌(E.coli)CGMCC1.0506,大肠杆菌(E.coli)CGMCC1.2222,大肠杆菌(E.coli)CGMCC0.2154,大肠杆菌(E.coli)CGMCC1.2389,大肠杆菌(E.coli)CGMCC1.2168,大肠杆菌(E.coli)CGMCC1.8423,大肠杆菌(E.coli)CICC8099,大肠杆菌(E.coli)CMCC44102,大肠杆菌(E.coli)CMCC44103,大肠杆菌(E.coli)ATCC25922,大肠杆菌(E.coli)ATCC8739,植物乳杆菌BM-1(Lactobacillusplantarum)均来自实验室保存。
MRS肉汤,MRS琼脂培养基,LB培养基[13],制备培养基使用的试剂均为国产分析纯级;硫酸铵,购于国药集团化学试剂有限公司;琼脂(Agar),购于北京奥博星生物技术有限公司;3500Da透析袋,购于北京瑞达恒辉科技发展有限公司;PrimeScriptTM1st cDNA Synthesis Kit,购于TAKARA公司;结晶紫,购于北京陆桥技术有限公司;TB GreenTMPremix Ex TaqTMII,购于TAKARA公司。
1.2 试验仪器
DL-CJ-1NDII超净台,北京东联哈尔仪器制造有限公司;LHS-100CH恒温恒湿箱,上海一恒科技有限公司;DYY-6DCP-32B型恒流电泳仪,北京六一仪器厂;GL-21M-台式冷冻离心机,上海沪湘仪离心机仪器有限公司;WBS-100微生物比浊法测定仪,北京先驱威锋技术开发公司。
1.3 试验设备
BT2202S电子天平,德国Starorius集团;FD-1A-80真空冷冻干燥机,德国CHRIST公司;Biologic LP阳离子交换系统,美国伯乐公司;酶标测试仪,美国Bio Rad公司;StepOnePlus Real-Time PCR System,美国ABI公司。
1.4 试验方法
1.4.1 植物乳杆菌素BM-1的制备 取-80 ℃冷冻保藏的植物乳杆菌BM-1的菌株,以2%接种量接种于MRS肉汤中,37 ℃恒温培养12 h后,以相同接种量至1 L MRS肉汤中进行扩大培养,37 ℃恒温培养20 h,9 000 r/min,离心15 min,发酵上清液中加入硫酸铵,至终饱和度为75%(如1 L上清液加516 g硫酸铵),4 ℃沉淀12 h,9 000 r/min离心15 min,100 mL去离子水溶解沉淀形成粗提溶液。粗提溶液透析过夜,利用阳离子交换层析得到植物乳杆菌素BM-1溶液,真空冷冻干燥48 h,得到纯化的植物乳杆菌素BM-1粉末,采用牛津杯法测定植物乳杆菌素BM-1的效价[14]。
1.4.2 大肠杆菌的菌悬液制备 以2%的接种量接种于5 mL LB培养基中,37 ℃振荡培养12 h。用0.85%的生理盐水梯度稀释为10-1、10-2、10-3、10-4、10-5、10-6,充分混匀。吸取1 mL于平板底部,倒入LB固体培养基15~20 mL左右,混匀,放在37 ℃的培养箱中培养18~24 h,进行菌落计数,找出合适的梯度,使菌悬液达到1×102和1×107CFU/mL,保存备用。
1.4.3 植物乳杆菌素BM-1抑制大肠杆菌活性的测定 以12株大肠杆菌为指示菌株,采用管碟法做抑菌试验[15]。吸取100 μL大肠杆菌(约1×107CFU/mL)于平皿底部,倾注LB固体培养基15~20 mL左右,充分混匀,静置凝固。在每个平皿中等距离放置牛津杯4个,每个牛津杯中加入100 μL纯化的植物乳杆菌素BM-1(效价512 Au/mL)及无菌水作为空白对照,37 ℃恒温培养8~10 h,测量抑菌圈直径,每个菌株做3个平行试验。
1.4.4 植物乳杆菌素BM-1对大肠杆菌生长和活菌数的测定 取生长至对数期的大肠杆菌菌液,将菌液稀释成含活菌数为1×102CFU/mL的菌悬液,取200 μL菌悬液加入到10 mL含植物乳杆菌素BM-1(效价512 Au/mL)的LB液体培养基中,并置于37 ℃,分别用OD540nm微生物比浊仪,每隔30 min测定,共测24 h;活菌计数,每隔4 h取样,共测24 h;以未加植物乳杆菌素BM-1的菌悬液为对照组,绘制出植物乳杆菌素BM-1作用下大肠杆菌的生长曲线和活菌数曲线[16]。
1.4.5 植物乳杆菌素BM-1对大肠杆菌生物膜形成的测定 取生长至对数期的大肠杆菌菌液,将菌液稀释成含活菌数为1×102CFU/mL的菌悬液,取100 μL菌悬液加入到100 μL含植物乳杆菌素BM-1(效价512 Au/mL)LB液体培养基中,同时设以未加植物乳杆菌素BM-1的菌悬液为对照组,以LB液体培养基为空白对照。将96孔板在37 ℃条件下恒温培养24 h,用PBS冲洗3次除去浮游菌体,充分干燥后每孔加入100 μL 1 %结晶紫染料,染色10 min,倾倒染液并以无菌水冲洗3次,吹干;加200 μL的95%乙醇,复溶30 min;酶标仪590 nm测定吸光值;每组做3次平行试验[17]。
1.4.6 植物乳杆菌素BM-1对大肠杆菌甘露糖磷酸转移酶基因表达的测定 采用玻璃珠-酚仿法提取RNA。根据吴思琪[18]等的方法进行总核酸的提取,消化DNA,最后用PrimeScriptTM1st cDNA Synthesis Kit合成cDNA。
实时荧光定量PCR体系10 μL 2×SYBR Premix ExTaqII,上下游引物各1 μL,0.4 μL ROX染料,4.5 μL ddH2O,1 μL cDNA模板,反应总体积为20 μL。所有待测样品均设3个重复,并用去离子水代替模板做阴性对照。PCR反应体系:95 ℃ 5 min,95 ℃ 10 s,57 ℃ 15 s,72 ℃ 30 s。采用2-ΔΔCt法分析基因的相对表达量。所用引物manYF(5′-CCAACCCAACAGATGTAGAGCG-3′),manYR(5′-TGACGGAATGCCATACCACC-3′);manZF(5′-ACCAGACGGGCAAAGAACAC-3′),manZR(5′-CGCAGTAGCCACATACAAGCAA-3′);27F(5′-CGTATTCACCGTGGCATTCTG-3′),149R(5′-GAGCAAGCGGACCTCATAAA-3′)。
1.4.7 数据处理与分析 本研究采用Spss 18.0软件对试验结果进行统计分析,组间数据比较采用单因素方差分析(one-way ANOVA)以P<0.05表示显著差异。
2 结 果
2.1 植物乳杆菌素BM-1抑制大肠杆菌活性的测定
采用牛津杯抑菌法测定植物乳杆菌素BM-1对12株大肠杆菌的抑菌效果见图1。与牛津杯内径6.00 mm相比,植物乳杆菌素BM-1对12株大肠杆菌均有不同程度的抑制作用。为进一步探究植物乳杆菌素BM-1对大肠杆菌的作用方式,选取5株不同敏感型大肠杆菌,分别是1株具有明显抑菌活性的大肠杆菌CGMCC1.8723(抑菌圈直径为15.00 mm),3株对植物乳杆菌素BM-1敏感性稍低的大肠杆菌CGMCC1.2527(抑菌圈直径为12.97 mm),大肠杆菌CGMCC1.0506(抑菌圈直径为11.87 mm),大肠杆菌CGMCC1.2222(抑菌圈直径为11.58 mm)和1株抑菌活性低的大肠杆菌CICC8099(抑菌圈直径为6.23 mm)。
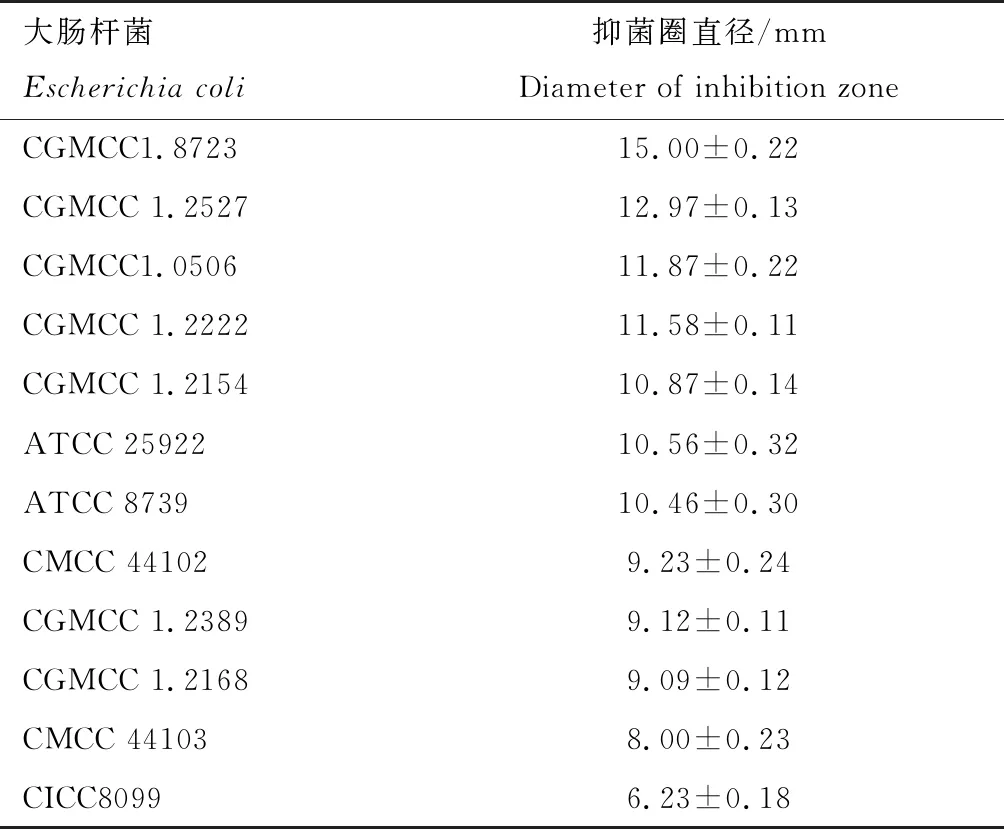
表1 植物乳杆菌素BM-1对大肠杆菌抑菌活性Tab.1 Antibacterial activity of plantaricin BM-1 against Escherichia coli
注:牛津杯内径为6.00 mm;ATCC,American type culture collection; CMCC,National center for medicial culture collection;CICC,China center of industrial culture collection。
Note: The diameter of Oxford cup was 6.00 mm; ATCC, American type culture collection; CMCC, National center for medicial culture collection; CICC, China center of industrial culture collection.
2.2 植物乳杆菌素BM-1对大肠杆菌生长曲线的测定
菌株的生长曲线可以直观观察到植物乳杆菌素BM-1的抑制情况。将2.1试验得到的5株大肠杆菌进行生长曲线的测定,以正常培养的大肠杆菌为对照,结果如图1所示,菌株4 h进入对数生长期,并保持正常的生长状态。当加入植物乳杆菌素BM-1后5株菌的生长曲线均出现不同程度的变化。大肠杆菌CGMCC1.8723在12 h后,植物乳杆菌素BM-1作用效果显著,OD值有一定程度增加,但始终低于对照组。说明植物乳杆菌素BM-1对大肠杆菌的生长速度有抑制作用。
2.3 植物乳杆菌素BM-1对大肠杆菌活菌数的测定
通过活菌计数进一步分析植物乳杆菌素BM-1对5株大肠杆菌的抑制效果。如图2所示,5株大肠杆菌呈现典型的生长规律。其中大肠杆菌CGMCC1.8723在4、8、12 h正常菌株的活菌数分别为4.568、7.112、8.776 lgCFU/mL。添加植物乳杆菌素BM-1的活菌数分别为3.396、5.936、8.274 lgCFU/mL,显著低于对照组大肠杆菌活菌数。表明植物乳杆菌素BM-1对大肠杆菌CGMCC1.8723前12 h的生长具有明显的抑制作用。

注:CK:对照组;F:添加植物乳杆菌素BM-1的试验组。Note: CK: Control group; F: Test group addingplantaricin BM-1.图1 植物乳杆菌素BM-1作用的大肠杆菌的生长曲线Fig.1 Growth curves of E. coli under with plantaricin BM-1 treatment

注:CK:对照组;F:添加植物乳杆菌素BM-1的试验组。Note: CK: Control group; F: Test group addingplantaricin.图2 植物乳杆菌素BM-1作用的大肠杆菌的活菌计数Fig.2 Viable count of E. coli under with plantaricin BM-1 treatment
2.4 植物乳杆菌素BM-1对大肠杆菌生物膜的测定
生物膜是细菌生长的一种保护模式,保护细菌在恶劣的环境下生存[19]。植物乳杆菌素BM-1对大肠杆菌生物膜形成的影响见图3。添加植物乳杆菌素BM-1后与未添加的对照组相比有显著差异(P<0.05),其中植物乳杆菌素BM-1作用效果最明显的是大肠杆菌CGMCC1.8723,对生物膜的抑制率达38.9%,抑制效果一般是大肠杆菌CGMCC1.2527,大肠杆菌CGMCC1.0506,大肠杆菌CGMCC 1.2222和大肠杆菌CICC8099。结果表明,植物乳杆菌素BM-1对大肠杆菌生物膜的形成有明显抑制效果。

图3 植物乳杆菌素BM-1对大肠杆菌生物膜的形成量Fig.3 Biofilm formation of E. coli under with plantaricin BM-1 treatment
2.5 植物乳杆菌素BM-1对大肠杆菌甘露糖磷酸转移酶基因表达的影响
采用玻璃珠-酚仿法进行5株大肠杆菌RNA的提取,结果如图4所示,提取的RNA分别为23S、16S、5SrRNA,可清晰看到无DNA条带,说明RNA提取成功。
通过实时荧光定量PCR检测植物乳杆菌素BM-1添加对5株大肠杆菌manY和manZ基因(参与甘露糖转运系统是IIC和IID蛋白的编码基因)表达量的影响。结果如图5所示,加入植物乳杆菌素BM-1后,manY和manZ在其中4株大肠杆菌中均有不同程度表达。与未添加植物乳杆菌素BM-1的对照组相比,大肠杆菌CGMCC1.0506的manY基因表达显著升高8.40倍(P<0.05)。大肠杆菌CGMCC1.8723的manZ基因表达显著升高7.26倍(P<0.05)。添加植物乳杆菌素BM-1导致大肠杆菌的甘露糖磷酸转移酶系统编码基因表达量升高。

注: M:Marker DL2000;1:大肠杆菌CICC8099;2:大肠杆菌CGMCC1.0506;3:大肠杆菌CGMCC1.8723;4:肠杆菌CGMCC1.2527;5:大肠杆菌CGMCC1.2222。Note:M:MarkerDL2000;1:E. coli CICC8099; 2:E. coli CGMCC1.0506; 3:E. coli CGMCC1-8723; 4:E. coli CGMCC1-2527; 5:E. coli CGMCC1.2222.图4 玻璃珠-酚仿法提取RNA的电泳图Fig.4 Extraction of RNA by glass bead-phenol method
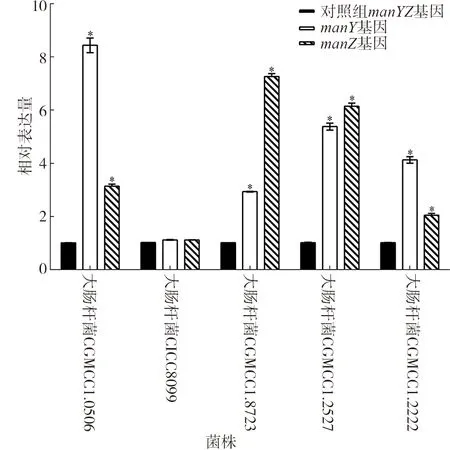
图5 甘露糖磷酸转移酶编码基因表达量Fig.5 Expression of mannose face acid transferase genes with plantaricin BM-1 treatment.
3 讨 论
IIa类细菌素成熟肽含37~48个氨基酸,其肽链分为两个区域:带正电荷、高保守的亲水性N端,低保守的亲水性或疏水性C端[20,8]。其中在高保守区N端含YGNGV/L共有序列,两个半胱氨酸形成一个二硫键[20,8]。两种模型解释IIa类细菌素的作用机制:细菌素会结合受体,导致内在通道的不可逆开放;细菌素将使用受体作为对接分子使肽更接近质膜,允许随后的细菌素插入与寡聚化形成孔[21]。有研究报道,IIa类细菌素是以细菌的甘露糖透性酶EIItMan为受体进行抑制作用,EIItMan受体属磷酸转移酶系统PTS,此系统在某些细菌中主要负责磷酸化和糖的运输[22]。甘露糖磷酸转移酶系统PTS中的EIItMan由IIA、IIB、IIC和IID四个结构域组成,例如单核增生李斯特菌的EIItMan由3个亚基组成,其中IIA和IIB为亲水性磷酸转移酶结构域位于细胞质,参与磷酸化;IIC和IID为亲水性磷酸转移酶结构域位于膜上,参与甘露糖转运[23]。本研究应用管碟法检测到植物乳杆菌素BM-1对12株大肠杆菌均有不同程度的抑制作用。本研究选取不同敏感型大肠杆菌5株,分析大肠杆菌的生长曲线、活菌数、生物膜形成情况,得到大肠杆菌对植物乳杆菌素BM-1有不同程度的敏感性,其中大肠杆菌CGMCC1.8723对植物乳杆菌素BM-1最为敏感。同时揭示植物乳杆菌素BM-1抑制模式在大肠杆菌的细胞膜上。通过实时荧光定量PCR检测到大肠杆菌的磷酸甘露糖转移酶系统编码基因的表达量均有显著变化,推测植物乳杆菌素BM-1可能作用于大肠杆菌的EIItMan受体。未来还需进一步探究植物乳杆菌素BM-1对大肠杆菌的作用机制。
