利用基因沉默技术验证东方百合‘Justina’番茄红素β-环化酶基因的功能
2019-10-14赵梦娜张克中崔金腾
赵梦娜,梁 晶,张克中,2,3,崔金腾,2,3*
(1.北京农学院园林学院,北京102206;2.城乡生态环境北京实验室,北京102206;3.北京市乡村景观规划设计工程技术研究中心,北京102206)
病毒介导的基因沉默技术(Virus Induced Gene Silencing,VIGS)是研究植物基因功能的一种重要方法,属于转录后基因沉默的现象[1]。VIGS利用携带目的基因片段的重组病毒载体侵染植株,随着病毒的复制和转录而特异性诱导序列同源基因mRNA降解或被甲基化等修饰,使植物内源基因的表达受到抑制,引起植物表型或生理指标的变化,进而阐明目的基因的功能[2-5]。烟草脆裂病毒(Tobacco Rattle Virus,TRV)是目前应用最广泛的VIGS载体,TRV作为病毒载体有诸多优点,如病毒症状较轻、沉默效率高且持久、各种组织均可产生沉默等,因而被广泛应用[6-10]。
类胡萝卜素是一类重要的天然色素的总称,常见的有胡萝卜素、叶黄素等,是一种辅助色素主要吸收蓝紫光,类胡萝卜素能将吸收的光能传递给叶绿素a,是光合作用不可少的光合色素,同时也是形成植物花色和叶色重要色素成分[11]。在类胡萝卜素代谢途径中番茄红素β-环化酶(Lycopene beta cyclase,LCYB)是调控胡萝卜素合成的一个关键酶[12]。东方百合(Liliumorientalis)为多年生草本球根植物,花姿优美伴有清香,是世界四大鲜切花之一[13-14],具有十分重要的经济价值,但对其叶色的调控尚未开展相关研究。本研究东方百合为试验材料,利用VIGS体系验证LoLcyB基因的功能,对深入开展东方百合叶色调控研究具有重要意义。
1 材料与方法
1.1 试验材料
以东方百合‘Justina’为材料。试验材料在2017年5月种植于北京农学院温室中,光照为自然光,采用湿帘降温加湿,白天室温不高于30 ℃,夜间室温不高于25 ℃。待种下的东方百合‘Justina’种球长出3~5片叶片时,取叶片为试验材料,用于后续总RNA的提取。植株生长30 d后进行VIGS验证。VIGS验证采用农杆菌菌株为GV3101和烟草脆裂病毒TRV。
1.2 LoLcyB 基因TRV载体构建
本实验室前期通过百合转录组文库分析得到LoLcyB基因CDS序列[15],采用Primer 5.0设计引物,在引物前端加入EcoR I和BamH I的酶切位点和保护碱基,定量验证TRV1和TRV2载体所需引物并根据TRV载体序列设计[16],由北京六合华大基因科技有限公司合成(酶切位点和保护碱基用下划线表示,见表1)。依照试验设计构建pTRV2-LoLcyB重组载体,重组载体pTRV2-LoLcyB的示意图见图1。采用T4 DNA Ligase Buffer对目的片段和目标载体进行连接,转入EscherichiacoliDH5α培养,选取阳性克隆菌液进行测序验证,并提取pTRV2-LoLcyB重组质粒,进行PCR扩增验证。
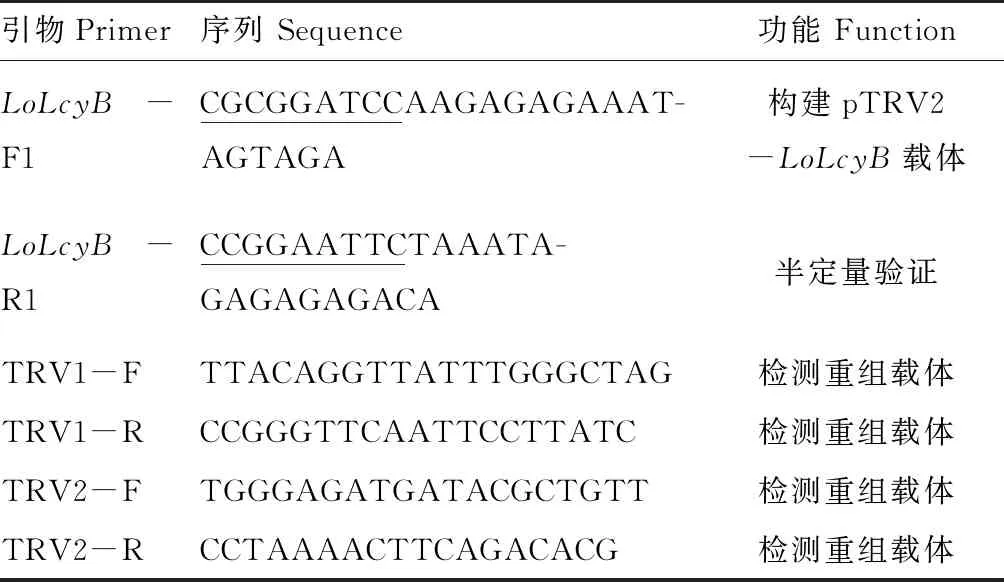
表1 引物序列Tab.1 The primer sequence

图1 重组载体pTRV2-LoLcyB的示意图Fig.1 Sketch map of pTRV2-LoLcyB recombinant vector
1.3 重组TRV载体侵染百合叶片
通过电击转化法,将pTRV1、pTRV2、重组质粒pTRV2-LoLcyB转至农杆菌GV3101,涂在含有50 μg/mL卡那霉素、50 μg/mL利福平、50 μg/mL庆大霉素的LB固体培养基上,倒置培养48 h。分别挑取含有pTRV1、pTRV2、pTRV2-LoLcyB载体的农杆菌单菌落,至2 mL含有50 μg/mL卡那霉素、50 μg/mL利福平、50 μg/mL庆大霉素的LB液体培养基,在28 ℃、200 r/min条件下过夜培养,取2 mL转入20 mL新鲜LB液体培养基,继续过夜培养。以LB液体培养基为对照,用分光光度计测量OD600值(OD600=0.6~0.8),4 000 r/min离心15 min弃上清,加入渗透缓冲液重悬;将OD600值调至2.0,使含有pTRV1质粒的菌液和含有pTRV2、pTRV2-LoLcyB质粒的菌液分别按1∶1比例均匀混合;28 ℃静置3 h,即获得TRV空载体和TRV-LoLcyB载体菌液。采用切割侵染法对东方百合幼苗的叶片进行侵染。用无菌试验手术刀分别蘸取已混合均匀的菌液,轻轻划割百合叶片的上表皮,划割伤口大小和多少可根据叶片进行适量选择,不蘸取菌液为对照组。被侵染的百合植株放置在白天25 ℃,晚上20 ℃,每天16 h光照的温室中培养,每天做好观测记录,7 d后取样。
1.4 色素含量测定
设置3个处理组,对照组(不侵染任何菌液的东方百合植株)、TRV空载体侵染组(用带有TRV空载体菌液侵染的东方百合植株)和TRV-LoLcyB重组载体侵染组(用带有TRV-LoLcyB载体菌液侵染的东方百合植株)。侵染7 d后,采集对照组、TRV空载体侵染组和TRV-LoLcyB重组载体侵染组侵染的百合叶片。采用分光光度法测定叶片的叶绿素a、叶绿素b、总类胡萝卜素、胡萝卜素、叶黄素的含量。充分研磨后,准确称取植物样品0.30 g,迅速加入25 mL提取液(丙酮∶无水乙醇=1∶1),充分吹打混匀,避光保存4 h。以提取液为空白对照,使用D30紫外分光光度计,测量470.0、474.0、485.0、642.5、649.0、665.0 nm波长下的吸光值[17]。设3次生物学重复。通过以下公式计算叶绿体色素含量:
叶绿素a(mg/L)=9.99A(665)-0.0872A(642.5)
叶绿素b(mg/L)=17.7A(642.5)-3.04A(665)
总类胡萝卜素(mg/L)=4.92A(474)-0.0255[a]-0.225[b]
胡萝卜素(mg/L)=12.6A(485)-6.00A(470)-0.0298[a]+0.336[b]
叶黄素(mg/L)= 10.2A(470)-11.5A(485)-0.0036[a]-0.652[b]
叶绿素a及叶绿素b的质量浓度用[a]、[b]表示。
叶绿素a(mg/g·FW)=叶绿素a(mg/L)×提取液总体积(L)/样品鲜重(g)
叶绿素b(mg/g·FW)=叶绿素b(mg/L×提取液总体积(L)/样品鲜重(g)
总类胡萝卜素含量(mg/g·FW)=总类胡萝卜素(mg/L)×提取液总体积(L)/样品鲜重(g)
胡萝卜素含量(mg/g·FW)=胡萝卜素(mg/L)×提取液总体积(L)/样品鲜重(g)
叶黄素含量(mg/g·FW)=叶黄素(mg/L)×提取液总体积(L)/样品鲜重(g)
1.5 LoLcyB基因的qRT-PCR分析
侵染7 d后,采集对照组、TRV空载体侵染组和TRV-LoLcyB重组载体侵染组侵染的百合叶片。提取对照组、TRV空载体侵染组和TRV-LoLcyB重组载体侵染组侵染的百合叶片中RNA,测定对照组、TRV空载体侵染组和TRV-LoLcyB重组载体侵染组侵染的百合叶片中LoLcyB基因的相对表达量。设3次生物学重复,每个重复3个单株。
1.6 数据分析
所得数据采用Excel软件进行整理,利用SPSS17.0软件的One-way ANOVA对数据进行统计分析。
2 结果与分析
2.1 pTRV2-LoLcyB重组载体的验证
将pTRV2-LoLcyB重组载体转化大肠杆菌(E.coli)DH5α后,提取阳性克隆菌液的质粒,以阳性克隆质粒为模板,使用TRV2-F和TRV2-R引物进行PCR扩增。经琼脂糖凝胶电泳检测(如图2),扩增出目的条带约为742 bp,符合重组载体的设计,281 bp片段是以TRV2空载体为模板扩增出的条带,重组载体插入LoLcyB基因片段大小为461 bp,证明pTRV2-LoLcyB重组载体构建成功。
2.2 LoLcyB基因沉默对百合叶色的影响
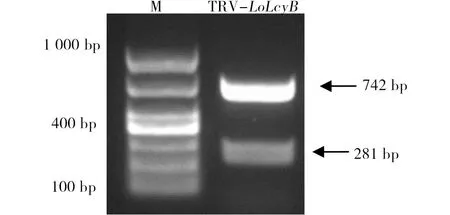
取东方百合种球种后30 d的植株上三片叶为材料进行侵染,侵染7 d后(图3),对照组叶片和TRV空载体侵染组的叶片未有明显的白化或黄化现象,其中TRV空载体侵染组的叶片仅在刀口边缘出现轻微黄化。而TRV-LoLcyB重组载体侵染组的叶片在刀口边缘明显黄化,并且沿着叶脉延伸,表明TRV-LoLcyB重组载体侵染组的叶片出现基因沉默。
注:281 bp条带模板为TRV2空载体,742 bp条带模板为pTRV2-LoLcyB重组载体。Note: The 281 bp allele is TRV2 empty vector, the 742 bp allele is pTRV2-LoLcyB recombinant vector.图2 LoLcyB基因片段的重组载体验证Fig.2 The verification of LoLcyB gene fragment in recombinant vector
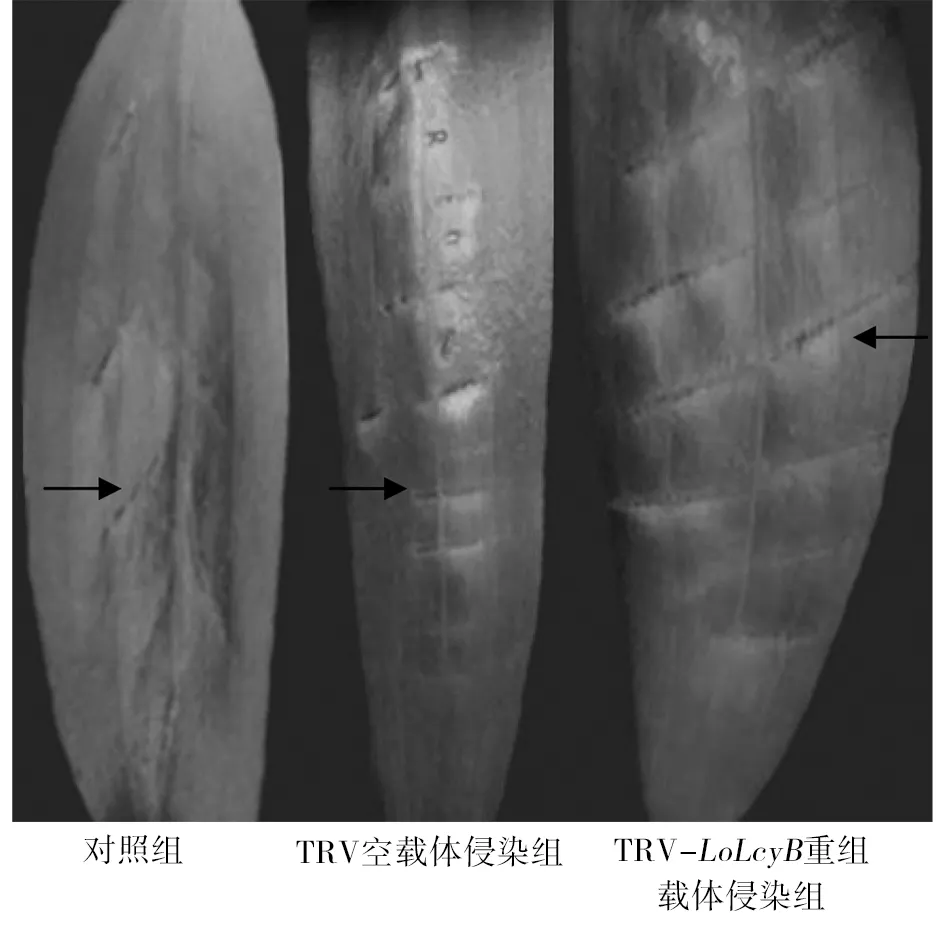
图3 LoLcyB基因沉默对东方百合叶片颜色的影响Fig.3 The effect of LoLcyB gene silencing on leave color in L. orientalis ‘Justina’
2.3 LoLcyB基因沉默对叶片色素积累的影响
图4显示了不同东方百合叶片中各种色素的含量。侵染后叶片类胡萝卜素含量:TRV-LoLcyB重组载体侵染组含量比对照组和TRV空载体侵染组分别减少了82.37%和80.47%(图4A);叶片胡萝卜素含量:TRV-LoLcyB重组载体侵染组含量比对照组和TRV空载体侵染组分别减少了80.008%和77.487%(图4B);叶片叶黄素含量:TRV-LoLcyB重组载体侵染组含量比对照组和TRV空载体侵染组分别减少了70.69%和67.77%(图4C)。利用SPSS17.0进行邓肯测验(在0.05水平),表明TRV-LoLcyB重组载体侵染组的叶片中总类胡萝卜素、胡萝卜素和叶黄素的相对含量均明显低于对照组叶片、TRV空载体侵染组的叶片中相对含量。而对照组叶片和TRV空载体侵染组的叶片中总类胡萝卜素、胡萝卜素和叶黄素的相对含量差异均不显著。另外,叶绿素a、叶绿素b的含量发生和类胡萝卜素相似的变化情况;TRV-LoLcyB重组载体侵染组的叶绿素a、叶绿素b含量比对照组和TRV空载体侵染组均有明显下降。
图4 LoLcyB基因沉默对东方百合叶片色素含量的影响Fig.4 The effect of LoLcyB gene silencing on the pigment contents in L. orientalis ‘Justina’ leaves
2.4 LoLcyB基因的qRT-PCR分析
试验分析对照组、TRV空载体侵染组和TRV-LoLcyB重组载体侵染组中百合叶片LoLcyB基因的相对表达量(图5)。TRV-LoLcyB重组载体侵染组LoLcyB基因表达量比对照组和TRV空载体侵染组分别减少了71.44%和66.48%。TRV-LoLcyB重组载体侵染组的叶片LoLcyB基因的表达量明显降低,而对照组叶片、TRV空载体侵染组的叶片LoLcyB基因的表达量并未出现较明显变化。
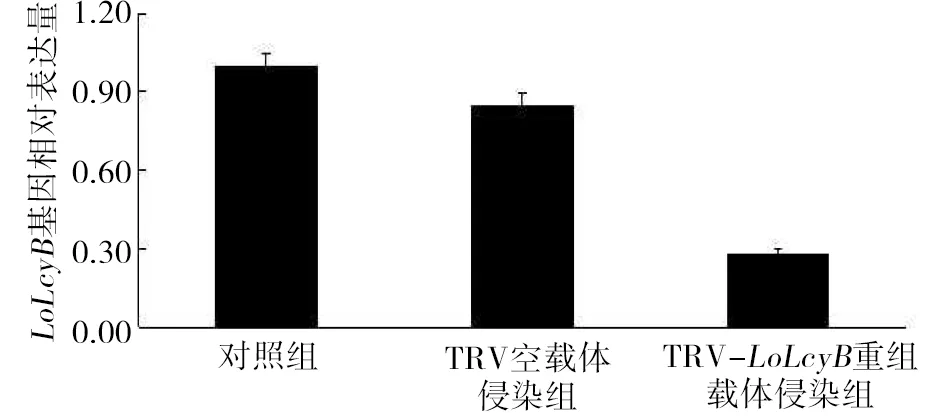
图5 东方百合叶片LoLcyB基因相对表达量Fig.5 The relative expression of LoLcyB gene in L. orientalis ‘Justina’ leaves
3 讨 论
类胡萝卜素代谢途径是调控东方百合叶色变化的重要途径,LoLcyB基因是类胡萝卜素代谢途径中的一个关键酶基因。前人研究表明,在类胡萝卜素代谢途径中,经LcyB基因和LcyE基因翻译得到的番茄红素β-环化酶和番茄红素ε-环化酶可以共同作用将番茄红素环化为α-胡萝卜素;番茄红素β-环化酶也可单独作用将番茄红素环化为β-胡萝卜素,这个分支反应对植物体内类胡萝卜素的含量有决定性作用[18-19]。VIGS技术在基因功能方面的研究已十分广泛,在植物的形态发育、信号传导和代谢途径等方面均有涉及,如植物程序性细胞死亡以及逆境应激等,已是一种很普遍的研究基因功能的方法[20-21]。VIGS技术在百合等植物上的应用正在不断深入,并且在植物花色、叶片、果实代谢等方面相关基因功能的鉴定及分子育种上均有广阔的应用前景[22-23]。本试验通过VIGS技术,采用烟草脆裂病毒载体构建了pTRV2-LoLcyB重组载体,利用切割侵染法对东方百合叶片进行侵染,发现侵染后叶片中LoLcyB基因表达量显著下调,即LoLcyB基因的沉默使番茄红素向下合成胡萝卜素途径受到阻碍导致叶片类胡萝卜素含量下降。LoLcyB基因参与东方百合叶片中类胡萝卜素和叶绿素合成的代谢调控。
东方百合LoLcyB基因功能的研究为深入探究类胡萝卜素的代谢途径在呈色方面的作用机理提供理论参考,另外本研究通过分析叶片中叶绿素含量的变化,发现和类胡萝卜素含量变化相同的情况,推测叶片中LoLcyB基因可能参与叶绿素代谢调控,对于其内在调控机理还需进一步研究。同时,VIGS体系在东方百合中的成功应用,为今后研究东方百合基因功能研究开拓新思路。
