地塞米松刺激猪内皮细胞对猪单核源树突状细胞内源性抗原递呈分子表达水平的影响
2019-10-14李志军张永红李焕荣李秋明
王 莹,吴 晗,李志军,张永红,李焕荣,李秋明*
(1.北京农学院动物科学技术学院,北京 102206;2.北京市动物疫病预防控制中心,北京 102600)
血管内皮细胞(VEC)可通过调节白细胞运输、炎性因子产生和与MHC-II分子相关的抗原递呈,使宿主对传染因子发生应答[1]。地塞米松(DSMS)是一种人工合成的糖皮质激素,普遍作为抗炎、抗过敏药使用[2]。有研究显示,地塞米松直接作用于单核细胞,对其分化具有明显的抑制作用[3],并且内皮源IL-8可在早期抑制体外培养的MoDC成熟[4]。
那么DSMS作用于内皮细胞后,使内皮源IL-8的分泌量降低,是否会间接对MoDC迁移与内源性抗原递呈功能有影响尚未见报道。本研究将模拟DSMS进入机体后刺激VEC,分别与分化和未分化的MoDC进行共培养,通过荧光定量PCR和多功能酶标仪检测,研究DSMS刺激VEC对MoDC迁移能力与抗原递呈功能的影响。
1 材料与方法
1.1 试验材料
细胞为猪髋动脉内皮细胞系(PIEC),购自中国科学院典型培养物保藏委员会细胞库上海生命科学研究院细胞资源中心,目录号是GN015。试验动物为长白、大白杂交断奶后仔猪,购自首农集团种猪育种中心,饲养于北京农学院动物房内。所有试验动物均通过PCR/RT-PCR检测PCV1、PCV2、PRRSV、PRV、PPV、CSFV病原,且结果均为阴性。地塞米松,购自阿拉丁公司;重组猪GM-CSF和IL-4,购自R&D公司,-20 ℃保存;超氧化物阴离子探针(Dihydroethidium,DHE),购自碧云天公司;无酚红RPMI 1640,购自Gibco公司。
1.2 试验方法
1.2.1 DSMS质量浓度筛选 常规方法培养PIEC,培养液使用含有10%胎牛血清的RPMI 1640细胞培养液。将细胞数量稀释为3×105个/孔,接种于无菌24孔板内,此时所使用的细胞培养液中加入不同质量浓度的DSMS,其质量浓度分别为10-2、10-3、10-4、10-5、10-6mg/mL。分别在48 h和5 d两个时间段收集细胞上清液,所收集的上清液通过ELISA检测IL-8的变化量,从而筛选出DSMS可下调IL-8分泌的合适质量浓度,用于后续研究。
1.2.2 CD14+单核细胞的纯化与诱导培养 采集猪前腔静脉外周血,参照文献[5]中的方法分离并纯化CD14+单核细胞,将其诱导为MoDC。
共培养方式分为两种,分别为诱导共培养与诱导后共培养。
诱导共培养是将分选出来的CD14+单核细胞接种在trans-well上室后直接与预先铺有PIEC的24孔培养板共培养;诱导后共培养是将CD14+细胞诱导为MoDC后,再转入预先铺有PIEC的24孔板中培养。
设置分组为DC单独培养组、PIEC共培养组、DSMS共培养组。每个分组均设置3个重复组。
DC组为CD14+细胞加入正常的诱导液;PIEC共培养组为CD14+细胞与PIEC中加入正常的诱导液;DSMS共培养组为CD14+细胞与PIEC中加入含有DSMS的诱导液。
1.2.3 MoDC迁移能力检测 收集MoDC并用HDE标记,37 ℃孵育45 min后,用无血清RPMI 1640培养基重悬,调整细胞至5×105个/mL,取100 μL标记好的MoDC加入到预先铺好的24孔transwell(5.0 μm)上室,下室加入质量浓度为200 ng/mL MCP-1的无血清RPMI 1640培养。37 ℃孵育8 h后,立即用多功能全自动定量绘图酶标仪测定下室内细胞相对荧光强度以分析细胞的相对迁移能力。
1.2.4 实时荧光定量PCR检测内源性抗原递呈分子 收集各组MoDC后提取总RNA,依照反转录试剂盒说明书操作,对所提取的RNA反转录以合成cDNA,RNA模板定量为2 μg。参考文献[6]中各分子引物(表1)进行实时荧光定量PCR检测。
1.2.5 统计分析 数据以均值±标准差表示,组间比较用F检验,以P<0.05为差异显著,P<0.01为差异极显著。

表1 细胞因子与β-actin Real-time FQ-PCR的扩增引物和PCR反应条件Tab.1 Primers and PCR conditions of real-time FQ-PCR for cytokines and β-actin
2 结 果
2.1 DSMS刺激PIEC质量浓度选择
DSMS刺激PIEC 48 h和5 d后,IL-8的分泌量变化见图1。当DSMS的质量浓度为10-3mg/mL时,48 h(图1A)与5 d(图1B)两个时间段内PIEC中IL-8的分泌量均显著下降。选择10-3mg/mL的DSMS质量浓度进行后续试验。
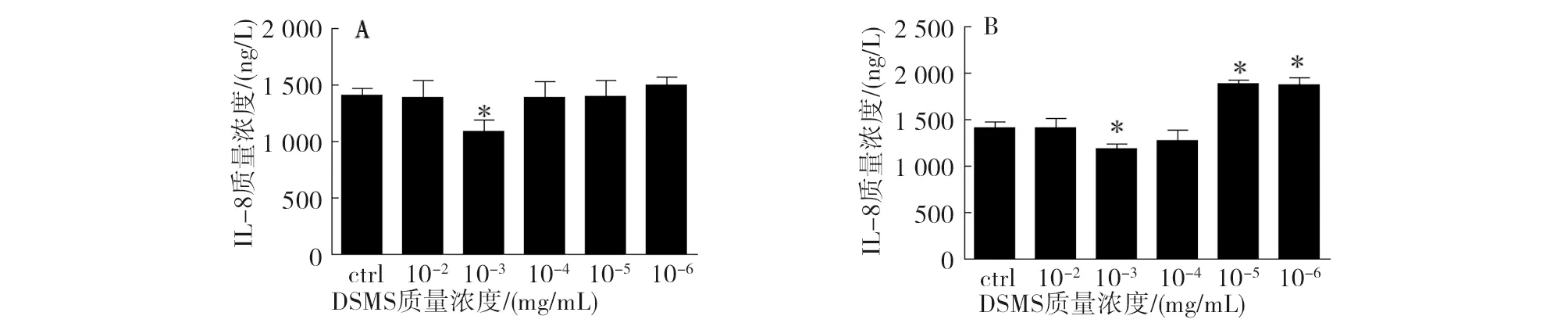
注:*表示差异显著(P<0.05)。note:* means P<0.05.图1 不同质量浓度的DSMS刺激PIEC 48 h(A)和5 d(B)后IL-8的变化Fig.1 Changes of IL-8 concentration in PIEC stimulated by different concentrations of DSMS in 48 h(A) and 5 d(B)
2.2 MoDC迁移能力检测
由图2可见,其他两种共培养方式的MoDC荧光强度显著低于MoDC单独培养组,尽管DSMS共培养组荧光强度高于未刺激共培养组,但差异不显著。表明DSMS在与PIEC、MoDC共培养过程中,对其迁移能力影响不大。
2.3 实时荧光定量PCR检测
检测结果如图3所示。两种共培养方式中,各组的UBP mRNA和calreticulin mRNA未见明显变化,而对LMP7 mRNA和MHC-I mRNA的检测结果中可以发现,共培养中表达水平均显著低于DC单独培养组,且DSMS共培养组中表达水平明显高于PIEC共培养组,提示DSMS可上调LMP7 mRNA和MHC-I mRNA的表达。
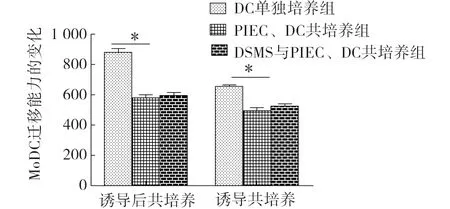
注:同一共培养方式中标注*表示差异显著(P<0.05)。Note: * mean significant difference in the same method of co-culture (P<0.05).图2 两种不同共培养方式中MoDC的迁移能力Fig.2 Migration of MoDC in two differentconditions of co-culture
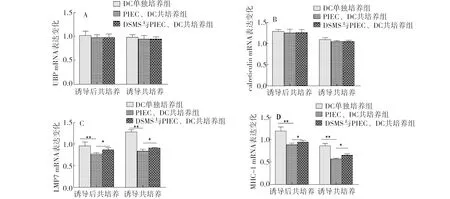
注:同一共培养方式中标注*表示差异显著(P<0.05),标注**表示差异极显著(P<0.01)。Note: * mean significant difference (P<0.05) and ** mean very significant difference (P<0.01) in the same method of co-culture.图3 MoDC中内源性抗原递呈分子的表达水平Fig.3 Expression level of endogenous antigen presenting molecules in MoDC
3 讨 论
DSMS作为一种典型的糖皮质激素,具有抗炎、抗过敏、抗病毒的药理作用。研究显示,DSMS可以抑制上皮细胞、内皮细胞和单核细胞分泌IL-8[7],本试验通过检测DSMS作用PIEC后IL-8分泌情况,筛选具有抑制IL-8分泌的合适质量浓度,以探索DSMS对单核树突状细胞免疫作用的影响。
当外周的DC识别抗原后,摄取携带抗原穿过淋巴管,向淋巴结迁移,最终到达次级淋巴器官,将抗原递呈给初始T细胞和B细胞并激活[8],只有DC从外周迁移到次级淋巴器官时,才能激活免疫反应,所以DC的迁移过程对于T淋巴细胞免疫反应至关重要[9],摄取到病毒的DC成功迁移到淋巴器官是内源性抗原递呈功能的关键。本研究显示在两种共培养方式中,PIEC共培养组与DSMS共培养组MoDC的迁移能力均显著低于DC单独培养组,但PIEC共培养组与DSMS共培养组相比并没有明显差异,说明PIEC可降低MoDC的迁移能力,而DSMS对MoDC迁移能力的影响并不大。
LMP7和UBP在促进抗原肽生成过程中起到关键性作用。LMP7可以上调蛋白酶体对疏水性和碱性氨基酸残基肽键的断裂[4],产生更适合肽段与MHC-I优先结合[10]。有研究表明LMP7基因敲除的小鼠显示出MHC-I抗原递呈功能显著下降[11]。UBP能阻止蛋白酶体降解目的蛋白,控制抗原肽的合成[12-13]。Calnexin能促进MHC-I重链和轻链的结合,保护重链免受降解。Calnxin在MHC-I异构化后被钙网蛋白取代。钙网蛋白的缺失直接导致MHC-I不能负载抗原肽并降低MHC-I的稳定性[14-15],进而导致抗原肽生成受到抑制、抗原递呈功能也会显著下降。本研究显示两种共培养中,经过DSMS刺激后的分组中,UBP mRNA和calreticulin mRNA变化不明显,而LMP7 mRNA与MHC-I mRNA的变化显著高于未刺激组,表明DSMS引起的内皮源IL-8下调后抗原肽的生成不再受到抑制,MHC-I mRNA与抗原复合肽能够顺利结合,从而有利于内源性抗原递呈能力的提升。DSMS对微血管内皮细胞功能的影响是否与髋动脉内皮细胞一致有待进一步探索。
总之,DSMS的刺激可下调内皮源IL-8的分泌,DSMS刺激PIEC后,对MoDC迁移能力没有影响,但可上调MoDC中LMP7 mRNA和MHC-I mRNA的表达水平,为进一步完善DSMS的作用机理提供思路。
