慢病毒介导的SUMO1P3基因表达对胃癌细胞侵袭、迁移、黏附能力及EMT的影响
2019-10-14任喜尚杨洁郑凤龙
任喜尚 杨洁 郑凤龙
(郑州澍青医学高等专科学校临床医学系,河南 郑州 450064)
胃癌死亡率居恶性肿瘤首位,近些年的发病率有上升趋势〔1〕。肿瘤发生发展涉及多基因、多信号,已有多项研究表明基因异常表达可影响胃癌增殖、侵袭迁移和黏附〔2,3〕。上皮细胞间质转化(EMT)是指上皮细胞在某些特定生理病理条件下,转化为具有间质样表型细胞的生物学过程〔4〕。EMT参与肿瘤侵袭转移、胚胎发育、组织纤维化等多种生理及病理过程。研究表明,发生EMT的肿瘤细胞,细胞侵袭和迁移能力明显增强,更易发生远处转移及周围组织浸润〔5〕。也有研究表明降低肿瘤细胞EMT可抑制细胞侵袭和迁移能力〔6〕。小泛素样修饰物基因(SUMO)是存在于所有真核生物的保守序列,SUMO1P3是SUMO假基因家族一员,有研究表明,沉默胰腺癌细胞SUMO1P3表达可抑制细胞增殖、迁移及侵袭能力,可能与其抑制EMT过程有关〔7〕。胃癌细胞中SUMO1P3也呈高表达,其表达与肿瘤大小、分化、淋巴结转移等有关〔8〕,SUMO1P3对胃癌细胞生物学特性影响研究尚未清楚。本研究以慢病毒为载体沉默胃癌细胞SUMO1P3表达,旨在研究SUMO1P3基因对胃癌细胞增殖、侵袭、迁移和黏附能力的影响。
1 材料与方法
1.1实验细胞及慢病毒 人胃癌BGC-823细胞购自中科院上海细胞生物学研究所。SUMO1P3 siRNA慢病毒载体由美国Sigma设计合成包装。
1.2试剂和仪器 胎牛血清(FBS)、RPMI1640培养基均购自美国Gibco;噻唑蓝(MTT)购自美国Sigma;Transwell细胞培养板及Matrigel胶均购自美国BD;聚氰基丙烯酸正丁酯(BCA)蛋白定量试剂盒购自美国Pierce;SUMO1P3、E-钙黏蛋白(cadherin)、波形蛋白(Vimentin)和α-SMA抗体均购自美国Abcam;酶标仪购自美国BIORAD。
1.3细胞培养 BGC-823细胞用含10% FBS的RPMI1640培养基,于5%体积分数CO2、37℃恒温培养箱常规传代培养。
1.4siRNA慢病毒转染 取生长状态良好的BGC-823细胞,用绿色荧光染料CFSE标记后以5×104/孔浓度接种细胞于6孔板,无抗生素的RPMI1640培养液培养细胞24 h,待细胞达40%~60%的汇合度时进行转染,转染参照LipofectamineTM RNAi MAX转染试剂盒说明。实验分组:空白组不作处理;NC组转染阴性对照病毒载体(把RNA干扰病毒所使用的干扰序列换成无序、无干扰作用的碱基);si-SUMO1P3组转染SUMO1P3基因的siRNA慢病毒载体。将含siRNA慢病毒及阴性对照病毒的转染试剂与细胞共孵育5 h,加入新鲜培养液继续孵育,48 h后通过Western印迹检测转染效果。
1.5转染效果检测 适量放射免疫沉淀法(RIPA)裂解液常规提取转染siRNA慢病毒的细胞总蛋白,BCA法定量蛋白。取50 μg蛋白上样,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电转至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉封闭膜后,加一抗(1∶500稀释的SUMO1P3、E-cadherin、Vimentin和α-SMA抗体)4℃过夜,加二抗〔辣根过氧化物酶(HRP)标记的1∶2 000稀释的兔抗鼠IgG〕,37℃孵育1 h,TBST洗涤。加电化学发法(ECL)试剂,曝光3 min,暗室中显影、定影。用Image-J软件行图像条带灰度值分析。以GAPDH为内参,SUMO1P3、E-cadherin、Vimentin和α-SMA与GAPDH灰度值比值为蛋白相对表达量。实验重复3次。
1.6细胞活力检测实验 将转染siRNA慢病毒的BGC-823细胞接种于96孔板,每孔5×103个,转染24、48、72 h,每孔加入MTT试剂(5 mg/ml)20 μl,37℃孵育4 h,每孔加入二甲基亚砜(DMSO)150 μl,震荡5 min,酶标仪测定570 nm波长吸光度(A)值。实验重复3次。
1.7细胞侵袭能力检测实验 将500 μg Matrigel铺在Transwell小室滤膜上,37℃孵育2 h使胶凝固。Transwell小室上室加100 μl转染siRNA慢病毒48 h的细胞悬液,Transwell小室下室加600 μl含10% FBS的RPMI1640培养液,37℃孵育24 h,吸弃上室液体,棉签轻拭掉Matrigel胶及未侵袭的细胞,4%多聚甲醛固定及结晶紫染色后,使用倒置显微镜(×400)随机选择5个视野,计数穿膜细胞数,取均值。实验重复3次。
1.8细胞迁移能力检测实验 实验步骤大体同1.7,差异在于聚碳酸多孔滤膜表面未铺Matrigel。
1.9细胞黏附力检测实验 胰酶消化转染siRNA 慢病毒48 h的细胞,将细胞浓度调整为5×104个/ml,接种细胞悬液于96孔,每孔100 μl,培养箱中孵育5、30、60 min,更换培养液,取出未贴壁细胞,MTT法检测各个孔A值。方法同1.6。
1.10统计学方法 采用SPSS21.0软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1各组SUMO1P3蛋白表达 si-SUMO1P3组SUMO1P3蛋白表达(0.052±0.005)明显低于空白组(0.668±0.065,P<0.05),NC组(0.679±0.068)与空白组差异无统计学意义(P>0.05);3组比较差异有统计学意义(F=130.613,P=0.000),见图1。
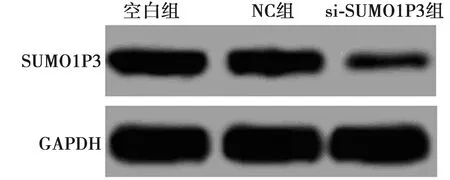
图1 Western印迹检测SUMO1P3蛋白表达
2.2各组BGC-823细胞活力比较 si-SUMO1P3组BGC-823细胞24、48、72 h细胞活力均显著低于空白组(P<0.05)。见表1。
2.3各组BGC-823细胞侵袭和迁移能力比较 与空白组比较,si-SUMO1P3组细胞侵袭和迁移能力明显降低(P<0.05)。见图2,表2。
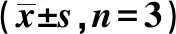
表1 各组BGC-823细胞活力比较
与空白组比较:1)P<0.05;下表同

图2 抑制SUMO1P3表达对BGC-823细胞侵袭(×400)
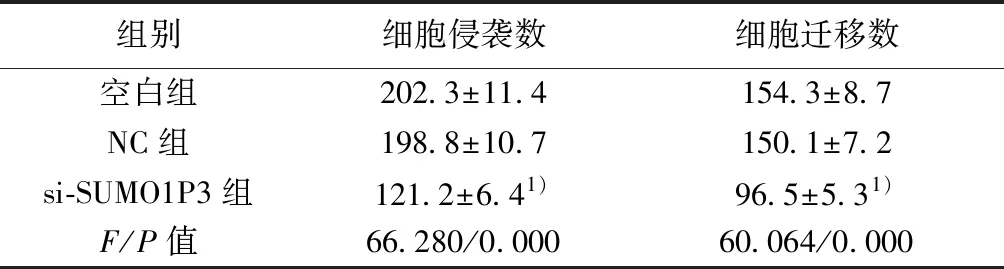
组别细胞侵袭数细胞迁移数空白组202.3±11.4154.3±8.7NC组198.8±10.7150.1±7.2si-SUMO1P3组121.2±6.41)96.5±5.31)F/P值66.280/0.00060.064/0.000
2.4各组BGC-823细胞黏附能力比较 si-SUMO1P3组在接种30 min和60 min细胞黏附能力均明显低于空白组(P<0.05)。见表3。
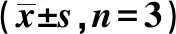
表3 各组BGC-823细胞黏附能力比较
2.5各组EMT相关蛋白表达比较 与空白组比较,si-SUMO1P3组E-cadherin表达明显升高,Vimentin和α-SMA表达明显降低(P<0.05)。见图3、表4。
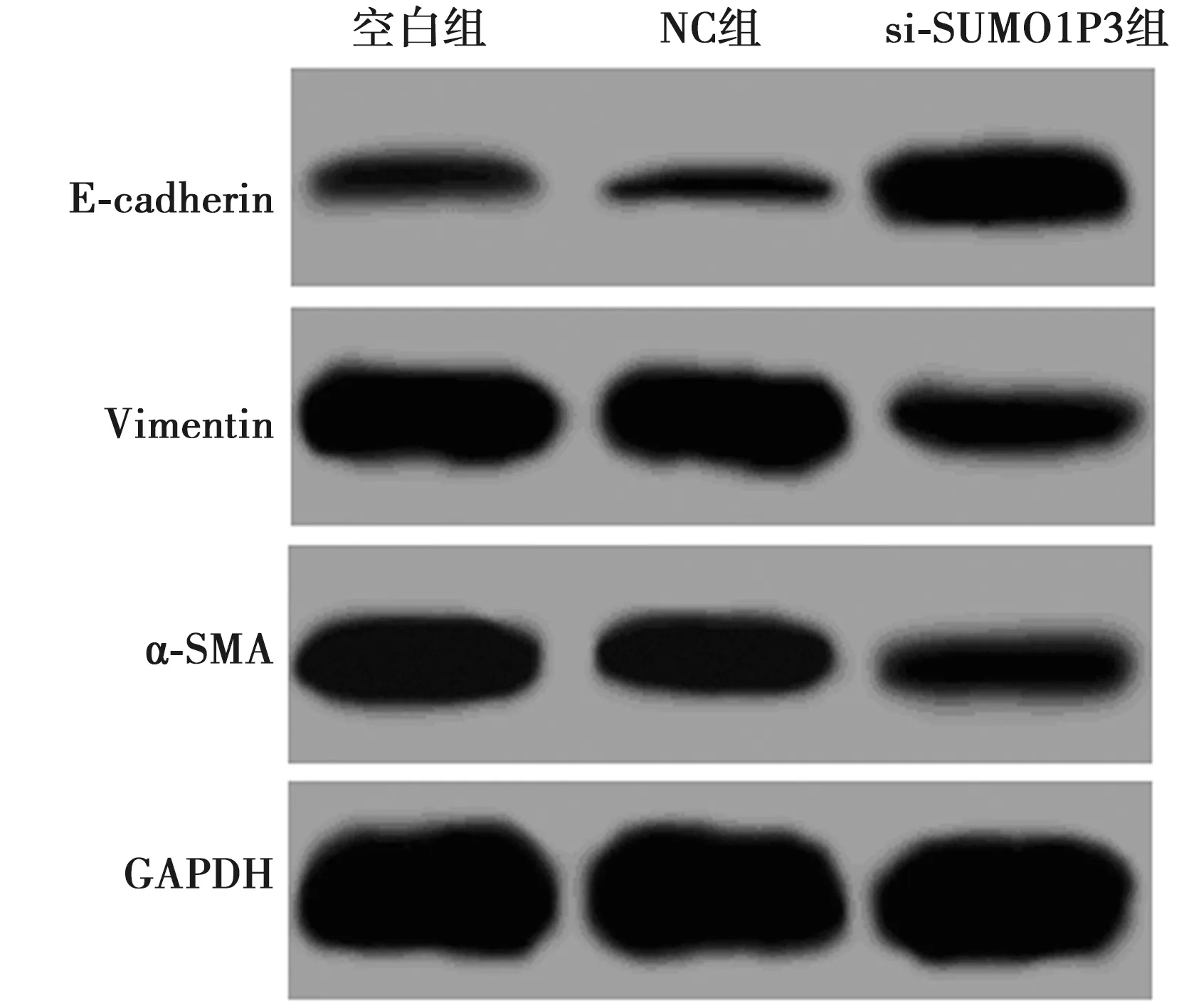
图3 Western印迹检测各组细胞EMT相关蛋白表达
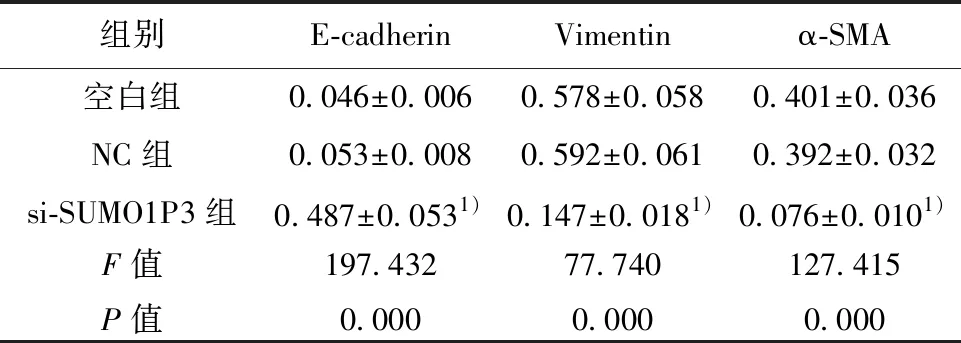
组别E-cadherinVimentinα-SMA空白组0.046±0.0060.578±0.0580.401±0.036NC组0.053±0.0080.592±0.0610.392±0.032si-SUMO1P3组0.487±0.0531)0.147±0.0181)0.076±0.0101)F值P值197.4320.00077.7400.000127.4150.000
3 讨 论
肿瘤发生发展是一个多基因、多阶段、多因素的复杂过程,肿瘤相关基因与肿瘤发生发展密切相关,对肿瘤分子生物学特性及机制研究具有重要意义。SUMO是存在于所有真核生物的保守序列,有SUMO1、SUMO2、SUMO3和SUMO4 4条编码蛋白基因,SUMO1、SUMO2和SUMO3在人体各种组织和细胞中广泛存在,参与细胞核转运、凋亡、转录调节等细胞过程,SUMO1有8条假基因,SUMO1P3是SUMO假基因家族成员之一,研究表明SUMO1P3影响肿瘤发生发展〔9〕。研究显示,膀胱癌SUMO1P3基因上调表达与组织学分级及晚期TNM分期呈正相关,沉默SUMO1P3 表达可抑制癌细胞增殖、迁移和诱导凋亡〔10〕;结直肠癌中SUMO1P3表达明显高于正常组织,沉默SUMO1P3表达可阻滞细胞于G1期,抑制细胞增殖,促进细胞凋亡〔11〕。胃癌中SUMO1P3研究较少。有研究显示,胃癌细胞中SUMO1P3也呈现高表达,其表达与肿瘤大小、分化、淋巴结转移等有关〔8〕。本研究旨在SUMO1P3表达对胃癌细胞侵袭迁移及黏附能力的影响。
RNA干扰(RNAi)是由RNA双链介导的在转录后沉默基因的现象,作为一种新的、强有力的研究工具,具有快速、高效、序列特异性及易操作等优点,使用RNAi技术治疗肿瘤、遗传性疾病、炎症等已成为研究热点,目前RNAi技术在肿瘤方面研究已有迅速发展〔12,13〕,在胃癌治疗中也取得了一定进展。研究表明,通过RNAi技术抑制基因表达可降低胃癌细胞生长。如有RNAi介导的NOX4基因沉默可通过JAK激酶(JAK2)/信号转录与转录因子(STAT)3信号抑制胃癌细胞侵袭能力〔14〕;通过RNAi技术抑制肝肠钙黏连蛋白(CDH17)基因表达可抑制胃癌细胞增殖,诱导细胞凋亡〔15〕。本研究结果显示,SUMO1P3表达降低可抑制BGC-823细胞增殖、侵袭、迁移及黏附力,提示抑制SUMO1P3表达可降低胃癌细胞生长。
EMT与肿瘤侵袭转移密切相关,通过EMT,上皮来源肿瘤细胞失去极性,细胞间黏附能力降低,同时获得较高的侵袭迁移能力和抗凋亡能力,甚至降低细胞外基质能力,使肿瘤细胞更易发生远处转移〔16,17〕。因此EMT是肿瘤进展的重要环节。EMT过程发生依赖于E-cadherin等上皮表型蛋白表达下调,Vimentin、α-SMA等间质表型相关蛋白过表达〔18〕。E-cadherin是EMT发生的重要标志,在包括胃癌在内的多种肿瘤中表达降低,低表达E-cadherin的胃癌患者生存期更短,而胃癌中重新表达E-cadherin可降低细胞侵袭和迁移能力〔19〕。侵袭迁移能力强、分化强的肿瘤细胞Vimentin和α-SMA往往高表达,而抑制其表达可降低肿瘤细胞侵袭和迁移能力〔20,21〕。本研究结果提示,SUMO1P3表达抑制可通过EMT途径抑制胃癌细胞侵袭迁移。
