睾丸蛋白聚糖1对胆囊癌细胞生长凋亡的影响及机制
2019-10-14赵鹏伟柳严刘延张佳伟刘江伟黄建钊
赵鹏伟 柳严 刘延 张佳伟 刘江伟 黄建钊
(贵州省人民医院肝胆外科,贵州 贵阳 550002)
胆囊癌属于消化系统的恶性肿瘤,其致死率高于多数消化道恶性肿瘤,近年来,胆囊癌分子发病机制越来越受到广大学者的关注,研究基因在胆囊癌发病中的作用也是目前提高胆囊癌治疗的重要途径〔1,2〕。睾丸蛋白聚糖(SPOCK)1在肿瘤中异常表达,其编码的蛋白属于骨黏连蛋白家族成员,与细胞形态维持、增殖等有关〔3,4〕。近年来的研究表明,SPOCK1沉默后可以发挥抗肿瘤作用,对于食管癌、胶质瘤、胆囊癌等细胞的生长、转移具有抑制作用,并且沉默SPOCK1还可以诱导胶质瘤细胞的凋亡〔5~7〕。本研究旨在探讨SPOCK1沉默后胆囊癌细胞的生长、凋亡情况,并初步探讨其作用机制。
1 材料与方法
1.1材料 胆囊癌细胞GBC-SD购自美国ATCC;信号转导与转录因子(STAT)3抗体购自美国Abcam;剪切的含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved Caspase)-抗体购自美国BOSTER;膜联蛋白V(Annexin V)-FITC/碘化丙啶(PI)凋亡测定试剂盒购自碧云天研究所;Real time PCR试剂盒购自大连TAKARA;磷酸化的STAT3(p-STAT3)抗体、SPOCK1抗体购自美国CST;Lipofectamine 2000购自美国invitrogen;二喹啉甲酸(BCA)蛋白定量试剂盒购自北京TIANGEN;二氨基联苯胺(DAB)显色试剂盒购自北京索莱宝;SPOCK1 siRNA和siRNA control购自美国biorbyt。
1.2细胞分组转染 胆囊癌细胞密度为80%时,进行细胞转染,在转染前用不含血清的培养液饥饿培养细胞1 d。转染操作步骤参照脂质体转染试剂Lipofectamine 2000。胆囊癌细胞中转染SPOCK1 siRNA和siRNA control后记为干扰组和阴性组,并以不做转染的胆囊癌细胞记为对照组。胆囊癌细胞培养于37℃,5% CO2和95%空气的培养箱内,细胞用0.25%的胰蛋白酶消化传代,用10%胎牛血清的RPMI1640培养。
1.3Real Time PCR法测定胆囊癌细胞中SPOCK1的转录水平 对照组、阴性组、干扰组的胆囊癌细胞在分别培养2 d以后,用Trizol试剂提取各组胆囊癌细胞内的总RNA,RNA保存于-80℃。取RNA,进行cDNA反转录后,用Real Time PCR测定SPOCK1水平。2-△△Ct法计算,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参。引物序列:SPOCK1正义链5′-CATGGGTTGGACCTTCGA-3′,反义链5′-CTTTGGTGGCTCAGGCTCT-3′。GAPDH正义链5′-CGGAGTCAACGGATTTGGTCGTAT-3′,反义链5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。
1.4Western印迹测定胆囊癌细胞中SPOCK1蛋白表达水平 对照组、阴性组、干扰组的胆囊癌细胞分别培养2 d以后,收集各组胆囊癌细胞,加入蛋白裂解液,放置在冰上裂解约30 min以后,在低温离心机10 000 r/min离心15 min。用移液枪吸取上清,按照BCA法对蛋白进行定量检测。以每孔上样孔添加40 μg蛋白进行电泳,在电泳前,蛋白样品与等体积的上样缓冲液在100℃煮沸,以90 V电压电泳,待染料进入到凝胶的底部时,终止电泳。将凝胶上的蛋白电转至硝酸纤维素膜上,转膜条件为:90 V,4℃。把膜放在5%牛血清白蛋白中室温孵育1 h,然后把膜放在1∶600稀释的一抗中孵育过夜以后,再将膜放在1∶2 000稀释的二抗中室温孵育2 h。DAB显色以后,用Gel Doc2000对各目的条带进行定量,以GAPDH为内参。
1.5噻唑蓝(MTT)法检测胆囊癌细胞增殖 MTT是一种黄色的染料,其可以被活细胞产生的乳酸脱氢酶还原,形成难溶解的蓝紫色结晶,而这种结晶物的产生量同活细胞的数目呈正相关,检测其在490 nm的A值可以反映出活细胞的数量。对照组、阴性组、干扰组的胆囊癌细胞种植到96孔板,接种密度约为每孔添加3 000个细胞,在2 d后添加MTT,每孔20 μl,置于37℃孵育3 h。把上清吸尽以后,按照每孔添加100 μl的二甲基亚砜(DMSO)把结晶溶解以后,测定490 nm的A值。
1.6细胞克隆实验检测胆囊癌细胞克隆形成能力 细胞克隆实验用于检测单个细胞的增殖能力,单个细胞在经过约6代的增殖以后,可以形成一个细胞群体,成为克隆,当一个克隆内的细胞数目大于50时,可用肉眼直接观察到克隆。对照组、阴性组、干扰组的胆囊癌细胞种植到24孔板内(用不含血清的培养液悬浮),每个孔中添加约200个细胞,约14 d以后,用PBS清洗各孔,用多聚甲醛固定以后,吉姆萨染色。计数大于50个细胞的克隆数目。用克隆形成数目占接种细胞数目的百分比表示克隆形成率。
1.7流式细胞术检测胆囊癌细胞凋亡情况 对照组、阴性组、干扰组的胆囊癌细胞在分别培养2 d以后,收集各组细胞,在细胞内加入结合缓冲液500 μl,再依次添加5 μl的Annexin V-FITC和5 μl的PI,混合以后,把细胞放在避光条件下,孵育结合15 min。用流式细胞术测定各组胆囊癌细胞凋亡情况。在结果中右上象限和右下象限表示凋亡的细胞,左上象限表示坏死的细胞,左下象限表示正常的细胞。
1.8Western印迹法检测胆囊癌细胞中STAT3、Cleaved Caspase-3、p-STAT3蛋白水平 对照组、阴性组、干扰组的胆囊癌细胞在分别培养2 d以后,按照Western印迹法测定各组胆囊癌细胞中STAT3、Cleaved Caspase-3、p-STAT3蛋白水平,一抗稀释:STAT3以1∶800稀释、Cleaved Caspase-3以1∶600稀释、p-STAT3以1∶600稀释。
1.9统计分析 采用SPSS21.0软件行t检验、单因素方差分析及SNK-q检验。
2 结 果
2.1转染后的胆囊癌细胞中的SPOCK1 mRNA和蛋白水平 胆囊癌细胞中转染SPOCK1 siRNA后,细胞中SPOCK1 mRNA和蛋白水平均明显降低,而胆囊癌细胞中转染siRNA control对细胞中SPOCK1 mRNA和蛋白水平没有影响。SPOCK1 siRNA可以明显下调胆囊癌细胞中SPOCK1转录和表达。见图1,表1。
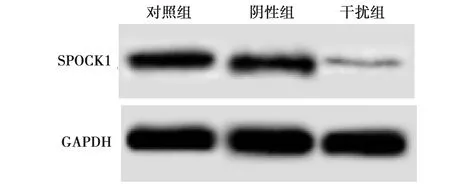
图1 Western印迹检测胆囊癌细胞中SPOCK1蛋白表达
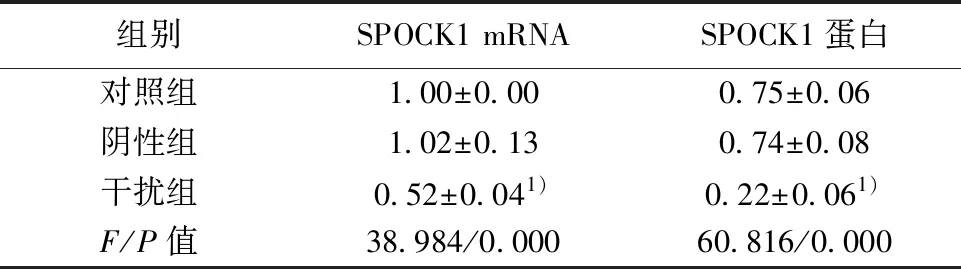
组别SPOCK1 mRNASPOCK1蛋白对照组1.00±0.000.75±0.06阴性组1.02±0.130.74±0.08干扰组0.52±0.041)0.22±0.061)F/P值38.984/0.00060.816/0.000
与对照组比较:1)P<0.05,下表同
2.2SPOCK1敲低后降低胆囊癌细胞增殖和克隆形成能力 胆囊癌细胞中转染SPOCK1 siRNA后,细胞A值、细胞克隆形成率明显下降,而胆囊癌细胞中转染siRNA control后对胆囊癌细胞A值和克隆形成率都没有影响。SPOCK1敲低后可以明显下调胆囊癌细胞增殖和克隆形成能力。见表2。
表2 各组胆囊癌细胞A值和细胞克隆形成率比较
2.3敲低SPOCK1促进胆囊癌细胞凋亡发生 对照组细胞凋亡率为〔(6.35±1.58)%〕,胆囊癌细胞中转染SPOCK1 siRNA后,细胞凋亡率〔(22.17±3.54)%〕明显升高,而胆囊癌细胞中转染siRNA control后〔(6.82±1.65)%〕对胆囊癌细胞的凋亡没有影响。SPOCK1敲低后可以明显促进胆囊癌细胞凋亡。见图2。
2.4敲低SPOCK1 促进胆囊癌细胞中Caspase-3活化并减少STAT3磷酸化 胆囊癌细胞中转染SPOCK1 siRNA后,细胞中Cleaved Caspase-3水平升高,而p-STAT3水平下调,而胆囊癌细胞中转染siRNA control后对胆囊癌细胞中Cleaved Caspase-3、p-STAT3水平没有影响。SPOCK1敲低后可以明显促进胆囊癌细胞中Caspase活化,抑制STAT3磷酸化。见图3,表3。
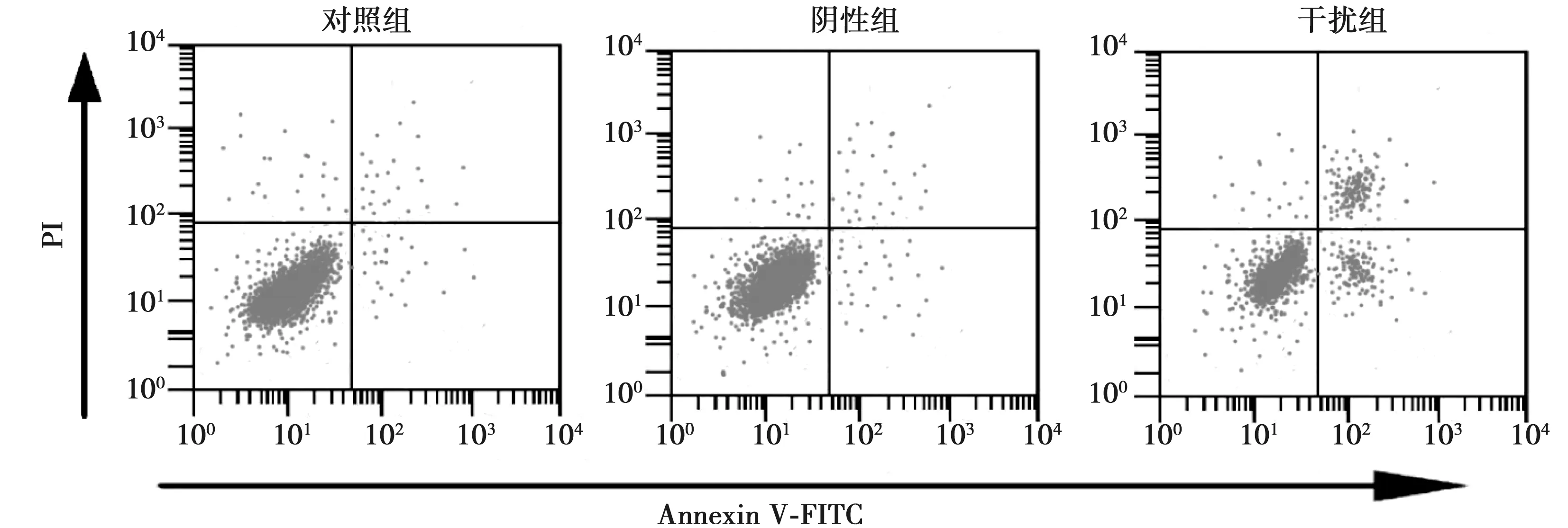
图2 Annexin V-FITC/PI法检测各组胆囊癌细胞凋亡
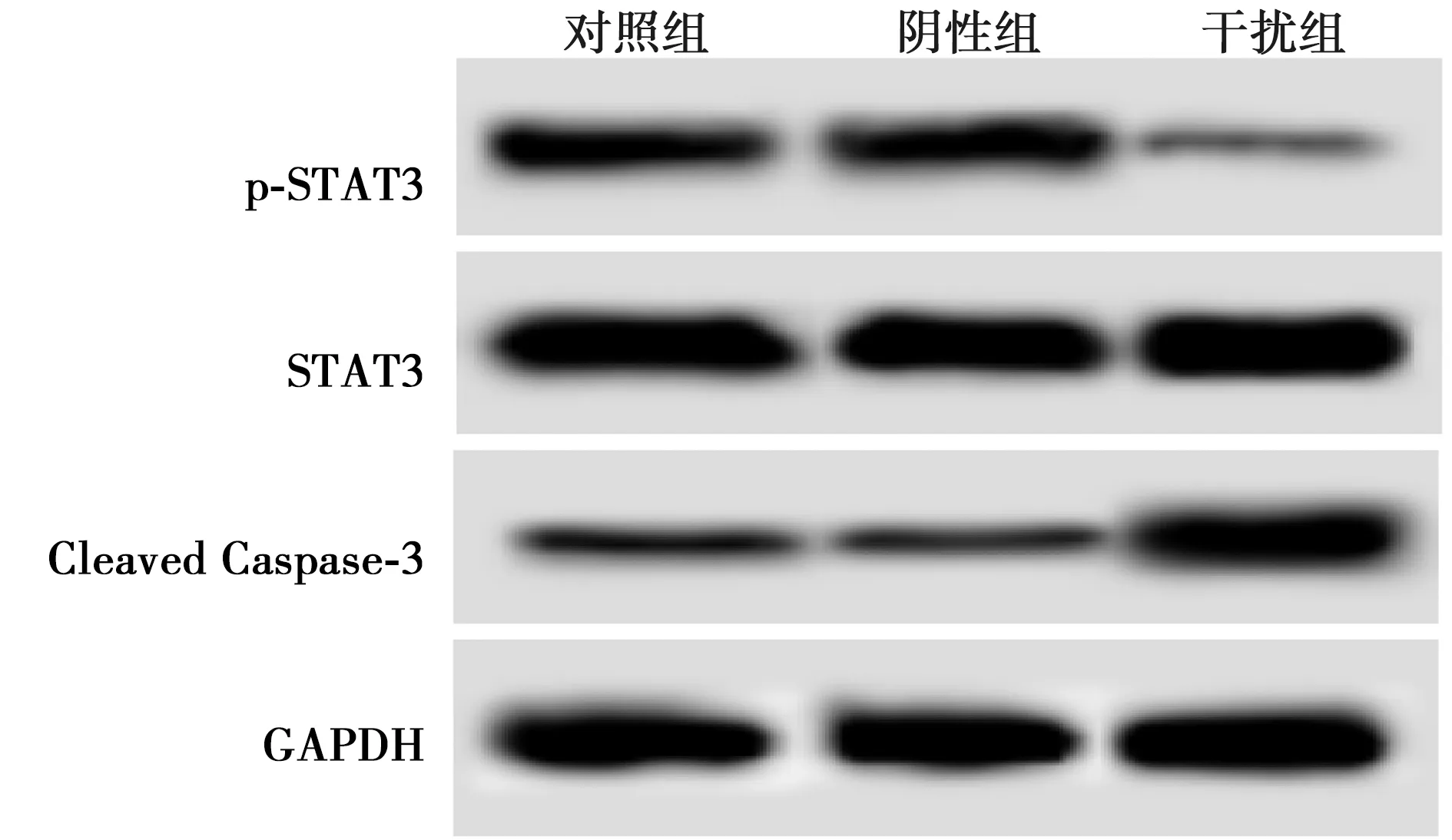
图3 Western印迹测定各组胆囊癌细胞中Cleaved Caspase-3、STAT3、p-STAT3蛋白水平
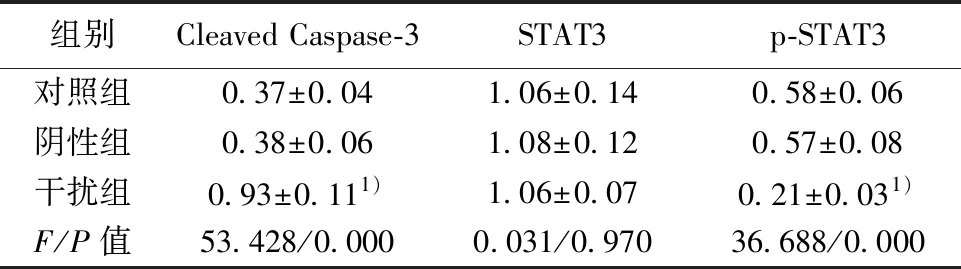
组别Cleaved Caspase-3STAT3p-STAT3对照组0.37±0.041.06±0.140.58±0.06阴性组0.38±0.061.08±0.120.57±0.08干扰组0.93±0.111)1.06±0.070.21±0.031)F/P值53.428/0.0000.031/0.97036.688/0.000
3 讨 论
SPOCK1最初发现于睾丸中,属于一种嵌合多糖,因此被命名为睾丸蛋白聚糖1,后来随着研究的不断深入,SPOCK1存在于除了睾丸之外的组织中,因此也称为Sparc/骨矿化结合素,其在多种物种中均有表达,是一个高度保守的多糖蛋白〔8,9〕。SPOCK1参与肿瘤的发生,与细胞与细胞之间的黏附作用有关,可以通过调控细胞内的基质金属蛋白酶影响多种肿瘤的转移〔10〕。已经有研究证实,SPOCK1在胆囊癌中表达上调,并且参与胆囊癌细胞的转移和侵袭过程〔3,7〕。在肺癌中发现,SPOCK1表达水平异常升高,并且能够调控肺癌细胞的生长,同样在胃癌、膀胱癌等癌症中发现SPOCK1异常高表达,并且与肿瘤预后、分期等有关〔11~13〕。近年来的研究显示,神经胶质瘤细胞中沉默SPOCK1后,肿瘤细胞凋亡增多,SPOCK1还与肿瘤细胞的凋亡有关〔5〕。
细胞凋亡的发生是机体正常的生理功能的一部分,是清除细胞的主动途径,当细胞凋亡途径发生紊乱时,就会引起机体发育异常,出现多种疾病。肿瘤细胞的生长、凋亡与肿瘤的发生密切相关,肿瘤发生常常伴随着肿瘤细胞凋亡异常减少的现象,如何诱导肿瘤细胞凋亡也是肿瘤治疗的重要途径〔14〕。Caspase-3以酶原的形式存在于细胞中,其N端含有一个较短的前区,没有死亡效应结构域,必须通过活化后才可以促进细胞凋亡的发生,Caspase-3酶原中含有一个由3个天冬氨酸(ASP)组成的安全扣,当细胞凋亡发生时,这个安全扣在细胞质内裂解,在ASP内被剪切,形成活化形式的Cleaved Caspase-3,最终诱导细胞凋亡的发生,而Caspase-3介导的细胞凋亡过程几乎存在于所有的肿瘤细胞中〔15~17〕。本实验表明,SPOCK1沉默后可以诱导胆囊癌细胞的凋亡,促进细胞内Caspase-3的活化,减少胆囊癌细胞的增殖和克隆,SPOCK1沉默可以抑制胆囊癌的发展。
癌基因和抑癌基因参与肿瘤的发生,癌基因过度表达和抑癌基因表达减少是肿瘤发生的基础。细胞的生长、增殖等与细胞内多种细胞因子和信号的转导有关,是一个极为复杂的过程〔18〕。STAT3在肿瘤组织中异常激活,其激活后可以诱导肿瘤细胞的生长,减少肿瘤细胞凋亡〔19〕。研究显示,胆囊癌组织中STAT3磷酸化水平异常升高,并且细胞内多种基因和药物调控胆囊癌细胞的生长均与STAT3信号通路有关〔20~22〕。本研究提示SPOCK1沉默可能通过抑制STAT3信号通路影响胆囊癌细胞的生长和凋亡,其具体的作用机制还需要在以后进行验证。
综上,SPOCK1沉默可以减弱胆囊癌细胞的增殖和克隆能力,诱导Caspase-3介导的细胞凋亡,抑制STAT3信号通路的激活,SPOCK1沉默可以发挥抗胆囊癌生长的作用,而对于其分子机制尚不清楚,还需要在以后深入研究,为靶向SPOCK1治疗胆囊癌提供坚实的参考。
