干细胞转录因子Nanog在人非小细胞肺癌中的表达及临床意义
2019-10-14王永芳宋姗姗张春芳陈昊
王永芳 宋姗姗 张春芳 陈昊
(徐州医科大学附属连云港市第一人民医院病理科,江苏 连云港 222002)
非小细胞肺癌(NSCLC)是目前全球范围内发病率和死亡率均居首位的恶性肿瘤,以老年患者居多,约70%以上的患者在发现肿瘤时已出现局部进展或远处转移而失去手术机会,其5年生存率通常低于20%〔1〕。在我国,NSCLC 的发病率和死亡率均呈上升趋势,其中鳞状细胞癌和肺腺癌是其主要的组织学类型〔2〕。干细胞转录因子Nanog基因位于染色体12p13.31上,在维持外胚层多能性、阻止向原始内胚层分化中起重要作用,有研究表明Nanog在生殖细胞肿瘤中阳性表达,其表达上调能够抑制钙黏素的表达,可诱发上皮间充质转化,促进肿瘤细胞的增殖和迁移〔3〕。此外,近年来多项研究发现Nanog在乳腺癌、食管癌、胃肠癌及肾癌等多种恶性肿瘤组织中表达增高,且与患者预后密切相关,提示其可能作为肿瘤生物学和预后的分子标志物〔4~7〕。本文拟分析干细胞转录因子Nanog在人NSCLC中的表达水平与临床病理参数之间的关系,为NSCLC的治疗及预后提供实验依据。
1 材料与方法
1.1临床资料 收集50例2014年2月至2017年6月在连云港市第一人民医院NSCLC患者术中切除的新鲜组织,以其中30例癌旁组织(距癌组织≤3 cm)及正常肺组织(距癌组织>3 cm)作为对照组,每例标本取下后立即放入冷冻管经液氮速冻后,置于-80℃冰箱中保存备用。所有患者临床资料完整,确诊前未接受任何形式放疗、化疗等辅助治疗,术后经病理明确诊断。患者年龄33~76岁,中位年龄61岁;男32例,女18例;鳞癌23例,腺癌27例;肿块直径1.5~10.0 cm,中位直径3.5 cm;临床TNM分期:Ⅰ期18例,Ⅱ期12例,Ⅲ期11例,Ⅳ期9例;有淋巴结转移26例,无淋巴结转移24例。
1.2主要试剂 Trizol RNA提取试剂购自美国Invitrogen公司;逆转录试剂盒购自美国Thermo公司;兔抗人Nanog单克隆抗体(浓缩液)购自美国Cell Signaling Technology公司,以1∶400倍稀释;三合一抗原修复液、过氧化物酶阻断剂、二抗、二氨基联苯胺(DAB)显色液、磷酸盐缓冲液(PBS)均购自美国DAKO公司。
1.3实时荧光定量PCR法检测Nanog基因 取100 mg的冻存新鲜组织液氮下研磨,加入1 ml Trizol RNA提取试剂抽提组织中的总mRNA,操作严格按照说明书进行。紫外分光光度计检测其浓度及A260/280比值。按照逆转录试剂盒操作说明书将提取 RNA逆转成cDNA,-80℃保存备用,Nanog和内参照GAPDH的引物序列Nanog正义:5′-TGTGGGCCTGAAGAAAACTATC-3′,反义:5′-GCTGTCCTGAATAAGCAGATCC-3′;GAPDH正义:5′-TGTACGCCAACACAGTGCTG-3′,反义:5′-TCAGGAGGAGCAATGATCTTG-3′。采用SYBR Green染料法行qRT-PCR扩增反应,反应条件为95℃ 5 min,95℃ 10 s,60℃ 30 s,共40个循环。每个样本均设3个复孔,并进行扩增曲线和熔解曲线检测,数据分析采用相对定量的方法,取2-ΔΔCt值进行比较,其中ΔCT =目的基因CT平均值-管家基因CT平均值,ΔΔCT=ΔCT癌-ΔCT癌旁。
1.4免疫组化检测Nanog蛋白 标本均用4%中性甲醛溶液固定,常规石蜡包埋,4 μm厚连续切片,采用EnVision二步法应用仪器Roche Bench Mark XT免疫组化自动染色仪行免疫组化染色。设阳性对照并用PBS缓冲液代替一抗做阴性对照。Nanog阳性表达主要定位于细胞核中,阳性判读使用半定量积分法〔8〕:光镜(×200)下检查组织中阳性细胞所占比例和着色强度,①阳性细胞染色比例<6%计0分;6%~25%计1分;26%~50%计2分;51%~75%计3分;>75%计4分。②阳性细胞着色强度:无0分;淡黄色1分;棕黄色2分;棕褐色3分。将以上两项得分相乘为最后评分,0分为阴性,1~4分为弱阳性,5~7分为中阳性,8分及以上为强阳性。
1.5统计学方法 运用SPSS16.0软件进行方差分析、t检验及χ2检验。
2 结 果
2.1NSCLC、癌旁组织及正常肺组织中Nanog基因的表达情况 NSCLC组织中Nanog mRNA相对表达量(3.25±1.12)显著高于癌旁(1.20±0.45)和正常肺组织(1.03±0.28,P<0.01);而癌旁与正常肺组织差异无统计学意义(P>0.05)。
2.2NSCLC、癌旁组织及正常肺组织中Nanog蛋白表达情况 Nanog蛋白的阳性染色为棕黄色颗粒,在细胞核和细胞质中均有表达,但在细胞核中的表达强于细胞质(图1)。Nanog蛋白在NSCLC组织中的阳性表达率为48%(24/50),以中度-强阳性为主;癌旁组织Nanog阳性表达2例,以弱阳性为主;正常肺组织中Nanog未见阳性表达;Nanog蛋白在NSCLC组织中的阳性表达显著高于癌旁组织和正常肺组织(P<0.01)。
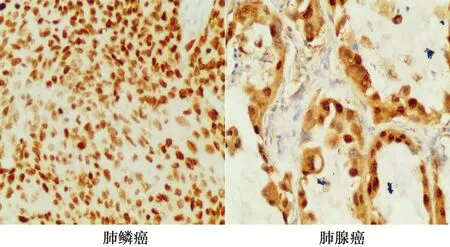
图1 Nanog在肺鳞癌和肺腺癌中表达(EnVision法,×200)
2.3Nanog mRNA表达与NSCLC临床病理参数的关系 NSCLC组织中,Nanog mRNA表达量与淋巴结转移、分化程度和病理类型差异有统计学意义(P<0.05,P<0.01),与性别、年龄、肿瘤大小及临床分期差异无统计学意义(P>0.05)。见表1。
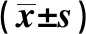
表1 NSCLC患者临床病理特征与肿瘤组织中Nanog mRNA表达的关系
3 讨 论
Nanog基因属于NK家族基因,2003年由Mitsui等〔9〕和Chambers等〔10〕同时发现并报道,是一种在原始生殖细胞、胚胎干细胞及囊胚内细胞群中均有表达的转录因子,在胚胎干细胞和胚胎发育早期高表达,而在已分化的组织中降低或消失。Nanog基因是维持外胚层多能性,阻止胚胎干细胞分化为原始内胚层的关键因子,将其敲除可导致胚胎干细胞向原始内胚层分化。研究发现,Nanog除了在生殖细胞中表达外,也在多种实体肿瘤中表达,将Nanog基因敲除后,肿瘤的发展在一定程度上受到抑制,提示Nanog与恶性肿瘤的发生发展密切相关,然而究其机制,目前尚无确切的定论〔11〕。
肺癌干细胞是导致肺癌发生的原始细胞,CD133+细胞主要分布在分化较差的肿瘤组织中,随分化程度增高而减少,具有强致瘤性,而CD133-细胞则缺乏这种潜力。研究发现,在肺癌组织中Nanog可以抑制CD133+细胞向CD133-方向转化,维持CD133+细胞自我更新等干细胞特征,其高表达的肺癌组织侵袭性和耐药性增强,预后更差〔12〕。当去除Nanog时,可以降低肿瘤干细胞的比例,消除肿瘤干细胞侵袭并抑制上皮间充质转化过程,减弱了球体形成的能力,阻断了肺癌细胞的致瘤和转移能力〔13〕。
研究报道,Nanog具有诱导鳞状细胞癌形成的潜力,常在人鳞状细胞癌中过表达,包括食管鳞癌、口腔鳞癌及皮肤鳞癌等,可能与Nanog上调Zeb1、Twist和miR-21等驱动因子,从而诱发上皮间充质转化和肿瘤干细胞特征相关〔4,18,19〕。此外,本研究结果表明合并淋巴结转移的低分化NSCLC组织中Nanog mRNA表达量升高,推测其原因可能为分化程度低的肿瘤细胞其表型和基因结构与原始幼稚的干细胞相近,因此具有干细胞特征的肿瘤细胞数量也越多,恶性程度越高,侵袭和转移能力越强。Nanog的表达可维持干细胞低分化条件,并维持干细胞自我更新和增殖能力,这对于协助分化信号至关重要。虽然本研究中Nanog的表达与肿瘤大小和临床分期没有统计学意义,但是随着肿瘤增大,Nanog的表达相对增高,TNM临床分期越晚Nanog基因表达量越多,提示Nanog基因表达与肿瘤细胞的增殖及恶性程度密切相关,而这些均是肿瘤预后不良的相关因素。Zhao等〔20〕研究显示,Nanog表达升高的患者总生存率和无病生存率较差,提示其可以作为新型肿瘤标志物来指导临床治疗和指示预后。此外,有研究表明,Nanog表达上调可以增强致瘤性,而抑制或消除Nanog则可阻滞肿瘤的发生发展,Nanog的表达与肿瘤进展、转移、抵抗治疗及复发有关,且与患者的耐药性和生存率差异呈正相关〔11〕。然而Nanog调控NSCLC发生发展的具体作用机制仍不清楚,还有待在更大样本中进一步证明。
综上,Nanog在NSCLC发生、发展、侵袭和转移过程中可能发挥癌基因的作用,有望成为NSCLC诊断的分子标志物及治疗的潜在靶点,为研究NSCLC发病机制提供了新思路。
