金鸡毛草叶总黄酮大孔树脂的富集及抗氧化活性研究
2019-10-12韦琴梅辉江咏雪刘少艺陈卓
韦琴,梅辉,江咏雪,刘少艺,陈卓
(1.武汉工商学院环境与生物工程学院,湖北武汉430065;2.武汉生物工程学院生命科学与技术学院,湖北武汉430415)
金鸡毛草,又名白背三七、白子菜、明月草、鸡毛菜等,为宿根多年生长常绿直立草本植物,直根系,侧根多,嫩茎浅绿色,分枝力强,该植物只开花,不结籽,茎部具有很强的不定根形成能力,原产于新加坡,盛产于我国云南、海南、广东等地,生长在潮湿的阴地上,耐热喜湿[1]。传统中草药治疗糖尿病历史悠久,金鸡毛草是一种具有较高的药用和食用价值的天然植物,开发前景非常广阔,目前金鸡毛草已实现人工栽培,具有降血糖、降血脂、降血压、抗炎、抗肿瘤及抗氧化等药理作用[2-4]。糖尿病是一种常见的慢性代谢性疾病,随着我国人民生活水平的提高、人口老龄化,其发病率逐年升高,已成为严重威胁人们健康的主要疾病之一,研究表明[5-6]金鸡毛草提取液对糖尿病有一定的治疗作用。黄酮类化合物是一类含有酚羟基的还原性化合物,其对自由基有较强的捕捉作用,抗氧化作用与其组分或聚合度都密切相关[7-8]。
大孔吸附树脂因成本低、选择性好和再生处理,近年来被广泛用于中草药活性成分的研究[9-10],王沙沙等[11]研究了大孔吸附树脂分离纯化猪毛菜总黄酮,发现AB-8 型树脂分离纯化效果较好,赖红芳等[12]研究大孔树脂纯化翠云草中穗花杉双黄酮,表明NKA-9型大孔吸附树脂比较适用于穗花杉双黄酮的纯化。但对金鸡毛草总黄酮的大孔树脂纯化工艺研究却很少有报道。
本团队前期在对金鸡毛草的叶和茎总黄酮进行超声波提取工艺优化时发现[13],总黄酮成分主要存在于金鸡毛草的叶的部位而不是茎,因此本研究对金鸡毛草叶的部分进行了后续研究,优选金鸡毛草叶大孔树脂纯化的工艺条件并测定纯化产物在体外的抗氧化活性,可为金鸡毛草的开发利用提供一定的试验基础。
1 材料与方法
1.1 材料与设备
干燥的金鸡毛草叶药材用粉碎机粉碎成粉末,过80 目的钢筛,密封保存。
芦丁标准品(含量≥98%):天津一方科技有限公司;水为超纯水;无水乙醇、甲醇、双氧水、氢氧化钠、硝酸铝、亚硝酸钠(均为分析纯):天津市凯通化学试剂有限公司。AB-8、D101、,D301、D315、HPD450、HPD600、X-5 型大孔树脂:天津市海光化工有限公司;抗坏血酸:上海山浦化工有限公司;1,1-二苯基-2-三硝基苯肼自由基:热默尔生物科技有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基:西亚试剂化学试剂有限公司。
B220 型恒温水浴锅、RE-52 型旋转蒸发仪:上海亚荣生化仪器厂;752 型紫外分光光度计:上海光谱仪器有限公司;FD-1A-50 冷冻干燥机:北京博医康实验仪器有限公司。
1.2 方法
1.2.1 标准曲线的制作
精密称取芦丁标准品,用30 %乙醇配制成0.15 mg/mL 芦丁标准品对照液,精确量取对照液0、0.50、1.00、2.00、3.00、4.00 mL 分别移入标有 0、1、2、3、4、5 号的10 mL 刻度比色管中,分别加入30 %乙醇至5 mL,各加入5 %亚硝酸钠溶液0.3 mL,摇匀,静置6 min,再各加入10%硝酸铝溶液0.3 mL,摇匀,静置6 min,分别加入4%氢氧化钠溶液2.0 mL,再加30%乙醇至刻度,摇匀,静置15 min 后以0 号为空白对照,于510 nm 处测吸光度[14]。绘制总黄酮含量测定标准曲线。测定得到回归方程y=9.626 7x+0.007 1(x 为芦丁标准品质量浓度,mg/mL;y 为吸光度值A),相关系数R2=0.999 6。结果表明,芦丁对照品在所试质量浓度0.007 5 mg/mL~0.06 mg/mL 呈良好的线性关系。
1.2.2 供试品溶液的制备
称取金鸡毛草叶药材粉末200 g,加入20 倍量的60%乙醇,于60 ℃、150 W 功率下超声波提取30 min,离心取上清液得粗提液,取一部分用抽真空冷冻干燥机冻干成干干浸膏状,冷藏备用,按需配取。
1.2.3 树脂的预处理
将大孔树脂浸泡于95%乙醇中,浸泡24 h,倒去悬浮物,更换95%乙醇溶液浸泡树脂,直至上清液加水无白色浑浊现象为止,再用蒸馏水冲洗树脂直至无醇,然后进行酸洗碱洗处理,最后用大量蒸馏水冲洗至上清液pH 呈中性[15-16]。
1.2.4 大孔树脂纯化金鸡毛草叶总黄酮的工艺优化
以金鸡毛草叶总黄酮的吸附率及解吸率为评价指标,通过静态吸附筛选最优的树脂;采用单因素试验和正交试验优选总黄酮的最佳纯化工艺。
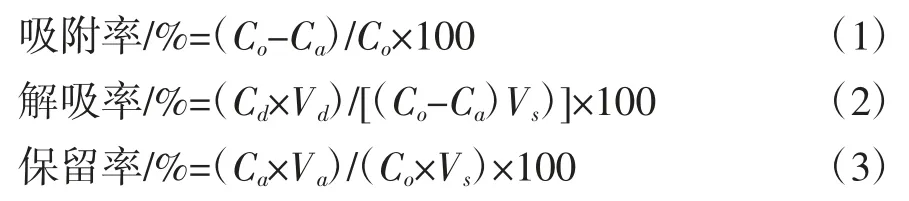
式中:Co为样品液质量浓度,mg/mL;Ca为上样吸附后流出液总黄酮质量浓度,mg/mL;Cd为解吸液中总黄酮浓度,mg/mL;Vs为样品液体积,mL;Vd为解吸液体积,mL;Va为解吸流出液体积,mL。
1.2.4.1 大孔树脂的静态吸附筛选
准确称取7 种已经过预处理的大孔树脂各1 g,用少量乙醇湿润后,以蒸馏水洗去乙醇,再吸干其表面水分置于150 mL 三角瓶中,各加入50 mL 金鸡毛草叶提取物,置于全温振荡培养箱中,于30 ℃,120 r/min 震荡静态吸附24 h 后过滤,吸取一定体积上清液测定溶液中的总黄酮浓度,计算吸附率,将上述吸附饱和的大孔树脂过滤后放入150 mL 三角瓶中,加入50 mL 60%无水乙醇溶液对已吸附饱和的树脂进行静态解吸24 h,然后测定解吸液中黄酮类化合物的含量计算解吸率。
1.2.4.2 上样浓度对树脂吸附率的影响
称取8 份AB-8 型大孔树脂1 g 于50 mL 三角瓶中,分别加入 1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 mg/mL的上样液6 mL,将其置于全温振荡培养箱中,于30 ℃,120 r/min 振荡进行静态吸附24 h 过滤,取上清液测定总黄酮浓度计算吸附率。
1.2.4.3 上样液pH 值对总黄酮吸附率的影响
准确称取7 份AB-8 型大孔树脂5.0 g(湿重),分别加入50 mL 三角烧瓶中,加入4.0 mg/mL 上样液25.0 mL,调节 pH 值为 2.0、3.0、4.0、5.0、6.0、7.0、8.0,置于全温振荡培养箱中,于30 ℃,120 r/min 震荡静态吸附24 h 过滤,取上清液测总黄酮浓度计算吸附率。
1.2.4.4 上样流速对总黄酮保留率的影响
称取适量AB-8 型大孔树脂进行湿法上柱,维持柱体积为12 mL,装入等体积,浓度为4 mg/mL 上样液,分别以 1.5、3.0、4.5、6.0、7.5 BV/h 的体积流量通过树脂柱,水洗后用60%乙醇进行洗脱,收集洗脱液计算保留率。
1.2.4.5 上样体积的考察
称取适量AB-8 型大孔树脂进行湿法上柱,控制上样流速为1.5 BV/h,分批收集流出液测定流出液总黄酮浓度。
1.2.4.6 水洗用量考察
以2 BV/h 的流速水洗已达到吸附平衡的大孔树脂,分批收集流出液,测定流出液中总黄酮的含量,绘制水洗用量曲线。
1.2.4.7 洗脱液浓度对树脂解吸率的影响
称取适量AB-8 型大孔树脂进行湿法上柱,维持柱体积为12 mL,加入1.2 BV 的4 mg/mL 上样液到色谱柱中进行动态吸附,调节上样流速为1.5 BV/h 上样pH 值为6,吸附完成后加入3.5 BV 蒸馏水进行洗脱,再分别用浓度在10%~90%的乙醇,每10%一个浓度梯度在2 BV/h 流速下解吸,收集流出液测定解吸率。
1.2.4.8 乙醇洗脱用量考察
水洗后用60%的乙醇进行洗脱,洗脱流速调节为2 BV/h,分批收集一管流出液,测定洗脱液中总黄酮的浓度,绘制洗脱曲线。
1.2.4.9 验证性试验
在1.2.4.2~1.2.4.8 单因素研究最佳条件下,以总黄酮的保留率为考察指标做五次平行试验,计算平均值和相对标准偏差(relative standard deviation,RSD)值。
1.2.5 金鸡毛草叶总黄酮纯度的测定
将总黄酮纯化液先浓缩后用抽真空冷冻干燥机冻干成干浸膏状,测定总黄酮质量和干浸膏质量,并计算所得总黄酮的纯度,按同样的方法得到总黄酮粗提液纯度,计算纯化前后纯度。

1.2.6 DPPH 自由基清除活性
称取24.00 mgDPPH 用100 mL 无水乙醇溶解,定容于100 mL 容量瓶中,摇匀,倒入棕色磨口瓶,作为储备液保存于4 ℃冰箱中,浓度为6×10-4moL/L,在比色管中依次加入干浸膏质量浓度为20 μg/mL~100 μg/mL样品1 mL 及浓度为 0.6 mmoL/L DPPH 乙醇溶液0.5 mL,然后再添加乙醇溶液补充体积至5 mL,使样品最终浓度分别为 4、8、12、16、20 μg/mL,摇匀,室温避光反应30 min 后于517 nm 处测定吸光值A,计算其DPPH 自由基清除能力[17-20]。VC测定方法同1.2.6。

式中:A0为不加样时的吸光度;A1为加样组的吸光度。
1.2.7 ·OH 清除率的测定
本试验采用Fenton 体系[17-20]对金鸡毛草叶总黄酮的·OH 清除率进行测定。取浓度为5.0 mmoL/L 的邻二氮菲溶液0.5 mL,加入浓度为150 mmoL/L 磷酸盐缓冲液(pH7.4)1.0 mL,混匀后加入浓度为 5.0 mmoL/L 的FeSO4溶液0.5 mL,充分混匀,加入干浸膏质量浓度为100 μg/mL 样品液 1.0 mL,再加入 0.1 mol/L H2O20.2 mL,摇匀,37 ℃保温60 min,在508 nm 处测定吸光度(As)。按照上述操作,用蒸馏水代替样品液,测定得A1,用蒸馏水代替样品液和H2O2溶液,测定得A0。计算待测液对羟自由基的清除率Y。计算待测液对羟自由基的清除率。VC测定方法同1.2.7。

式中:As为样品液测得吸光度;A1为蒸馏水代替样品液所测得吸光度;A0为蒸馏水代替样品液和H2O2溶液所测得吸光度。
1.2.8 ABTS+·清除率测定
ABTS+·工作液的制备[17-20]:将 7 mmoL/L ABTS 水溶液与2.45 mmoL/L K2S2O8(终浓度)混合,在室温暗处存放12 h~16 h,生成ABTS+·阳离子自由基,作为储存液,使用前,用80%乙醇将ABTS+储存液稀释到734 nm处吸光值为0.70±0.02,反应体系是具塞比色管中依次加入 0.5 mL 干浸膏质量浓度为 40 μg/mL~200 μg/mL,及5 mL ABTS+·工作液,使样品最终浓度分别为3.6、7.2、10.9、14.5、18.2 μg/mL,室温避光反应 6 min 后于 734 nm测定吸光值A,计算其抗氧化能力。VC测定方法同上。

式中:A0为不加样时的吸光度;A1为加样组的吸光度。
2 结果与分析
2.1 大孔树脂的静态吸附筛选
7 种型号大孔树脂筛选结果见表1。
由表1 可知,7 种树脂的吸附中,HPD600 型大孔树脂的吸附率最佳为71.2%,但其解吸率是中等水平为70.9%;AB-8 型大孔树脂的解吸率最佳为81.5%,且AB-8 型大孔树脂的吸附率是上等水平为69.9%,综合以上因素,最佳树脂筛选为AB-8 型大孔树脂。
2.2 AB-8型大孔树脂对金鸡毛草叶总黄酮的吸附性能考察
2.2.1 上样浓度对总黄酮吸附率的影响
上样液中总黄酮的浓度对吸附率的影响见表2。
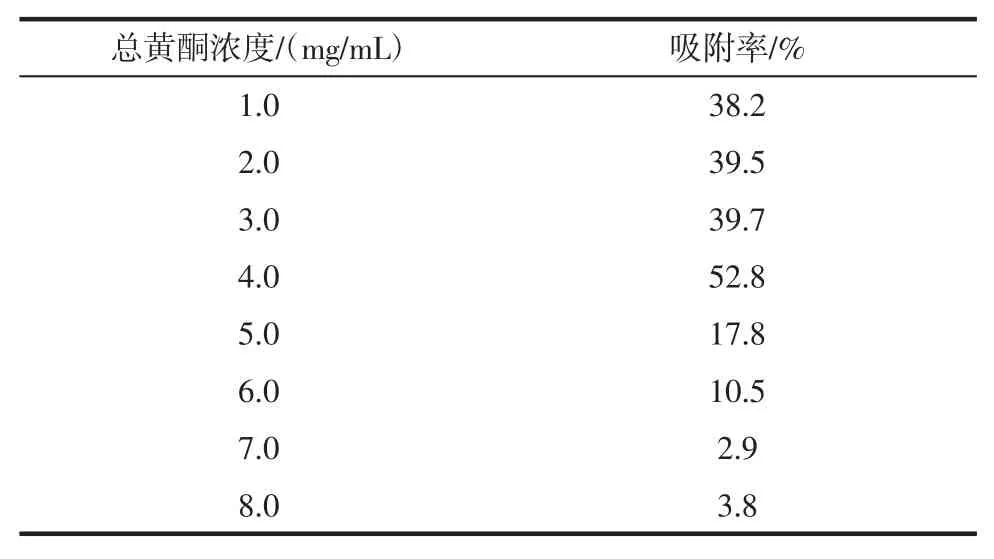
表2 上样液中总黄酮的浓度对吸附率的影响Table 2 Effect of the concentration of total flavonoids in the sample solution on the adsorption rate
由表2 可知,随着上样浓度的增加,树脂的吸附率也增加,而当上样浓度达到4.0 mg/mL 时,树脂的吸附率达到最大为52.8%。而当样品液浓度再次增加时,上样液中杂质也随之增加,杂质与黄酮产生竞争吸附反而抑制了黄酮在树脂中的扩散。因此,最佳上样浓度为4 mg/mL。
2.2.2 上样液pH 值对树脂吸附率的影响
pH 值对总黄酮吸附率的影响见表3。
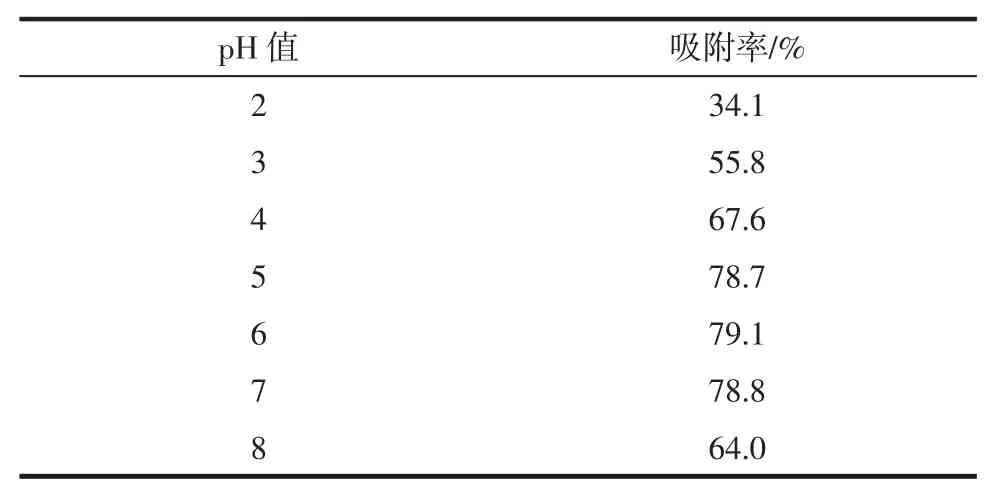
表3 pH 值对总黄酮吸附率的影响Table 3 Effect of pH on the adsorption rate of total flavonoids
由表3 可知,上样pH 值对大孔树脂纯化总黄酮的吸附率影响较大,大孔树脂纯化总黄酮吸附率随着pH 值的增大而逐渐增大,在pH 值为6 时最大,其后逐渐降低,故后续单因素试验选取吸附pH 值为6。
2.2.3 上样流速对总黄酮保留率的影响
上样流速对总黄酮保留率的影响见表4。

表4 上样流速对保留率的影响Table 4 Effect of loading flow rate on retention rate
由表4 可知,当以越低的上样流速通过色谱柱时,总黄酮就越能和树脂充分接触,总黄酮保留率越高。因此本试验中选取1.5 BV/h 作为试验最佳上样流速。
2.2.4 上样体积的考察
上样体积对流出液总黄酮浓度的影响见图1。
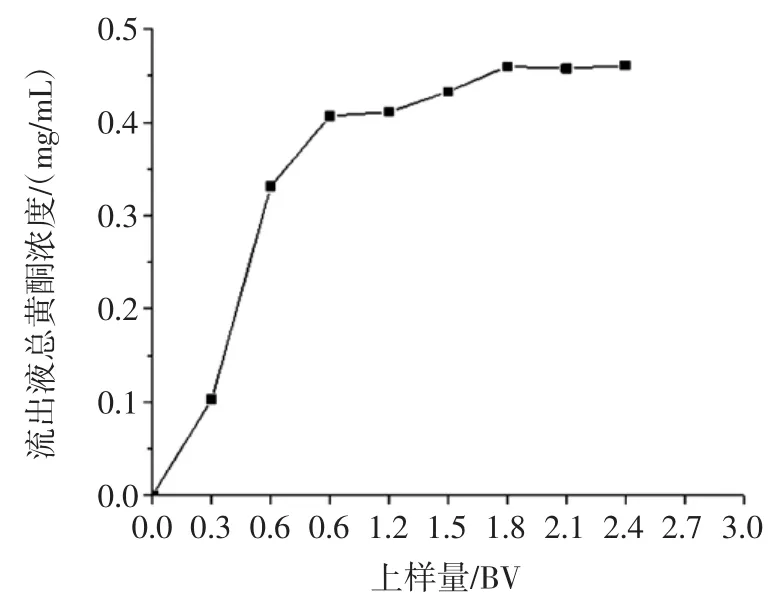
图1 上样体积的考察Fig.1 Investigation of the loading volume
结果如图1,当上样体积达到0.3 BV 时流出液开始有总黄酮泄露,而后总黄酮浓度随着上样液体积的增加而逐渐增加,当柱床体积达到1.8 BV 以上时,AB-8 型大孔树脂对总黄酮的吸附量达到吸附平衡,但考虑到泄露过多造成浪费,故综合考量最佳上样体积为1.2 BV。
2.2.5 水洗用量考察
水洗用量对流出液总黄酮浓度的影响见图2。

图2 水洗用量曲线Fig.2 Washing dosage curve
结果见图2,洗脱开始时便有总黄酮的泄露,而当蒸馏水洗脱用量达到3.5 BV 时,总黄酮的流出基本达到平衡,所以确定洗脱蒸馏水用量为3.5 BV。
2.2.6 洗脱液浓度对树脂解吸率的影响
洗脱液浓度对解吸率影响见表5。
由表5 可知,解吸率随着洗脱液浓度的增加而增加,而当洗脱液浓度达到60%时解吸率达到最大,其后逐渐降低但降幅不大,可能是总黄酮的极性与60%乙醇的极性更为相似,因此选取60%作为洗脱液浓度。
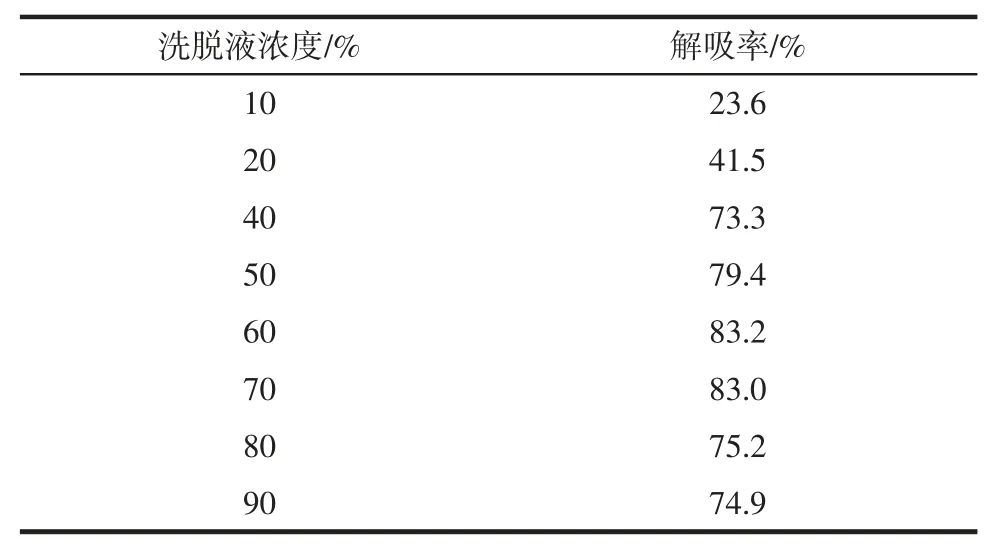
表5 洗脱液浓度对解吸率影响Table 5 Effect of eluent concentration on desorption rate
2.2.7 乙醇洗脱用量考察
洗脱液体积对流出液总黄酮浓度的影响见图3。

图3 洗脱曲线Fig.3 Elution curve
由图3 可知,当洗脱体积达到3 BV 时可以基本解吸完全,再添加洗脱液时,也会有总黄酮的流出,但浓度很低。从成本方面考虑,选取3 BV 洗脱液进行洗脱。
2.2.8 验证性试验
称取适量AB-8 型大孔树脂进行湿法上柱,维持柱体积为12 mL,加入1.2 BV 的4 mg/mL 的上样液到树脂柱中进行动态吸附,调节上样流速为1.5 BV/h,上样pH 值为6,吸附完成后加入3.5 BV 蒸馏水水洗,用3 BV 的60%乙醇对大孔树脂进行洗脱。5 次平行试验总黄酮保留率分别为60.4%、61.0%、61.6%、61.5%、61.2%,平均值为61.1%,RSD 值为0.78%,表明重复性较好。
2.3 金鸡毛草叶总黄酮纯度的测定
经过AB-8 型大孔树脂纯化后,金鸡毛草叶总黄酮的纯度由5.83%提升至30.54%,纯化液总黄酮纯度是粗提液的5.24 倍。
2.4 抗氧化活性研究
2.4.1 DPPH·清除活性
AB-8 型树脂总黄酮纯化液和VC对DPPH·的清除率见图4。
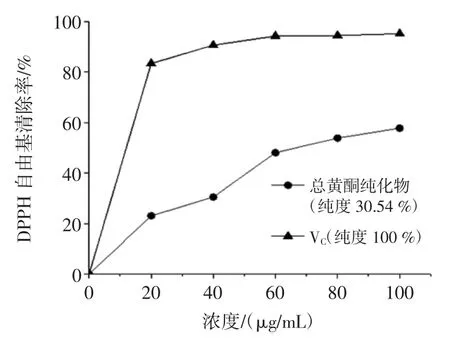
图4 AB-8 型树脂总黄酮纯化液和VC 对DPPH·的清除率Fig.4 Clearance of DPPH·by total flavonoids purified by AB-8 resin and VC
结果见图4,对照品纯度为100%的维生素C 在20 μg/mL~100 μg/mL 浓度范围内对 DPPH 自由基清除率为 83.33%~95.13%,在 100 μg/mL 时对 DPPH 自由基清除率已达到最大为95.13%。经AB-8 型大孔树脂纯化的纯度为30.54%的金鸡毛草叶总黄酮,其DPPH 清除率随浓度增大而增大,在干浸膏质量浓度20 μg/mL~100 μg/mL 浓度范围内对 DPPH 自由基清除率为23.10%~57.76%,在 100 μg/mL 时对 DPPH 自由基清除率达到最大为57.76%,为VC的DPPH 自由基清除率的0.61 倍。因此DPPH 自由基清除率:VC(纯度100%)>AB-8 型大孔树脂纯化的总黄酮(纯度30.54%)。
2.4.2 ·OH 清除率
浓度为100μg/mLVC溶液的·OH 清除率是10.20%,经大孔树脂纯化的纯度为30.53%的金鸡毛草叶总黄酮在干浸膏质量浓度为100 μg/mL 溶液时对于·OH 清除率为3.76%,是VC的0.37 倍。而·OH 自由基清除率越大则证明抗氧化活性越强,因此·OH 清除率:VC(纯度100 %)>AB-8 型大孔树脂纯化的总黄酮(纯度30.54%)。
2.4.3 ABTS+·清除率测定
AB-8 型树脂总黄酮纯化液和VC对ABTS+·的清除率见图5。
结果见图5,纯度为100%的对照品VC在3.6 μg/mL~18.2 μg/mL 浓度范围内对 ABTS+·清除率为 49.51%~100%,VC的浓度为 10.8 μg/mL 时 ABTS+·清除率已经到了100 %。经AB-8 型大孔树脂纯化的纯度为30.54%的金鸡毛草叶总黄酮ABTS+·清除率随浓度的升高而升高,在干浸膏质量浓度3.6 μg/mL~18.2 μg/mL浓度范围内对ABTS+·清除率为33.27%~87.90%,在18.2 μg/mL 时对 ABTS+·清除率达到最大为 87.90%,是VC的0.88 倍。ABTS+·清除率越大则证明抗氧化力越强,因此ABTS+·清除率:VC(纯度100%)>AB-8 型大孔树脂纯化的总黄酮(纯度30.54%)。
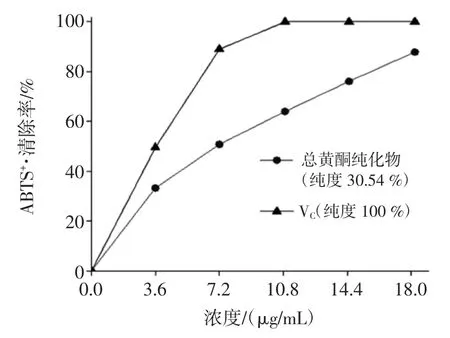
图5 AB-8 型树脂总黄酮纯化液和VC 对ABTS+·的清除率Fig.5 Clearance of ABTS+·by total flavonoids purified by AB-8 resin and VC
3 结论
用静态吸附试验筛选出最佳树脂为AB-8 型,经过单因素试验考察,动态吸附最优条件为上样浓度为4 mg/mL、上样体积为1.2 BVmL、上样流速为1.5 BV/h、上样pH 为6、洗脱水用量为3.5 BV、乙醇洗脱浓度为60%,乙醇洗脱用量为3 BV。在此条件下纯化后总黄酮的保留率为61.1%,纯度由5.83%提升至30.54%,提高至5.24 倍,林秋凤等[21]报道经大孔树脂纯化后的金莲花总黄酮的纯度提高了2.88 倍相比较,本研究中的大孔树脂纯化工艺对金鸡毛草叶总黄酮的纯化效果较好。
抗氧化活性数据显示,经大孔树脂纯化的纯度为30.54 %的金鸡毛草叶总黄酮在干浸膏质量浓度100 μg/mL 时对DPPH 自由基清除率达到最大清除率为57.76 %,为VC的0.61 倍;在干浸膏质量浓度18.2 μg/mL 时对 ABTS+·清除率达到最大为 87.90%,是VC的0.88 倍;在干浸膏质量浓度100 μg/mL 时对·OH 的清除率为3.76%,是VC的0.37 倍。因此金鸡毛草叶总黄酮经过大孔树脂纯化后在纯度为30.54%时有一定的抗氧化能力,对于DPPH 自由基、·OH 自由基及总抗氧化能力随抗氧化剂浓度增强而增强,该试验可为金鸡毛草的深入开发、产业附加值的提高提供参考依据。
本试验是基于相同干浸膏质量浓度条件下,比较了金鸡毛草叶总黄酮纯化物与VC的抗氧化性能,虽然金鸡毛草叶总黄酮纯化物在纯度为30.54%情况下抗氧化能力不比上纯度100%的VC,但是并不表示金鸡毛草叶总黄酮的抗氧化能力比不上VC,因为抗氧化能力还与纯度有关,所以后续试验将继续探讨对相同纯度下金鸡毛草叶总黄酮纯化物与VC的抗氧化性能进行比较,比便于进一步衡量金鸡毛草叶总黄酮在体外的抗氧化活性。
