硫化氢对硼毒害下星星草幼苗SOD、POD活性的影响
2019-10-12
(天津渤海职业技术学院,天津 300402)
一、前言
星星草(Puccinelliatenuiflora),该植物具有较强的适应性,不仅耐盐,耐寒,耐旱,而且耐碱性也较强,多生长在草甸,盐渍化土壤地区,一般在土壤含盐量达到>5%以上,PH值大于10及10以上,仍能生长良好。星星草还具有结实多,种子发芽率高,富含大量的粗蛋白质、粗脂肪和矿质元素等特点,是一种改良盐碱化土壤的先锋植物。硼是高等植物所必须的一种微量元素,在土壤中以多种形式存在,除了以分子和离子形式存在外,大多数以无机和有机形式存在。如果土壤中的硼元素不足,则会造成缺硼现象,如果硼元素过量,则会对植物产生毒害作用。植物硼的缺乏量,适用量和毒害量之间的浓度范围一般很小,相对于缺硼现象,硼毒害现象更为常见。据调查,在我国吉林,辽宁,西藏和青海等地区的植物硼毒害现象较为严重,引起了广泛的关注。关于缓解硼毒害的方法,大部分是添加其他元素如硅、磷等,而用H2S缓解硼毒害的方法则较少使用。
20世纪90年代左右,首次证明H2S是一种神经活性物质,从此人们开始加强对其生理功能的研究。Bressanra等研究结果表明,当植物置于较高的硫素环境时,会产生H2S,并揭示H2S参与植物的生理过程。据报道,H2S可以缓解铜毒害下种子的萌发,而且可以保护在渗透胁迫下植物免受氧化损伤。本实验以星星草为对象,研究H2S对硼毒害下星星草幼苗体内SOD、POD活性的影响,旨在为缓解硼毒害严重地区植物的生长受阻问题提供科学依据。本实验以NaHS作为H2S供体,既可以保证H2S分子的含量,又可以起到稳定pH值的作用。
二、材料与方法
(一)材料
1.实验材料
星星草幼苗
2.仪器与实验用具
天平(电子分析天平,ACCULAB)、广口瓶、气泵、玻璃培养平皿、微量移液器、研钵等。
3.试剂
1/2 Hoagland营养液,用硼酸配成250 mg/L的硼溶液,配制200 μmol/L NaHS溶液等。
(二)实验步骤
1. 星星草培养与处理
(1)培育受试植物
星星草幼苗是在实验室环境下培育所得,用土培法在育苗盘中培养,每日按时喷洒营养液,30天后可用。
(2)植物培养方法:水培法
用1/2 Hoagland营养液进行植物培养。容器为1 L的广口瓶,具盖子。塞子有三个孔,中间的两个大孔用来固定植物(孔的大小由植物大小来决定),旁边的孔用来通气。待实验苗进入快速生长阶段,选取长势一致,称重统一在一定范围内生长良好的植株,用清水将根冲洗干净,再用脱脂棉将植物固定于容器。
(3)外源物质H2S供体硫氢化钠溶液的配制
H2S浓度实验:使用 NaHS溶液作为H2S的供体。
处理液的配制:取一定量体积的10 mmol/LNaHS母液,用蒸馏水稀释成浓度为200 μmol/L NaHS溶液。
(4)实验处理受试植物
4个处理(表1),每个处理都均有2个重复。

表1 不同处理下的星星草幼苗
2.抗氧化物酶活性的测定
(1)超氧化物歧化酶(SOD)活性的测定
方法:氮蓝四唑(NBT)光化还原法测定
A:原理:超氧物歧化酶(SOD)是动植物体内普遍存在的一种清除超氧负离子的酶。
B:试剂:a.0.1 mol/L pH7.8磷酸钠(NaHPO4-NaH2PO4)缓冲液(PBS)
b.50 mmol/L pH7.8磷酸钠缓冲液(用0.1 mol/L pH7.8磷酸钠缓冲液配制而成)
c.14.5 mm/L dl-甲硫氨酸(MW=149.21g)(用50 mmol/L pH7.8 PBS配制,用前配制,避光保存)
d.3 μmol/L EDTA(MW=292) (用50 mmol/L pH7.8 PBS配制,用前配制,避光保存)
e.2.25 mm/LNBT(MW=817.7)溶液(用50 mmol/L pH7.8 PBS配制,用前配制,避光保存)
f.60 μmol/L核黃素(MW=376.36)溶液(用50 mmol/L pH7.8 PBS配制,用前配制,避光保存)
C:酶活性测定
测定前在270 ml 14.5 mmol/L dl-甲硫氨酸(dl-蛋氨酸)中分别加入EDTA、NBT、核黄素溶液各10 ml,混匀,此为反应混合液。
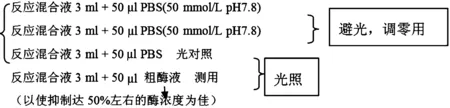
SOD活性单位是以抑制NBT光化还原的50%为一个酶活性单位,用紫外分光光度计在560 nm波长下测定吸光值,计算反应被抑制的百分比。
D:酶活力计算公式
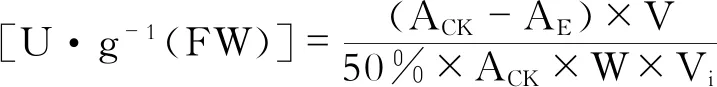
式中,SOD总活性以鲜重酶单位每克表示,Ack为光照对照管的吸光度;AE为样品管的吸光度;V为样品液总体积,mL;Vt为测定时样品用量,mL;W为样品鲜重,g。
(2)过氧化物酶(POD)活性测定
方法:愈创木酚法
A:原理:本实验以愈创木酚(邻甲氧基苯酚)为供氢体,为测定POD的经典方法。
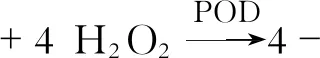
B:试剂:30%过氧化氢、愈创木酚、100 mmol/L磷酸缓冲液(pH6.0)、20 mmol/LKH2PO4、反应混合液[100 mmol/L PH6.0磷酸缓冲液50 mL,混匀后保存在冰箱中。
C:酶活性測定
取3支试管,加入反应混合液、KH2PO4溶液和相应的酶液(如表2),立即开启秒表,然后于470 nm波长下测定吸光值,每1 min读数一次(4 min)。
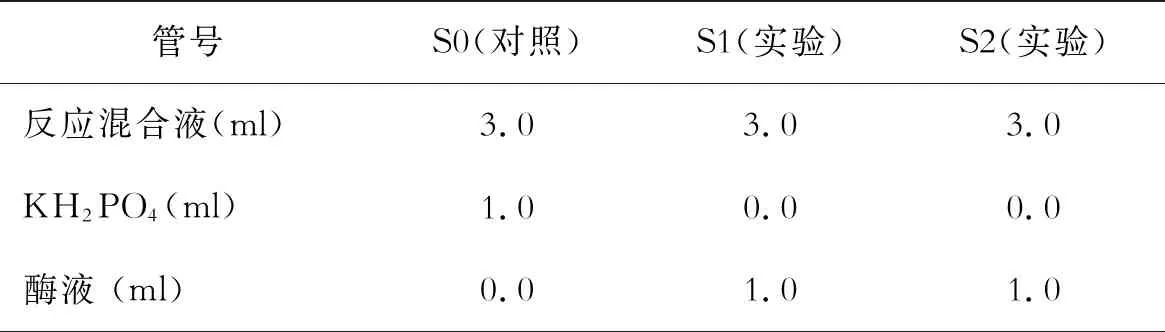
表2 紫外吸收法测定过氧化物酶活性配置表
D:酶活力计算公式
POD总活性[U·min-1g-1(FW)]=
式中:POD总活性以酶单位每克鲜重表示。其中 △470=ACK-AE
比活力单位以酶单位每毫克蛋白表示。
ACK——照光对照管的吸光度。
AE——样品管的吸光度。
Vt——样品液总体积,mL。
V1——测定时样品用量,mL。
W——样品鲜重,g。
三、结果与分析
(一)不同处理下星星草幼苗的长势情况

图1 不同处理下星星草幼苗生长状况
由图1可以看出,在200 μmol /L的H2S处理下,该组幼苗和对照组的星星草幼苗长势情况基本一致,而在250 mg/L 的硼毒害作用下,星星草幼苗长势出现枯萎,发黄现象,说明星星草明显受到了硼毒害作用,当用200 μmol /L的H2S和250 mg/L的硼共同处理星星草幼苗,发现长势虽不如对照组和200 μmol /L的H2S处理下的星星草幼苗,但也得到了一定的缓解作用。
(二) H2S对硼毒害下星星草幼苗超氧化物歧化酶(SOD)活性的影响
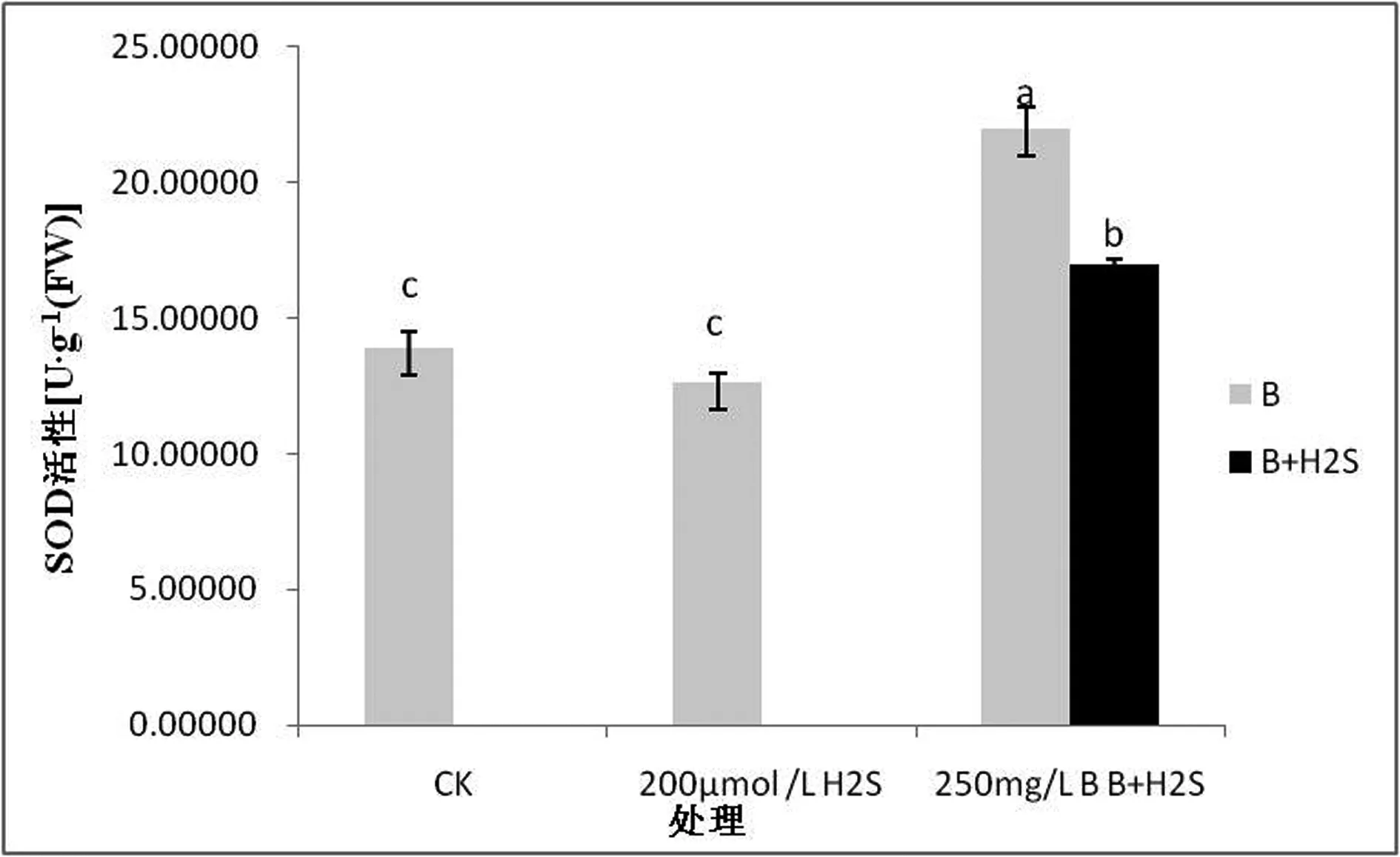
图2 H2S对硼胁迫下星星草幼苗体内SOD酶活性影响
由图2可以看出,在适量的硼浓度条件下,星星草幼苗体内的酶活性约为13.88555 U·g-1(FW),当用200 μmol/L的H2S处理后,星星草幼苗SOD活性为12.656 U·g-1(FW),说明H2S对星星草幼苗体内的SOD活性会有一定的影响,但差异不显著;当用高硼溶液处理星星草,发现其体内的SOD活性为21.9678 U·g-1(FW),与空白对照组相比较,有显著升高的趋势,而当用H2S缓解高硼毒害下的星星草幼苗,发现其体内的SOD活性为16.9595 U·g-1(FW),与空白对照组相比较有显著升高的趋势,与仅在高硼毒害下的星星草幼苗相比较SOD活性有显著降低的趋势。
(三)H2S对硼毒害下星星草幼苗过氧化物酶(POD)活性的影响
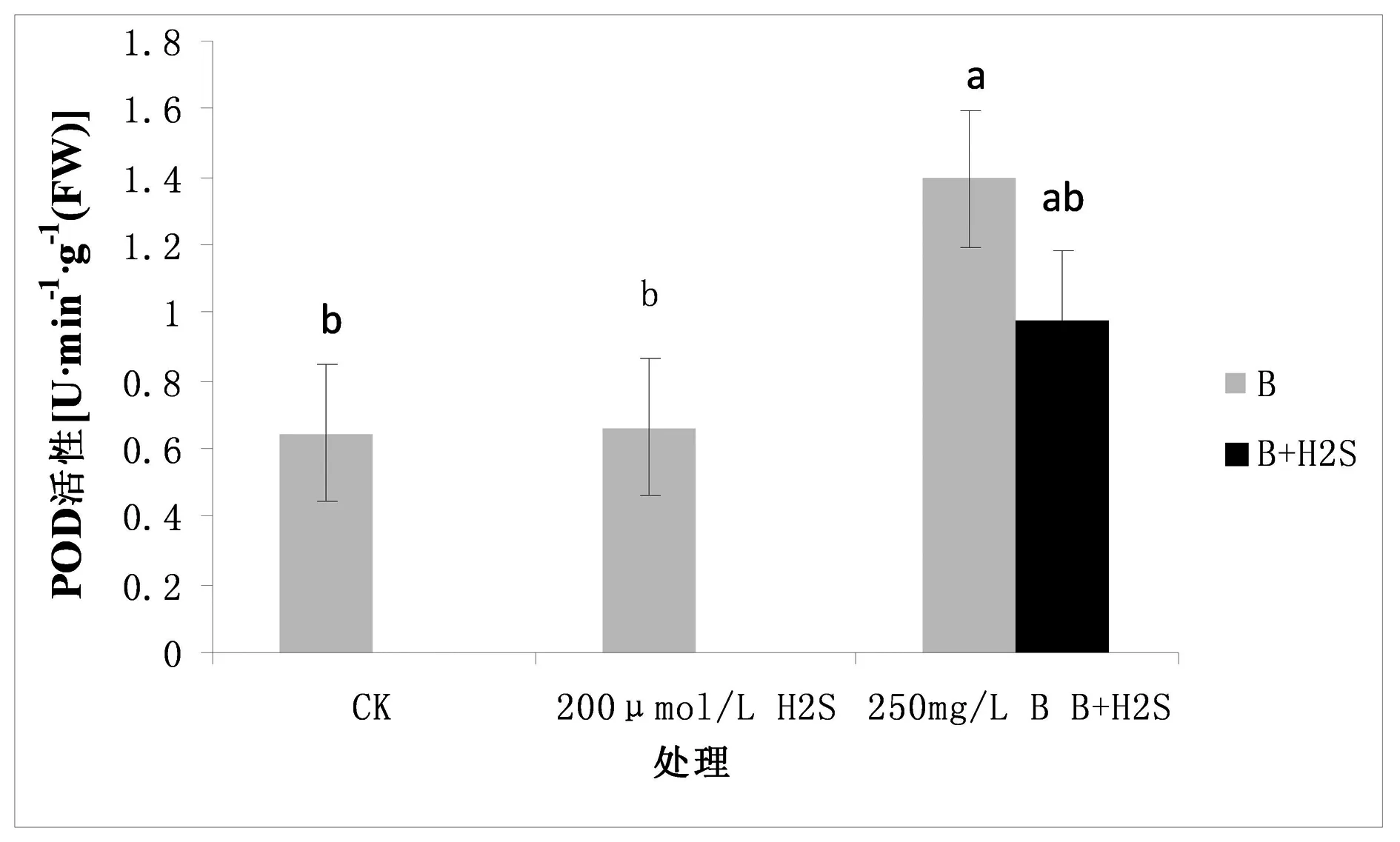
图3 H2S对硼毒害下星星草幼苗过氧化物酶(POD)活性的影响
由图3可以看出,在适量的硼浓度条件下,星星草幼苗体内的酶活性约为0.646 U·min-1g-1(FW),当用200 μmol/L的H2S处理后,星星草幼苗POD活性为0.663 U·min-1g-1(FW),说明H2S对星星草幼苗体内的POD活性会有一定的影响,但差异不显著;当用高硼溶液处理星星草,发现其体内的SOD活性为1.394 U·min-1g-1(FW),与空白对照组相比较,有显著升高的趋势,而当用H2S缓解高硼毒害下的星星草幼苗,发现其体内的POD活性为0.981 U·min-1g-1(FW),与空白对照组相比较有升高的趋势,但效果不显著,与仅在高硼毒害下的星星草幼苗相比较POD活性有显著降低的趋势,效果也不显著。
四、 结论与小结
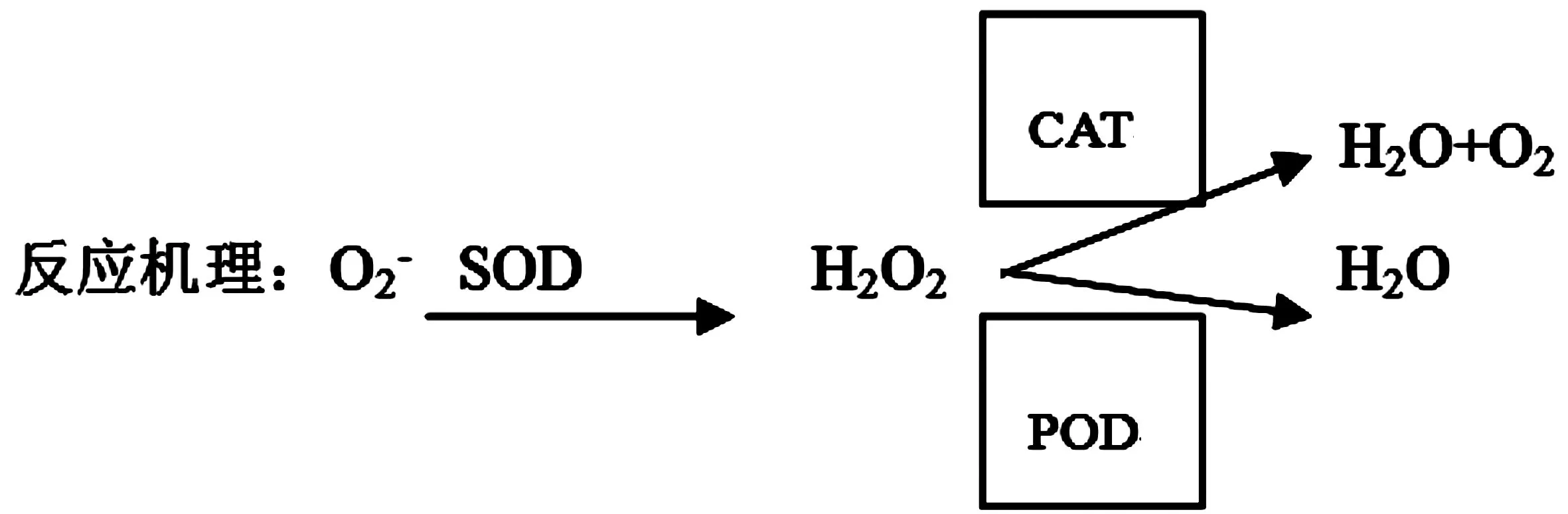
一般认为,重金属对幼苗生长的影响存在一个高浓度下的抑制效应,硼作为化学性元素,也具有同样的效应。许多研究者认为,植物在新陈代谢过程中,遭受逆境如干早、低温、重金属毒害、盐害、强光辐射等胁迫以及植物的衰老都会造成氧伤害积累,不断产生活性氧。SOD和POD是氧自由基伤害中非常重要的2种保护酶,一般情况下,SOD是植物体内清除自由基的第一道防线,它能立即对胁迫做出反应,合成表达增强,使O2-转变为H2O2与O2;POD可以将SOD产生的H2O2转化为H2O,它们的主要功能就是能有效地清除掉植物体内过多的超氧负离子,有效地阻止高浓度氧的累积,使植物能够维持正常的发育和生长。酶活性越高,就越能有效地起作用,植物也就越能抵抗逆境的胁迫。
实验结果表明,H2S对硼毒害下星星草幼苗体内超氧化物歧化酶(SOD)、过氧化物酶(POD)活性具有一定的影响。当星星草幼苗在硼毒害处理下,体内超氧化物歧化酶(SOD)活性,与空白对照组和H2S处理组的酶活性相比发生了显著性的升高,因为酶活性的升高是为了抵抗硼毒害下逆境的胁迫,而当用H2S缓解硼毒害下的星星草,发现其体内的超氧化物歧化酶(SOD)活性与硼毒害组的酶活性相比发生了显著的降低,与空白对照组相比发生了显著性的升高,说明H2S对硼毒害的星星草幼苗具有一定的缓解作用,但是酶活性仍高于对照组,还是处于硼胁迫的环境下;当星星草幼苗在硼毒害处理下,过氧化物酶(POD)活性,与空白对照组和H2S处理组的酶活性相比发生了显著性的升高,因为酶活性的升高是为了抵抗硼毒害下逆境的胁迫,而当用H2S缓解硼毒害下的星星草,发现其体内的过氧化物酶(POD)活性与硼毒害组的酶活性相比,虽有下降,但效果不显著,与空白对照组相比酶活性虽有升高,但效果不显著,可能是本实验的浓度还与最适浓度有一定差距。
