间接竞争酶联免疫分析方法检测花生中黄曲霉毒素B1
2019-10-12潘明飞李诗洁郭丹丹王俊平
潘明飞 李诗洁 郭丹丹 王俊平 王 硕
(教育部食品安全与营养重点实验室 天津科技大学 天津 300457)
黄曲霉毒素(Aflatoxin,AF)是一种典型的真菌毒素,是主要由黄曲霉和寄生曲霉菌产生的一类次生代谢产物[1-2]。根据其化学结构和毒性差异,主要分为 B1、G1、G2、M1、M25 种,均为二氢呋喃香豆素的衍生物[3]。AF广泛存在于黄曲霉污染的花生、玉米、大米等农作物产品及其制品中,其中粮食食品中主要以B1,G1,G2为主,牛乳及其制品中主要是M1、M2。AFB1的毒性最强,有相当强的致畸、致癌、致突变作用[4-5]。其毒性可达到氰化钾的10倍,砒霜的68倍,三聚氰胺的416倍。AFB1可通过诱导人类p53肿瘤抑制基因的249位密码子突变,从而引发肝癌等恶性疾病[6-7]。据报道,在亚非地区,肝癌发病率直接与被AFB1污染食物的消费情况成正比。1993年,国际癌症研究机构(International Agency for Research on Cancer,IARC)正式将AFB1列为IA类致癌物质[8],认为其是一种毒性极强的物质。另外,AF属于天然毒素,其产生与环境因素密切相关。在作物种植、收获、储藏和加工过程中,很难避免和防止产毒真菌的危害,其含量也随着农作物生长、收获、加工、储运过程中菌体生长和污染程度加深而日趋上升[9-11]。国际上对食品和农产品产业链条的各环节中AF含量都进行严格监管。
迄今为止,许多国家和组织均对AF在食品中设定了最高残留限量(Maximum Residue Limits),如中国[12]和美国[13]针对玉米、花生仁、花生油中AFB1的 MRLs均为 20 μg/kg,欧盟[14]为 2 μg/kg。然而,近年来,有关AF引起对粮食、油料等食品的污染事件屡见不鲜,对食品质量和人类健康造成极大的威胁,给社会经济造成极大的损失。同时,各种基于不同原理的检测分析方法也逐渐被开发出来用于不同样品中AFB1的定性、定量分析。目前常用的AFB1检测方法主要有如薄层色谱法[15-16]、高效液相色谱法(High Performance Liquid Chromatography,HPLC)[17-18]及液-质谱联用技术,如气-质谱联用(Gas Chromatograph-Mass Spectrometer,GC-MS)[19]、 液-质联用(Liquid Chromatograph-Mass Spectrometer,LC-MS)[20-21]等。仪器分析方法能够为食品中AFB1污染物提供准确度和灵敏度相对较高的分析,然而存在仪器昂贵,需要操作相对复杂,繁琐的样品前处理过程,检测耗时长等问题,不适合大量样品筛查及现场快速检测。基于抗原-抗体特异性反应的免疫分析技术具有灵敏、精确、快速、成本低廉等特点,在大量样品快速筛查、现场快速检测方面,有无可比拟的优势。
鉴于此,本研究以高毒性的AFB1污染物为研究对象,通过对一系列关键试验条件的优化比较,建立一种灵敏度高、准确性好的间接竞争酶联免疫分析方法(Indirect competitive enzyme-linked immunosorbent assay,ic-ELISA),并成功用于花生中AFB1的检测。本研究为食品中AF污染物的快速筛查、现场分析提供一种高效、可行的分析方法,为进一步提升食品安全检测水平,保障食品产品质量提供技术支持。
1 材料与试验方法
1.1 试剂、材料与仪器
目标物 AFB1及其结构类似物 AFG1、AFG2、AFM1、AFM2均购于美国 Sigma-Aldrich公司;AFB1单克隆抗体购自山东绿都生物科技有限公司;羊抗鼠二抗、1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺(EDC)、N,N-二甲基甲酰胺(DMF)、鸡卵白蛋白(OVA)、羧甲基羟胺(CMO)、牛血清白蛋白(BSA)、明胶、鱼皮胶、过氧化氢脲、3,3,5,5-四甲基联苯胺(TMB)均购于美国 Sigma-Aldrich公司;研究所用其它化学药品如β-环糊精、柠檬酸、无水醋酸钠、氯化钠、氯化钾、磷酸二氢钾、磷酸氢二钠、碳酸钠、碳酸氢钠(分析纯)等均购于天津市化学试剂三厂。
96孔酶标板、酶标仪(Multiskan Spectrum),美国Thermo公司;周转式振摇器(MS3),德国IKA公司;8 道微量移液器(10~100 μL),德国 Eppendorf公司;高速冷冻离心机(5810r),德国 Eppendorf公司;超纯水系统,美国Millipore公司。
1.2 试验方法
1.2.1 AFB1包被抗原的制备 半抗原的合成:准确称取5.0 mg AFB1置于圆底烧瓶中,加入200 μL甲醇,充分溶解后加入12.0 mg CMO,1.0 mL无水吡啶,氩气保护下室温搅拌反应24 h,得橙红色溶液,50℃下真空干燥,得AFB肟化物(AFB1O)。
包被抗原(AFB1-OVA)(3.15 mg/mL)的制备:准确称取4.28 mg AFB1O和3.98 mg EDC,溶解于300 μL DMF,搅拌均匀,4℃活化过夜。另称取10.0 mg OVA溶于2.0 mL碳酸氢钠缓冲液(0.13 mol/L,pH 8.1)。在冰浴条件下逐滴加入活化产物,室温反应2 h后4℃下反应过夜。收集所得产物在PBS 溶液(0.01 mol/L,pH 7.4)透析 72 h,4 ℃保存备用。
1.2.2 ic-ELISA方法条件优化 研究过程中,针对ic-ELISA方法一系列关键试验参数包括抗原包被量(0.01,0.05,0.1,0.5 μg/孔)、抗体稀释倍数(1∶8 000,1∶16 000,1∶32 000,1∶64 000)、 封闭液的种类和浓度(0.1%脱脂乳粉、0.5%脱脂乳粉、0.5%BSA、0.5%鱼皮胶、0.5%明胶)、缓冲液种类及缓冲离子强度(0.01 mol/L PBS、0.05 mol/L PBS、0.01 mol/L PB)、 缓冲液 pH 值(5.7,7.4,8.5)进行了详细优化。并根据优化试验结果,绘制方法标准曲线。
1.2.3 ic-ELISA检测过程 抗原包被:以碳酸盐缓冲液(0.05 mol/L)为包被液稀释包被原至1 μg/mL,加入到 96 孔酶标板中,100 μL/孔(0.1 μg/孔的包被量),4℃条件包被14~16 h,弃去包被液,用PBST缓冲液(0.01 mol/L,pH 7.4)洗板 3次,拍干。
封闭:用0.1%脱脂乳粉以200 μL/孔封闭酶标板,于37℃培养箱中静置1 h,弃去封闭液,用PBST缓冲液洗板3次,拍干。
测定:对照组每孔加入50 μL 0.01 mol/L PBS缓冲液(pH 7.4),抑制组每孔加入50 μL一系列梯度浓度的 AFB1标准品溶液(0.005,0.01,0.025,0.05,0.1,0.25,0.5,1,2.5 以及 5 μg/L)。向对照组和抑制组中各加入 50 μL AFB1抗体溶液(1∶64 000倍稀释),于37℃培养箱静置反应1 h,用PBST缓冲液洗板4次,拍干;向每孔中加入100 μL 0.01 mol/L PBS缓冲液(pH 7.4)稀释10 000倍的山羊抗鼠酶标二抗,于37℃培养箱反应0.5 h,用PBST缓冲液洗板5次,拍干;
显色:向每孔中加入100 μL底物溶液,于37℃培养箱孵育0.5 h,用1.25 mol/L H2SO4终止显色,并在λ=450 nm条件下读取吸光度值。
1.2.4 方法特异性评价 本试验选用5种AFB1类似物(AFB2,AFG1,AFG2,AFM1,AFM2)以及 4 种生物毒素(玉米赤霉烯酮(ZEN)、呕吐毒素(DON)、伏马毒素 B1(FB1)、T-2 毒素),通过计算各标准品的IC50值,对所建立的ic-ELISA方法特异性进行评价。
1.2.5 实际样品测定 准确称取2.0 g粉碎花生样品置于15 mL离心管中,加入4.0 mL 70% 甲醇-PBS溶液(V/V),涡旋振荡 10 min后,5 000 r/min常温离心5 min,取上清液稀释20倍后建立抑制曲线。
2 结果与讨论
2.1 AFB1包被抗原的鉴定
2.1.1 半抗原AFB1O的鉴定 试验利用CMO将AFB1肟化生成半抗原AFB1O。表征图见图1。AFB1质谱图如图1a所示,ESI-MS:M:313.06(M=312.27)。AFB1O质谱图如图1b所示,ESI-MS:M:386.09(M=385.2)。经质谱分析,有AFB1O的单体峰存在,且AFB1的特征峰消失,证明该物质合成成功。

图1 AFB1与AFB1O质谱鉴定结果Fig.1 Mass spectrometry identification results of AFB1and AFB1O
2.1.2 包被原 AFB1O-OVA的鉴定 试验利用紫外-可见光谱仪分别测定了 AFB1、AFB1O以及AFB1O-OVA在200~600 nm处的吸光度值,并绘制紫外可见吸收光谱曲线,以鉴定包被原AFB1OOVA偶联情况,结果见图2。OVA仅在280 nm处有最大吸收峰,AFB1在360 nm处存在吸收峰,而AFB1O-OVA在两处均发生明显偏移,可推断AFB1O-OVA包被原偶联成功。
2.2 ic-ELISA方法工作条件的确定
2.2.1 抗原包被量与抗体稀释倍数的优化 试验选取不同包被浓度(0.01,0.05,0.1,0.5 μg/孔),抗体稀释8 000~64 000倍,绘制抑制率曲线并计算IC50值,以确定最佳抗原包被量以及抗体稀释倍数。结果见表1。当抗体稀释倍数在8 000和16 000倍时,ODmax值超过 1.2。当包被量为 0.1 μg/孔时可获得合适的OD值和较低的IC50值。当包被量为0.01 μg/孔时,虽然IC50值较低,但OD值偏低,易产生误差。最终确定包被原包被量为0.1 μg/孔,抗体稀释倍数为1∶64 000。

图2 AFB1O-OVA偶联鉴定结果Fig.2 UV-vis spectrometer identification of AFB1O-OVA

表1 包被原包被量及抗体稀释倍数的优化Table 1 The optimized amount of antigen and antibody
2.2.2 封闭液及缓冲液种类的优化 试验分别选取0.1%脱脂乳粉、0.5%脱脂乳粉、0.5%BSA、0.5%鱼皮胶、0.5%明胶5种蛋白作为方法封闭液,绘制抑制率曲线,结果见图3a。当选择0.1%脱脂乳粉作为封闭剂时,方法灵敏度较0.5% 脱脂乳粉及0.5%BSA作为封闭剂的灵敏度高,且线性范围好。而当选用鱼皮胶和明胶作为封闭液时,方法不成线性,无法建立抑制率曲线。故封闭液选择为取0.1%脱脂乳粉。
试验分别选取相同pH(7.4)的PBS缓冲溶液(0.01 mol/L)、PBS 缓冲溶液(0.05 mol/L)、PB 缓冲溶液(0.01 mol/L)作为方法缓冲液绘制抑制率曲线,结果见图3b。当选用PBS(0.01 mol/L)作为缓冲液时,曲线相关性较好,且灵敏度最高。最终确定 PBS缓冲溶液(0.01 mol/L,pH 7.4)作为方法缓冲液。

图3 封闭液及缓冲液种类的确定Fig.3 The optimization of types of blocking and dilution buffer
2.3 ic-ELISA检测方法的建立
根据上述优化结果,本试验确定了AFB1间接竞争ELISA方法的最优条件为:1)以0.1 μg/孔的抗原包被量对96孔板进行包被;2)抗体稀释倍数为1∶64 000;3)选择0.1%脱脂乳粉作为试验封闭液;4)标准品稀释液为PBS缓冲溶液(0.01 mol/L,pH 7.4)。选取 0.005,0.01,0.025,0.05,0.1,0.25,0.5,1.0,2.5 以及 5.0 μg/L 的 AFB1标准品溶液建立AFB1的标准曲线,如图4所示。本研究所建立的 ELISA 检测方法检出限(IC15)为 0.0066 μg/L;灵敏度(IC50)为 0.027 μg/L;抑制率曲线线性范围(IC20-IC80)为 0.0097~0.088 μg/L,相关系数 R2=0.999。

图4 AFB1ic-ELISA标准曲线(n=3)Fig.4 Standard curve of ic-ELISA for AFB1(n=3)
2.4 ic-ELISA检测方法的性能评价
2.4.1 精密度评价 试验通过计算板内变异系数和板间变异系数对所建立的ic-ELISA方法精密度进行评价(表2)。随着AFB1测定浓度的增加(0.005~5.0 μg/L),板内与板间变异系数(n=6)分别介于0.29%~16.9%和0.22%~21.19%之间,且逐渐降低,符合酶联免疫分析方法变异系数规律。
2.4.2 特异性评价 试验分别对AFB1的结构类似物(AFB2,AFM1,AFM2,AFG1,AFG2),以及其它 4种生物毒素(ZEN,DON,FB1,T-2)进行方法特异性测定,结果如表3所示。本研究所建立的分析方法对AFG1有较大交叉,交叉反应率达到158.82%,对 AFM2、AFB2、AFG2交叉反应率在0.62%~8.68%之间。该方法对其它类毒素均无交叉。

表2 icELISA板内及板间变异(n=6)Table 2 Intra and inter-assay coefficient CV of the ic-ELISA

表3 所建立的ic-ELISA方法对AFB1结构类似物及其它毒素的交叉反应Table 3 Cross-reactivity of the ic-ELISA with AFB1 analogues and other mycrotoxins
2.5 实际样品检测
2.5.1 样品基质影响及消除 用PBS缓冲液(0.01 mol/L)对花生提取液进行5倍、10倍、20倍、40倍稀释并用ELISA方法检测,确定最佳的稀释倍数。结果见表4。当稀释20倍时,ODmax最大,IC50值最小,可有效去除基质影响。
2.5.2 添加回收试验在花生样品中进行浓度范围为 0.2~200 μg/kg的梯度添加,以建立的 ic-ELISA方法进行检测,获得的花生样品检测曲线如图4所示,灵敏度IC50为0.99 μg/kg。在所选定的 3 个添加浓度(1.0,2.0,4.0 μg/kg)下,目标物AFB1的回收率达到96.67%~106.51%。说明所建立的方法针对花生样品可提供一种相对准确的分析方法。

表4 花生基质对建立的ic-ELISA检测方法的影响Table 4 The effect of peanut matrix on the developed ic-ELISA

图5 ic-ELISA方法检测花生中的AFB1Fig.5 Detection of AFB1in peanut sample by ic-ELISA
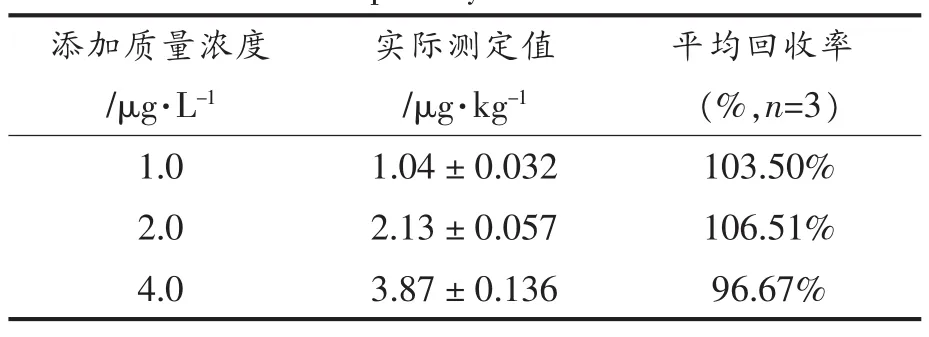
表5 ic-ELISA检测花生中AFB1添加回收试验结果Table 5 Recoveries of AFB1in spiked peanut samples by ic-ELISA
3 结论
本研究建立了一种检测花生中强毒性污染物黄曲霉毒素B1(AFB1)的间接竞争酶联免疫分析方法(ic-ELISA)检测方法。通过优化ic-ELISA检测方法的工作条件,最终确定抗原包被量为0.1 μg/孔,抗体稀释倍数为1∶64 000;选用0.1%的脱脂乳粉为封闭液,PBS缓冲溶液(0.01 mol/L,pH 7.4)作为样品稀释液。所建立的ic-ELISA检测方法检出限(LOD,IC15)为 0.0066 μg/L;灵敏度(IC50)为 0.027 μg/L;线性范围为:0.0097~0.088 μg/L;R2=0.999。方法对 AFG1交叉反应率为158.82%,对 AFM2、AFB2、AFG2交叉反应率在0.62%~8.68%之间,对其它生物毒素均无交叉。板内变异系数(n=6)为0.29%~16.9%,板间变异系数(n=6)为0.22%~21.19%。实际样品(花生)检测灵敏度(IC50)为 0.99 μg/kg,回收率范围为 96.67%~106.51%。本研究方法操作简便、灵敏度高、准确性好,在大量样品的AFB1筛查工作中有极大的优势,适用于低浓度AFB1残留样品的检测。方法可以作为谷物食品中黄曲霉毒素B1残留的快速检测的有用工具。
