重组SOD发酵液去除内毒素的效果研究
2019-10-12陈晓超崔文明李伟松刘树滔饶平凡
陈晓超 王 友 崔文明 李伟松 刘树滔* 饶平凡
(1福州大学生物科学与工程学院 福州 350108
2浙江工商大学食品与生物工程学院 杭州 310018)
超氧化物歧化酶(SOD)广泛存在于自然界一切生物体内,它能够催化超氧阴离子自由基(O2-)发生歧化反应,减轻或消除超氧阴离子自由基对生物体的氧化或过氧化损伤[1]。大量的前期研究表明,生物体的衰老、病变及辐射损伤等都与自由基在体内的形成密切相关,而SOD作为自由基清除剂具有抗衰老、抗炎症、抗辐射、抗自身免疫疾病和抑制肿瘤等生理功能[2-4]。人体中的超氧化物歧化酶有 3 种:Cu,Zn-SOD、Mn-SOD和EC-SOD。其中Cu,Zn-SOD在人体肝脏和大脑中含量最高,它以二聚体的形式存在于细胞质中[5]。作为人体关键的抗氧化酶类之一,SOD被广泛应用于医药、保健品、食疗和护肤美容等领域[6-8]。
迄今为止,国内各研究单位已成功利用不同原核生物系统大量表达重组人源SOD蛋白,例如在大肠杆菌和毕赤酵母发酵体系中成功构建与表达人源Cu,Zn-SOD[9-12],并应用于相关的抗放化疗辐射[13-14]、抗紫外线辐射[15-16]、抗脑缺血再灌注损伤[17]、皮肤创伤修复[18]等研究。然而,将基因重组技术制备的Cu,Zn-SOD应用于各种疾病的治疗,首先必须解决的问题是如何去除工程菌在发酵表达重组蛋白质过程中所造成的大量内毒素污染。如果未能解决这一关键纯化问题,后续的一系列临床前功能评价试验与潜在的临床应用都无法开展。
细菌内毒素是一种脂多糖,主要来源于革兰氏阴性菌的细胞壁,当细菌死亡或自溶后便会释放出内毒素[19-20]。内毒素是一种毒性极强的致炎和热原物质,极微量内毒素进入人体内,就会引起高热、腹泻、血管扩张,甚至休克或死亡[21]。对于非胃、肠道给药制剂中去除内毒素,始终是一项极其重要的任务[22]。目前常用的去除内毒素的方法有膜过滤/超滤、活性炭吸附、柱层析/离子交换色谱或亲和色谱法等多种[21,23-24]。本文采用活性炭吸附和Triton X-114萃取两种方法去除重组蛋白溶液中内毒素,通过对比二者在内毒素去除效率和重组蛋白回收率两个关键参数,确定适合于大批量处理重组Cu,Zn-SOD蛋白溶液中内毒素的最适工艺路线。本研究的目的在于有效清除重组蛋白溶液中的内毒素,并保证目标蛋白在纯化过程中高回收率,使纯化后蛋白溶液的内毒素含量能够达到药典中要求的注射剂的质量标准,完全可以应用于保健食品的开发。
1 材料与方法
1.1 材料与仪器
材料:重组人源Cu,Zn-SOD来自毕赤酵母的大量表达;分析纯级别活性炭和TirtonX-114等化学试剂均购自国药集团化学试剂有限公司;鲎试剂(灵敏度0.5 EU/mL),福州新北生化工业有限公司;内毒素工作标准品(10EU/支),福州新北生化工业有限公司;无菌注射用水,天津药业集团新郑股份有限公司;SOD酶活试剂盒,购自南京建成生物研究所。
仪器:UV-1900紫外分光光度计、CR15-RX型高速离心机,日本日立公司生产;Colour Squid电动磁力搅拌器、组织匀浆机,德国IKA公司生产;BS124-S型电子称、PB-10型pH计,德国Sartorius公司生产;1285classic II超净台、超低温冰箱,美国Thermo公司生产;HH-4型恒温水浴箱,常州国华电器公司生产。
1.2 试验方法
1.2.1 活性炭吸附法去除内毒素 向重组人源Cu,Zn-SOD蛋白溶液中添加1~10%(W/V)活性炭,4℃低温搅拌,定时取样待测SOD酶活力和内毒素含量。样品检测前先使用0.22微米孔径滤膜滤除活性炭颗粒,之后使用SOD试剂盒检测蛋白溶液中SOD酶活力,使用鲎试剂盒检测蛋白溶液中内毒素含量。
1.2.2 Triton X-114萃取法去除内毒素 向SOD蛋白溶液中添加1%Triton X-114,4℃低温搅拌至蛋白溶液澄清透明,转移蛋白溶液至37℃恒温水浴下保温15 min后,12 000 r/min高速离心10 min,取上层清液用于检测SOD酶活力及内毒素含量。
1.2.3 内毒素含量测定 按照《中国药典》第3部(2005版)进行[25]。在鲎试剂灵敏度复核试验与供试品干扰试验达标的情况下,使用灵敏度为0.25 EU/mL的鲎试剂,按照内毒素凝胶半定量法检测样品。
1.2.4 SOD酶活力测定 采用邻苯三酚自氧化方法测定SOD酶活力,具体操作按照南京建成生物工程研究所SOD试剂盒操作手册进行试验。
2 结果与讨论
2.1 内毒素限值的确定
参考药典[25],供试品的内毒素限值L=K/M,单位用EU/U表示;其中,K为人每公斤体重每小时最大可接受内毒素剂量,用 EU/(kg·h)表示;其中注射剂的 K=5 EU/(kg·h);M 为人用每公斤体重每小时的最大供试品剂量。按照参考文献[26]中,Cu,Zn-SOD纯蛋白的人体最大给药量约为32 mg/d,按酶比活换算为18 112 U酶活/天,一天给药3次。那么标准体重的人体按60 kg计,注射所用时间按1 h计,则标准人体每公斤每小时的Cu,Zn-SOD纯蛋白的最大给药量不得超过1 006 U/(kg·h)。由此可以通过L=K/M 公式得出 Cu,Zn-SOD蛋白溶液产品中内毒素限值为5.0×10-3EU/U,即每10 000酶活单位 Cu,Zn-SOD中内毒素含量应不超过50 EU效价。
2.2 活性炭吸附法
2.2.1 吸附时间对活性炭吸附效果的影响 首先考察活性炭吸附时间长短对内毒素吸附效果的影响。向pH 6.0的Cu,Zn-SOD蛋白溶液中添加1.0% 的活性炭,低温4℃搅拌,定时取样检测内毒素含量,结果如图1所示。随着吸附时间的增加,蛋白溶液中内毒素的含量逐渐减少。当吸附时间为2 h,内毒素含量从4.0×104EU/mL降至3.5×104EU/mL,降低了12.5%。随着吸附时间的继续延长,内毒素吸附效果变化不明显,推断该浓度下活性炭对内毒素的吸附能力在2 h左右趋于饱和。根据以上结果,后续活性炭吸附效果的评估试验均以吸附2 h进行对比。
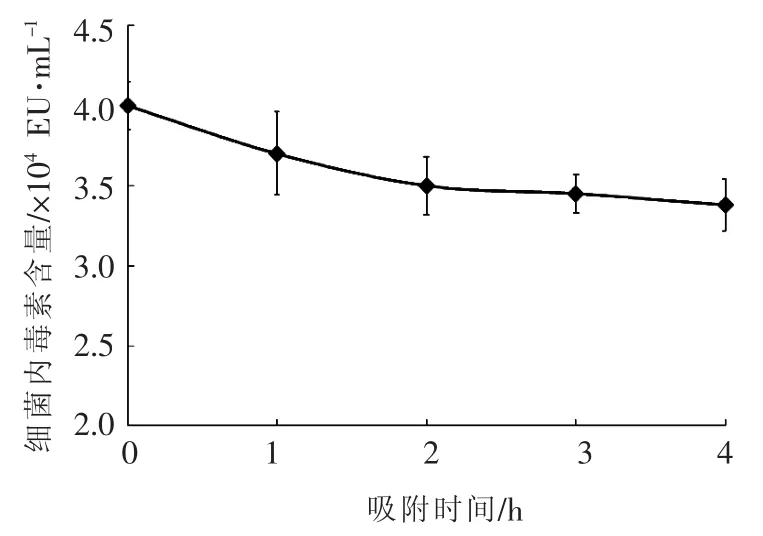
图1 活性炭吸附内毒素经时变化曲线Fig.1 Time dependent manner of endotoxin removal with active carbon adsorption
2.2.2 不同pH对活性炭吸附效果的影响 其次,在确定吸附时间为2 h后,通过调整Cu,Zn-SOD蛋白溶液pH值,来考察pH值对活性炭吸附内毒素效果的影响。由于本研究所表达的Cu,Zn-SOD的等电点在5.8左右,因此对pH值的优化筛选的考察范围设置在pH值5.0~7.0之间。试验结果如图2所示,蛋白溶液pH为7.0,6.5和6.0的条件下,活性炭对内毒素的吸附效率很低,仅为2.5%,10%和12.5%。在蛋白溶液pH为5.5的条件下,活性炭对内毒素的吸附效率有所提升,为22.5%。进一步降低蛋白溶液pH值至5.0,活性炭吸附内毒素的效果最佳,一次操作内毒素的去除率可以达到50.0%左右。由此可见,在弱酸性pH环境下,有利于提高活性炭吸附内毒素的效率。因此,在后续的蛋白纯化回收工艺设计中,以pH 5.0作为活性炭吸附过程的最适pH值,以达到内毒素吸附效果的最优化。
2.2.3 活性炭添加量对吸附效果的影响在上述试验基础上,进而考察活性炭添加量对内毒素去除效率的影响,后续优化试验调整蛋白溶液pH值为5.0。试验结果如图3所示,当活性炭的添加量在1%时,蛋白溶液内毒素含量从未处理前的4.0×104EU/mL 降低至 1.95×104EU/mL,去除率达到51.2%。继续增加活性炭的添加量达到3%时,蛋白溶液内毒素含量从未处理前的4.0×104EU/mL降低至1.8×104EU/mL,去除率达到55%。当活性炭的添加量上升为5%时,蛋白溶液内毒素含量从未处理前的 4.0×104EU/mL降低至 1.19×104EU/mL,去除率达到70.8%。如果继续增加活性炭使用量至10%时,蛋白溶液内毒素含量从未处理前的 4.0×104EU/mL 降低至 2.69×104EU/mL,去除率大幅度降低,仅为32.8%;其原因归结于10%的活性炭添加量导致蛋白溶液的黏度明显上升,搅拌效率显著降低,从而对活性炭吸附带来了负面影响。因此,在后续的蛋白纯化回收工艺设计中,选择5%的活性炭作为最适活性炭添加量,以达到内毒素去除效果的最优化。

图2 不同pH对活性炭吸附内毒素的影响Fig.2 Effects of pH values of protein solution on endotoxin absorption by active carbon
2.3 TritonX-114萃取法
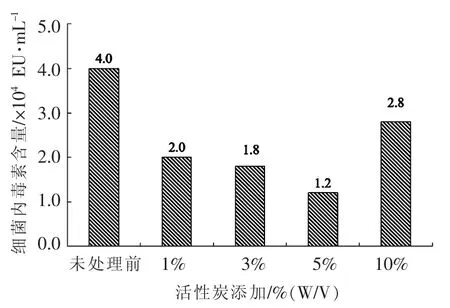
图3 不同活性炭添加量对内毒素吸附效果的影响Fig.3 Effects of concentrations of active carbon used on endotoxin adsorption
本试验考察Triton X-114萃取方法去除Cu,Zn-SOD蛋白溶液中内毒素的效率。向蛋白溶液直接添加1%(V/V)的Triton X-114,置于低温下,进行重复3次的萃取后,蛋白溶液中的内毒素含量明显降低,从未处理前的4.0×104EU/mL陡降至500 EU/mL,结果见图4。由于Triton X-114萃取过程中,对目标蛋白溶液产生一定程度的浓缩效应,因此蛋白溶液的SOD酶活有所上升,从35 564 U/mL增加到37 698 U/mL,蛋白溶液操作体积由未处理前的70 mL减少至64 mL,而该萃取过程的SOD酶活回收率高达96.9%。基于以上结果,可见Triton X-114萃取法去除内毒素的效率明显高于活性炭吸附法,而且在目标蛋白的回收率上也有着非常明显的优势;然而,从大批量去除内毒素的工艺操作成本角度出发,活性炭吸附法的优势在于低成本,原材料可重复使用。因此本研究旨在设计适用于大批量蛋白溶液纯化回收的工艺,综合考虑操作成本和纯化效率两个角度,后续工艺优化过程将结合采用活性炭吸附法和Triton X-114萃取法两种方式。
2.4 三步法去除内毒素工艺过程的优化
通过活性炭吸附和Triton X-114萃取相结合方式去除内毒素,试验结果如表1所示。经过第一轮5%活性炭吸附,内毒素含量从未处理前的4.0×104EU/mL降低至约10 000 EU/mL,内毒素吸附率达75%;SOD酶活力从未处理前的37 500 U/mL降低至31 500 U/mL,该步骤的目标蛋白回收率为81.4%。经过第二步的Triton X-114反复萃取,蛋白溶液中内毒素进一步降低至200 EU/mL,仅为未处理前蛋白溶液中内毒素含量的0.5%,目标蛋白SOD的回收率仍维持在79.6%左右。经过以上两步纯化步骤后,蛋白溶液中内毒素含量为每10 000酶活单位内毒素含量为57 EU效价,仍然略高于药典中对注射药品内毒素限值50 EU/10 000 U酶活的要求。因此随后继续增加一步活性炭吸附操作,蛋白溶液中细菌内毒素的含量降低为80 EU/mL,目标蛋白SOD的回收率为66%,可以换算成蛋白溶液中内毒素含量为每10 000酶活单位内毒素含量为26.8 EU效价。

图4 Triton X-114萃取前后与活性炭吸附前后内毒素的含量变化的对比Fig.4 Comparison of removal efficiency of endotoxin with Triton X-114 phase separation or active carbon adsorption
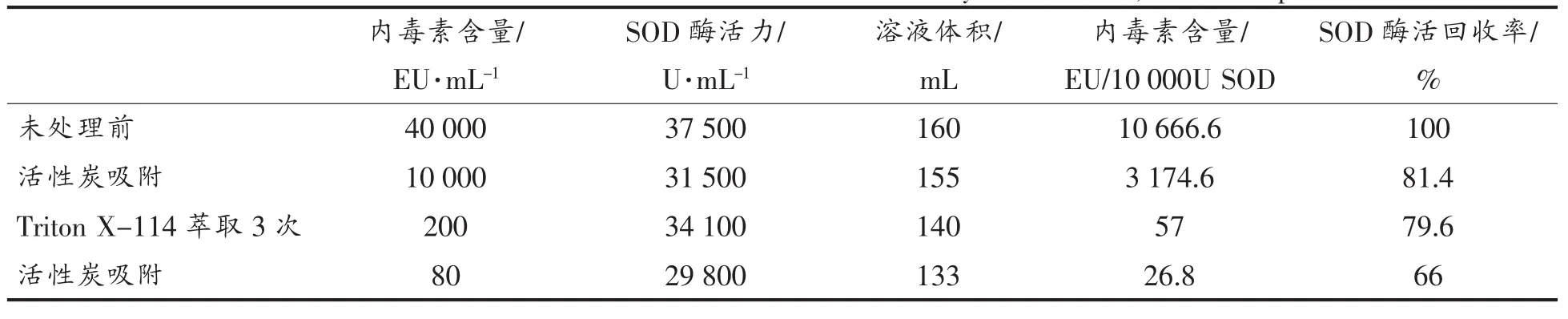
表1 三步法去除内毒素纯化与回收效率表Table 1 Results of removal rates of endotoxin and recovery rates of Cu,Zn-SOD protein
2.5 残留Triton X-114的去除
考虑到Triton X-114相分离法去除细菌内毒素后,蛋白溶液中仍有部分Triton X-114残留,对后期重组SOD蛋白在动物体内的安全性和功效性评价结果存在着影响。因此,后续试验采用高效液相色谱法检测蛋白溶液中Triton X-114的含量,明确三步法纯化去除内毒素过程中Triton X-114的残留量。首先将质量浓度分别为50,25,10,5,2.5,1.25 μg/mL 的 6 个 Triton X-114 标准样品经过反相高效液相色谱柱TSKgel ODS-100V分析。图5表明:在保留时间5 min至7.5 min之间,Triton X-114出现特征峰,峰值大小随着浓度的降低而减小。读取特征峰峰面积数据,绘制标准曲线,得到线性回归方程y=3 208.7x+1 778.5(R2=0.9981)。取三步法去除内毒素处理后的SOD蛋白溶液终产品,经过反相高效液相色谱法分析可知Triton X-114仅为5.7 μg/mL。同时经过离体细胞培养试验考察急性细胞毒性,结果显示细胞存活率为100%,确认经过三步法去除内毒素处理后的SOD蛋白溶液终产品对细胞未显示任何毒性。
3 讨论
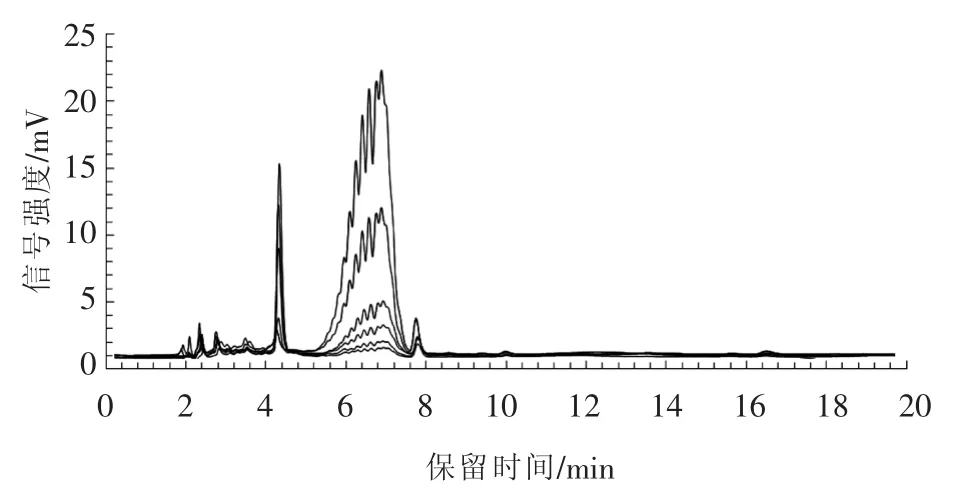
图5 不同浓度Triton X-114的HPLC色谱图Fig.5 HPLC chromatograms of Triton X-114 with different concentrations
随着基因工程技术的发展,越来越多的生物活性蛋白通过微生物进行表达和大量制备。这些重组蛋白最终将被广泛应用于体内注射药物和口服营养保健品,相关产品的质量标准中最关键的一项指标就是内毒素含量不可检出或处于低检测值。然而,以微生物作为蛋白质表达载体的工艺以及在非真空条件下的生产环境,往往不可避免的会有细菌内毒素污染。常见的微生物表达体系如大肠杆菌和毕赤酵母,重组蛋白在大肠杆菌的胞内进行表达,在破碎细菌获得重组蛋白的同时,细胞壁内的内毒素也随之大量释放到蛋白质溶液中[27];在毕赤酵母表达系统中,重组蛋白被毕赤酵母主动分泌到胞外,不存在细菌破壁导致大量内毒素污染问题,但是有研究表明某些真菌多糖也会对鲎法检测和兔试法具有类似的生理效应[28];另外生产环境以及分离纯化操作过程等因素也会造成蛋白质溶液内毒素的污染[21]。因此如何有效去除重组蛋白溶液中的内毒素是所有重组蛋白相关产品生产过程中必须重点关注的环节。
去除蛋白溶液中内毒素始终是一个非常棘手的技术问题[19]。由于各种基因重组蛋白的性质各有不同,找到一种适用于所有重组蛋白溶液的通用方法是不可能的。常见的内毒素去除方法有超滤、活性炭吸附、两相萃取法、色谱分离法等方法,然而每种方法都有其相应的缺陷。例如纯化效果最好当属亲和色谱法,但因该方法使用柱填料十分昂贵,不适用于大批量样品的处理[29]。Triton X-114萃取法能非常高效的去除重组蛋白溶液中的内毒素,但是Triton X-114作为一种非离子表面活性剂对细胞有着一定的损害,因此无法大量使用[30]。活性炭吸附法的优点在于大批量操作成本低,且活性炭可反复使用。因此在实际蛋白质纯化过程中,往往需要以上各种分离方法相互配合、取长补短。
国家药典2015版[25]规定,人体用注射针剂的每公斤体重每小时的最大可接受细菌内毒素剂量为 5 EU/(kg·h)。Richard和Frank 研究结果显示,牛Cu,Zn-SOD的人体耐受量为32 mg/d,大约181 120 U/d[26]。通过换算,人用SOD注射针剂里,10 000 U酶活中所含有的细菌内毒素不应该超过50 EU。本试验中使用的重组人源Cu,Zn-SOD是一种水溶性非常好的蛋白质,非常适合活性炭吸附法和Triton X-114相分离法。使用活性炭吸附法,pH为5.0的蛋白溶液中添加5%(W/V)的活性炭,4℃低温吸附2 h,活性炭吸附能力达到饱和,内毒素去除率达到75%,SOD酶活力回收率为81.4%。随后使用TritonX-114萃取法,添加1%(V/V)的 Triton X-114,反复处理 3次,内毒素去除率可达99.5%,酶活回收率为79.6%。通过三步法工艺去除内毒素,蛋白溶液终产品中内毒素含量降低至28.6 EU/10 000 U酶活,低于 《中国药典》(2005版)对注射药品内毒素限值50 EU/10 000 U酶活的质量要求。由此可以明确,三步法纯化重组SOD蛋白溶液的终产品完全符合药典规定的注射用蛋白质针剂内毒素限量的质量要求。
自从1990年Aida首次采用Triton X-114萃取法去除重组蛋白溶液中内毒素,该方法已经广泛应用于各种重组蛋白质溶液的内毒素去除工艺[31],其纯化效果取得了普遍的认可[27,30]。然而很少有研究者对溶液中Trition X-114的残余及去除问题进行探讨。Triton X-114是一种聚乙二醇单辛基酚醚表面活性剂,能够通过液相分离的方法萃取去除水相溶液中的细菌内毒素。但是它作为一种非离子表面活性剂对细胞有着一定程度的损害,如果蛋白溶液中尚有Triton X-114残留,必然会影响重组目标蛋白在临床前的安全性和功效性的评估。因此本研究中,最后一道工艺选择使用活性炭吸附法,在进一步去除细菌内毒素的同时,也将吸附去除残余的Triton X-114,确保重组蛋白质样品的安全可靠。《中国药典》(2005)版[25]中对Triton X-100的残留量要求为:半成品中不得大于 15 μg/mL,人用剂量可控制在7.5 μg/mL 以内。本试验采用高效液相色谱法测定三步法纯化去除内毒素过程终产品中的Triton X-114残余量,结果显示Triton X-114残余量为5.7 μg/mL,低于《中国药典》中对Triton残留量的质量要求;同时经过离体细胞培养试验考察急性细胞毒性,SOD蛋白溶液终产品对细胞未显示任何毒性作用。由此可以明确,三步法纯化重组SOD蛋白溶液的终产品完全符合药典规定的注射用蛋白质针剂Triton残余量的质量要求。
综上所述,本研究采用的活性炭吸附与Triton X-114相分离法相结合,去除重组酵母表达人Cu,Zn-SOD蛋白溶液中内毒素,该纯化工艺操作简易、周期短、适合大批量生产,操作成本低,重组蛋白回收率较高,终产品完全符合药典规定的注射用蛋白质针剂中内毒素限量和Triton残余量的质量要求,完全可以应用于潜在的保健食品开发。本研究的工艺设计和分离纯化结果,可为其它重组蛋白去除内毒素的工艺设计提供参考。
