7种海参提取物酶法制备及其抗氧化活性研究
2019-10-12赵谋明孙为正赵强忠林恋竹
杨 坤 赵谋明 孙为正 赵强忠 林恋竹
(华南理工大学食品科学与工程学院 广州 510640)
海参属棘皮动物门、海参纲[1],是海洋中最常见的无脊椎动物。据报道,全世界已发现的海参大约有1 100种,其中40种可供食用;我国总计约有100种,其中约20种可供食用[2]。新鲜海参体内含有活性很强的自溶酶[3],在受到外界物理因素、化学因素和生理因素等刺激后,原本正常的生命活动出现紊乱,会发生吐肠和体壁软化的现象[4],在捕获后需快速进行干制处理。市场上流通量最大的海参制品为干制海参,约占到市场上海参制品量的90%[5]。
海参具有高蛋白、低脂肪的特点[6]。海参中丰富的蛋白、多糖和皂甙,是其发挥抗衰老、抗肿瘤、提高机体免疫力和降血脂等多种生理功效的主要活性物质[7]。其中,胶原蛋白是海参中含量最多的活性物质,占海参蛋白的70%以上[8]。中国产刺参胶原蛋白中甘氨酸和羟脯氨酸含量较多,酪氨酸、苯丙氨酸和组氨酸含量较低,与人Ⅰ型胶原蛋白的氨基酸组成相近,生物利用度较高[9-12]。海参多糖是海参体壁中含量仅次于蛋白质的另一重要成分,其分为两种:一种为硫酸软骨素,为分支杂多糖,另一种是岩藻聚糖,为直链多糖。二者均有较高含量的硫酸酯质,约占其总质量的30%[13-16]。
本文在前人研究的基础上,以小北极海参、大北极海参、叶瓜参、花刺参、土耳其长崎参、大连大乌参、澳洲参为研究对象,采用3种蛋白酶——复合蛋白酶、风味蛋白酶、木瓜蛋白酶分别水解4,8,12 h,制备得到海参提取物,采用还原力、羟自由基清除能力、氧自由基吸收能力评价法对比研究其抗氧化活性,为以海参提取物为核心配料的功能性食品的加工提供理论支持。
1 材料与方法
1.1 原料
小北极海参、大北极海参、叶瓜参、花刺参、土耳其参、大连大乌参、澳洲参,采购自广州市一德路干货批发市场,置于阴凉干燥处备用。
1.2 试剂
复合蛋白酶(酶活为46 000 U/g),风味蛋白酶(酶活为40 000 U/g),购于丹麦诺维信公司;木瓜蛋白酶(酶活为56 000 U/g),购于广州裕立宝生物科技公司;AAPH,荧光素,trolox,纯度为 99%,购于美国Sigma公司;其它试剂均为分析纯,购于广州化学试剂厂;去离子水,实验室自制。
1.3 设备
绞肉机(MM12),广东省韶关市食品机械厂;pH计(PHS-2F),上海仪电科学仪器股份有限公司;阿贝折光仪(E-line),香港德祥科技有限公司;电热恒温水浴锅(HH-S1),金坛华特实验仪器有限公司;分析天平(AL204),梅特勒-托利多仪器(上海)有限公司;烘箱(101-3A),上海浦东荣丰科学仪器有限公司;酶标仪(Varioskan Flash),美国Thermo公司;紫外分光光度计(UV-721),上海精密科学仪器仪表有限公司;恒温振荡器(THZ-82A),常州澳华仪器有限公司;离心机(ST-16R),美国Thermo公司;自动定氮仪(KND-103F),上海纤检仪器有限公司。
1.4 试验方法
1.4.1 海参提取物酶法制备工艺研究 分别取干海参各 200 g,按料液比 1∶20(m/m)加入去离子水,15℃泡发48 h,冷水漂洗2次,沥干多余的水分,称重后,计算泡发增重倍数,然后使用绞肉机绞碎海参,成肉糜状,分别取海参肉糜各15 g,按料液比为1∶2(m/m)加入去离子水,分别加入肉糜质量0.1%的酶(复合蛋白酶、风味蛋白酶、木瓜蛋白酶),分别于55℃酶解4,8和12 h,95℃加热15 min,4 000 g离心 20 min,取上清液,得海参提取物。考察海参种类、酶的种类、酶解时间对海参提取物得率、蛋白回收率以及抗氧化活性的影响。
1.4.2 泡发增重倍数测定 取m1质量的干海参进行泡发,泡发完成后沥干水分计重,质量为m2。

1.4.3 海参提取物得率的测定 取m3质量的海参肉糜进行酶解,海参提取物计重m4,使用阿贝折光仪测定提取物中固形物含量(b)。

1.4.4 蛋白回收率的测定[17]采用凯氏定氮法(GB/T5009.5-2003)测定提取物中总氮量。
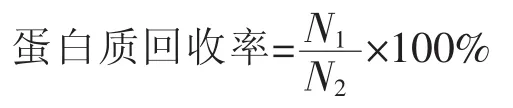
式中:N1——海参提取物总氮量,g;N2——原料总氮量,g。
1.4.5 海参提取物的还原力评价[18]取2 mL样品,依次加入2 mL磷酸盐缓冲液(0.2 mol/L,pH 6.6)和2 mL 1%(w/v)的铁氰化钾溶液,混匀,50℃保温 20 min后,加入 2 mL 10%(w/v)的 TCA,混匀,4 000 g离心 10 min,取上清液 2 mL,依次加入2 mL蒸馏水以及 0.4 mL 0.1%(w/v)氯化铁溶液,混匀,室温反应10 min后,测定其在700 nm 处的吸光度值。将trolox作为标准品,trolox浓度与其吸光度值呈线性关系,换算得到样品的还原力值,即达到每克干海参的还原力所需trolox的量(μmol trolox当量/g干海参),还原力值越大,样品的还原力越强。
1.4.6 海参提取物的羟基自由基清除能力评价[19-20]羟基自由基(OH)清除力的测定选用邻二氮菲法。样品管:取0.6 mL样品溶液,加入0.4 mL磷酸盐缓冲液(0.2 mol/L,pH 7.4),混匀,依次加入0.6 mL邻二氮菲溶液(5 mmol/L)及0.6 mL EDTA(15 mmol/L),混匀后,加入 0.6 mL FeSO4溶液(5 mmol/L),充分混匀后加入0.8 mL 0.1%(V/V)H2O2。摇匀后于37℃保温1 h,测定其在536 nm 处吸光值 A536(样品);损伤管:以去离子水代替样品,其余步骤同样品管,所测吸光值为 A536(损伤);未损伤管:以去离子水代替H2O2,其余步骤同损伤管,所测吸光值为 A536(未损伤)。

将trolox作为标准品,trolox浓度与其OH清除率呈线性关系,换算得到样品的OH值,即达到每克干海参的OH清除能力所需Torlox的量(μmol trolox当量/g干海参),OH值越大,样品的OH清除能力越强。
1.4.7 海参提取物的氧自由基吸收能力(ORAC)评价[21]在96孔荧光板各微孔中分别加入20 μL待测样品或磷酸盐缓冲液(75mmol/L,pH7.4),添加70 nmol/L荧光素120 μL,在37℃下保温 15 min后,用多道移液器迅速在各孔中加入60 μL 12 mmol/L AAPH启动反应,并将微孔板置于酶标仪中,保持反应体系温度恒定为37℃,设定激发波长485 nm,发射波长520 nm,开始计时反应并读数(f0),每 1 min测定 1次,共读 121次数(共计反应120 min),将每次读数连成曲线。Q表示曲线下的面积。
Q=0.5(f0+fn)+(f1+f2+…+fi+…+fn-1)
L=Q样品-Q空白
将trolox作为标准品,trolox浓度与其L呈线性关系,换算得到样品的ORAC值,即达到每克干海参的氧自由基吸收能力所需Torlox的量(μmol trolox当量/g干海参)。
1.4.8 数据分析 采用SPSS 17.0软件中的ANOVA方法对数据进行差异显著性检验分析,以P<0.05为差异显著,数据以平均值±标准差(x±s)的形式来表示。聚类分析采用SPSS 17.0软件中的系统聚类的方法。
2 结果与讨论
2.1 7种海参蛋白含量及泡发增重倍数
7种海参蛋白含量及泡发增重倍数如表1所示。
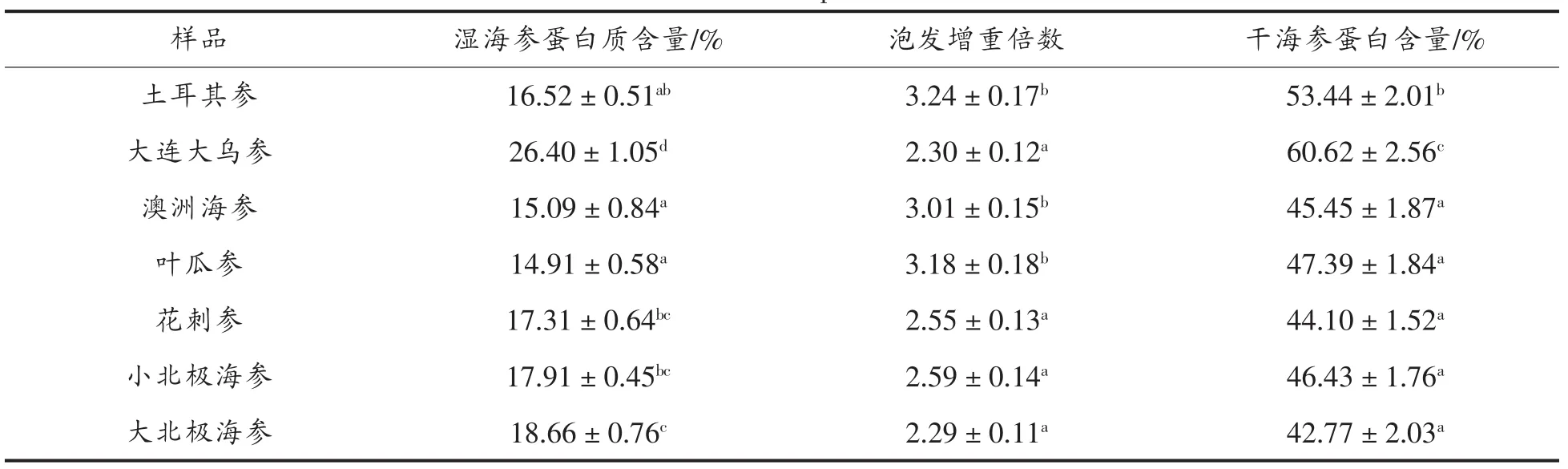
表1 7种海参蛋白含量及泡发增重倍数Table 1 Protein contents and soaked mulriples of seven kinds of sea cucumbers
试验结果表明:7种干海参经冷水泡发后,土耳其参增重倍数最高(3.24)。大连大乌参蛋白含量最高,达到60.62%。海参中最重要且含量最高的营养成分是蛋白质,由于干海参制作时会添加大量的盐,致使干海参中蛋白含量有所降低。不同等级、种类海参在盐干时,加入的盐含量不同,因此,不同干海参蛋白含量差异较大。
2.2 不同酶、酶解时间对7种海参提取物得率、蛋白回收率的影响
2.2.1 不同酶、酶解时间对7种海参提取物得率的影响 不同酶、酶解时间对7种海参提取物得率的影响如图1所示。
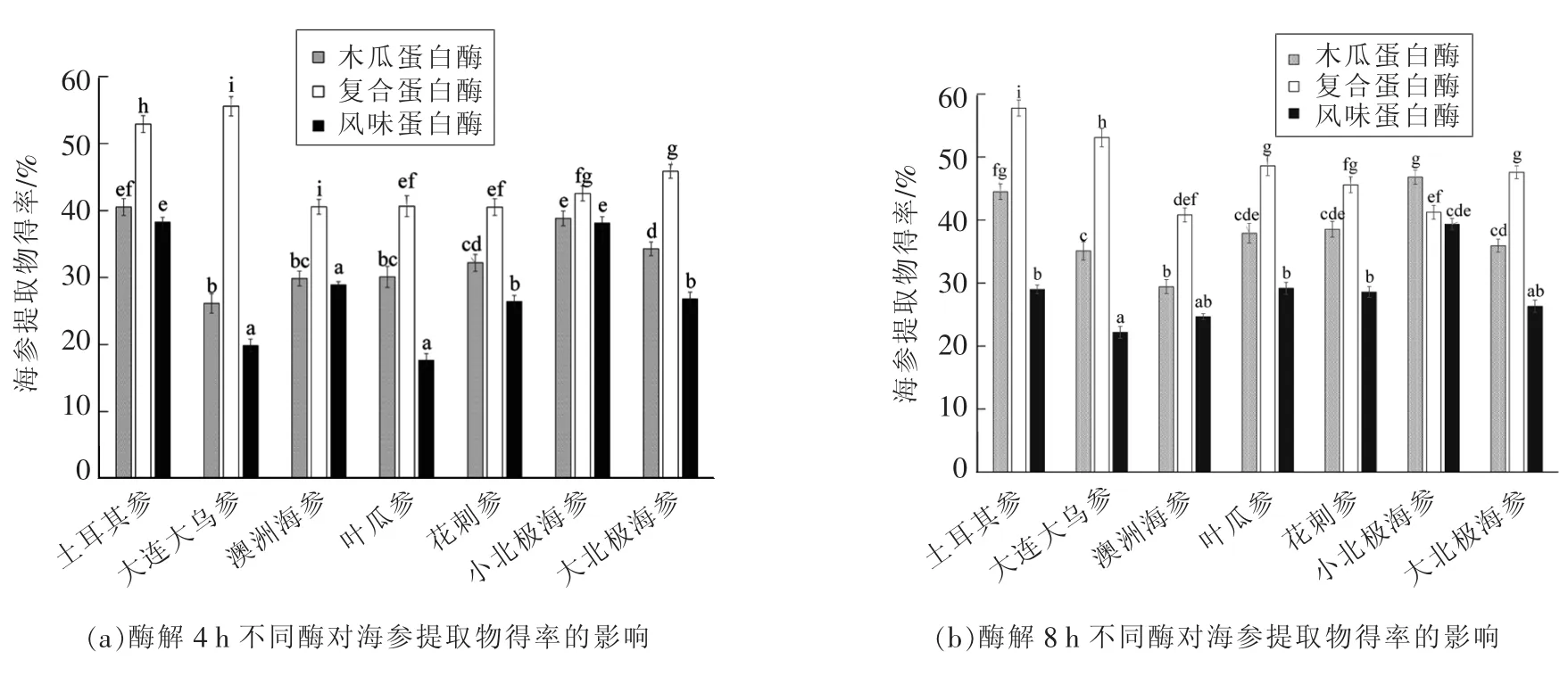
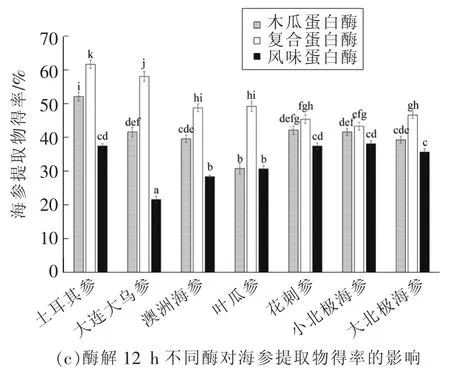
图1 酶解4,8,12 h不同酶对海参提取物得率的影响Fig.1 Effect of different enzymes on the sea cucumber extract yields in enzymolysis for 4,8,12 h
试验结果表明:3种酶酶解海参4 h时,7种海参提取物得率为17.68%~55.57%。采用复合蛋白酶酶解大连大乌参,其提取物得率最高,达到55.57%。对于7种海参,以土耳其参、小北极海参提取物得率较高,分别为38.3%~52.9%和38.17%~42.53%。对于3种蛋白酶,采用复合蛋白酶酶解7种海参,所得海参提取物得率最高。此外,采用木瓜蛋白酶酶解大连大乌参、叶瓜参、花刺参和大北极海参时,所得海参提取物得率显著高于采用风味蛋白酶酶解这4种海参所得海参提取物得率(P<0.05)。然而,采用木瓜蛋白酶酶解土耳其参、澳洲海参和小北极海参时,所得海参提取物得率与采用风味蛋白酶酶解这3种海参所得海参提取物得率没有显著性差异(P>0.05)。当采用3种酶酶解海参8 h时,7种海参提取物得率为22.17%~57.76%,相对于酶解4 h时海参提取物得率有一定程度的提高,但提高幅度不大。3种酶酶解海参12 h时,7种海参提取物得率介于21.57%~61.64%之间,相对于酶解4,8 h时海参提取物得率有一定程度的提高。
2.2.2不同酶、酶解时间对7种海参蛋白回收率的影响 蛋白质是海参中含量最高的营养成分。因此,蛋白肽是海参提取物中最主要的成分,对海参提取物的活性有重要的贡献。不同酶、酶解时间对7种海参蛋白回收率的影响如图2所示。
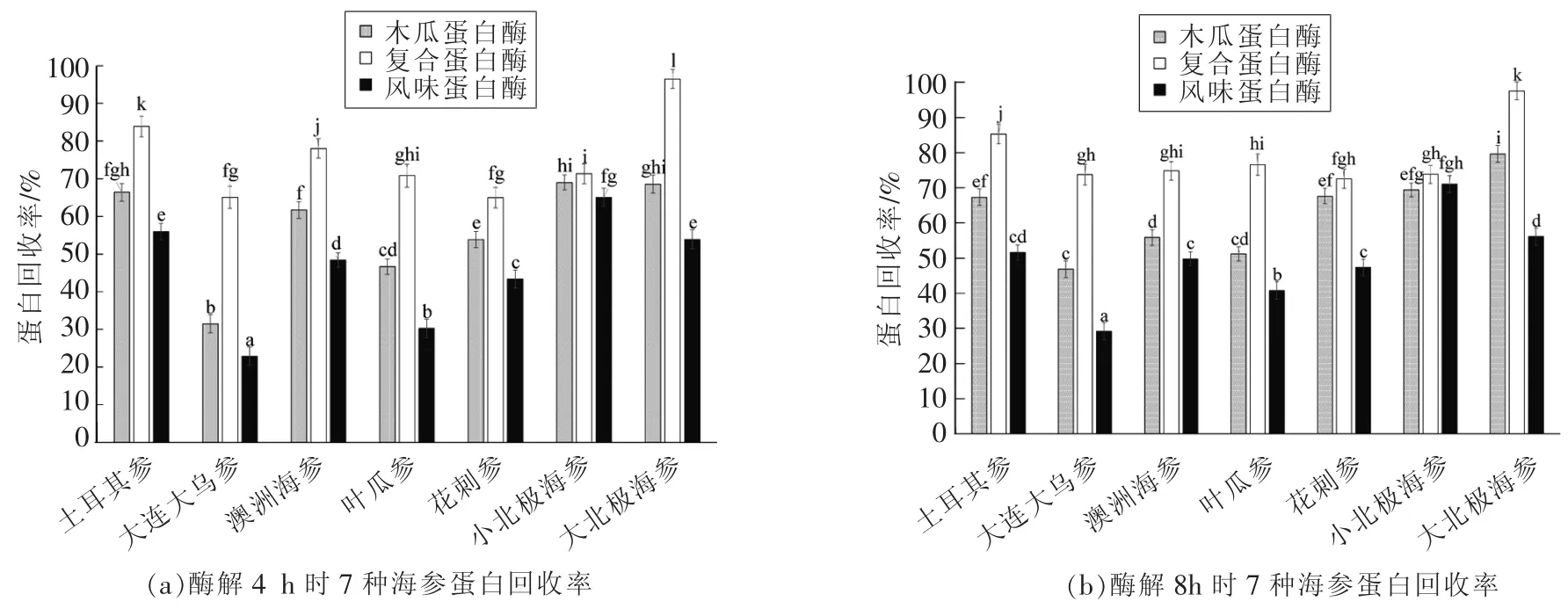

图2 酶解4,8,12 h时7种海参蛋白回收率Fig.2 Protein recovery rates of 7 kinds of sea cucumbers in enzymolysis for 4,8,12 h
试验结果表明:当采用木瓜蛋白酶、复合蛋白酶以及风味蛋白酶酶解不同海参4 h时,7种海参的蛋白回收率为22.89%~96.48%。其中,采用复合蛋白酶酶解大北极海参时,蛋白回收率最高,达到96.48%。对于3种蛋白酶,采用复合蛋白酶酶解7种海参时,蛋白回收率最高,木瓜蛋白酶次之,而采用风味蛋白酶酶解7种海参时,蛋白回收率最低。
当酶解时间延长至8 h时,7种海参的蛋白回收率为29.18%~97.56%。采用复合蛋白酶酶解7种海参时,蛋白回收率最高,其中以大北极海参酶解产物蛋白回收率为最高,木瓜蛋白酶次之,风味蛋白酶最低。采用3种不同酶酶解小北极海参时,蛋白回收率没有显著性差异(P>0.05)。
当酶解时间延长至12 h时,7种海参的蛋白回收率为28.56%~98.40%。采用复合蛋白酶酶解大北极海参时,蛋白回收率最高。3种蛋白酶酶解效率从高到低依次是:复合蛋白酶>木瓜蛋白酶>风味蛋白酶。采用3种不同酶酶解小北极海参时,蛋白回收率没有显著性差异(P>0.05)。
2.2.3 7种海参提取物得率、蛋白回收率聚类分析 以海参提取物得率和蛋白回收率为指标,对不同酶解条件下所制得的63种海参提取物进行了聚类分析,一共分为5类,结果表明:(1)土耳其海参、大连大乌参、澳洲海参、叶瓜参和大北极海参提取物得率及蛋白回收率高,较易酶解;(2)使用复合蛋白酶所制备的海参提取物得率和蛋白回收率最高,其次是木瓜蛋白酶,最次是风味蛋白酶;(3)使用复合蛋白酶酶解澳洲海参和叶瓜参时,增加酶解时间有利于蛋白肽的提取。对于土耳其海参、大连大乌参和大北极海参,使用复合蛋白酶酶解时,增加酶解时间不会显著提高其提取物得率与蛋白回收率;(4)对于土耳其参、大连大乌参、澳洲海参和花刺参,使用木瓜蛋白酶进行酶解时,增加酶解时间有利于蛋白肽的提取。而对于叶瓜参、小北极海参和大北极海参,增加酶解时间不会显著提高其提取物得率和蛋白回收率;(5)对于叶瓜参和大北极海参,增加酶解时间有利于蛋白肽的提取。而对于土耳其参、大连大乌参、澳洲海参、花刺参和小北极海参,使用风味蛋白酶进行酶解,延长酶解时间不会显著提高其提取物得率和蛋白回收率。
2.3 不同酶、酶解时间对7种海参提取物抗氧化活性的影响
2.3.1 不同酶、酶解时间对7种海参提取物还原力的影响 7种海参的还原力值如图3所示。不同海参经3种蛋白酶解,所得提取物的还原力值具有显著性差异(P<0.05)。总的说来,土耳其参、大连大乌参和澳洲海参提取物的还原力值相对较高,其余种海参提取物还原力值较低。

图3 酶解4,8,12 h时7种海参提取物的还原力值Fig.3 Reducing power values of 7 kinds of sea cucumbers in enzymolysis for 4,8,12 h
具体说来,当采用木瓜蛋白酶、复合蛋白酶以及风味蛋白酶酶解不同海参4 h时,7种海参提取物的还原力值为3.34~13.86 μmol trolox当量/g干海参,其中,风味蛋白酶酶解澳洲海参所得提取物的还原力值最高,达到13.86 μmol trolox当量/g干海参。当酶解时间延长至8 h时,7种海参提取物的还原力值为2.91~13.47 μmol trolox当量/g干海参,其中,风味蛋白酶酶解土耳其海参所得提取物的还原力值最高,达到13.47 μmol trolox当量/g干海参。当酶解时间延长至12 h时,7种海参提取物的还原力值为4.21~15.98 μmol trolox当量/g干海参,其中,风味蛋白酶酶解澳洲海参所得提取物的还原力值最高,达到15.98 μmol trolox当量/g干海参。
2.3.2 不同酶、酶解时间对7种海参提取物羟自由基清除能力的影响 7种海参提取物的OH值如图4所示。不同海参经3种蛋白酶解,所得提取物的OH值具有显著性差异(P<0.05)。总体来说,叶瓜参提取物的OH值最高,明显高于其他6种海参提取物。土耳其参、大连大乌参和澳洲海参提取物的OH值相对较低。
具体来说:采用3种酶酶解4 h时,7种海参提取物的OH值为17.39~99.06 μmol trolox当量/g干海参,其中,木瓜蛋白酶酶解叶瓜参所得提取物OH值最高,达到99.06 μmol trolox当量/g干海参。当酶解时间延长至8 h时,7种海参提取物的OH值为25.42~128.8 μmol trolox当量/g干海参,其中,风味蛋白酶酶解叶瓜参所得提取物OH值最高,达到128.8 μmol trolox当量/g干海参。当酶解时间延长至12 h时,OH值变化范围为27.29~148.43 μmol trolox 当量/g 干海参,其中,风味蛋白酶酶解叶瓜参所得提取物OH值最高,达到148.43 μmol trolox当量/g干海参。结果显示,延长酶解时间有利于海参提取物羟自由基清除能力的提高。
2.3.3 不同酶、酶解时间对7种海参提取物氧自由基吸收能力的影响
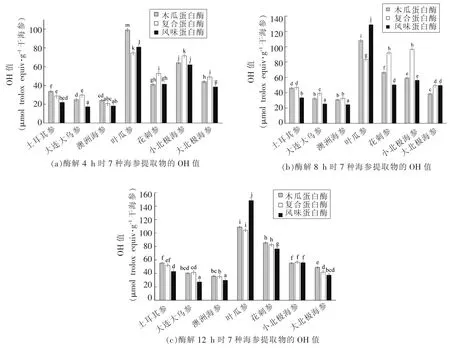
图4 酶解4,8,12 h时7种海参提取物的OH值Fig.4 OH values of seven kinds of sea cucumbers in enzymolysis for 4,8,12 h
7种海参提取物的ORAC值如图5所示。不同海参经3种蛋白酶解,所得提取物的ORAC值具有显著性差异(P<0.05)。与其它海参提取物相比,花刺参提取物的ORAC值较低。采用复合蛋白酶所制备的海参提取物的氧自由基吸收能力最强,其次是木瓜蛋白酶,再次是风味蛋白酶。


图5 酶解4,8,12 h时7种海参提取物的ORAC值Fig.5 ORAC values of 7 kinds of sea cucumbers in enzymolysis for 4,8,12 h
结果显示:当采用木瓜蛋白酶、复合蛋白酶以及风味蛋白酶酶解不同海参4 h时,7种海参提取物的 ORAC值为 15.4~99.93 μmol trolox当量/g干海参,其中复合蛋白酶酶解土耳其参所得提取物ORAC值最高,达到99.93 μmol Trolox当量/g干海参。当酶解时间延长至8 h时,7种海参提取物的ORAC值为24.2~133.08 μmol trolox当量/g干海参,相对于酶解4 h所得海参提取物的ORAC值有显著提高(P<0.05),其中,复合蛋白酶酶解叶瓜参所得提取物ORAC值最高,达到133.08 μmol trolox当量/g干海参。当酶解时间延长至12 h时,7种海参提取物的ORAC值为19.99~110.2 μmol trolox当量/g干海参,相对于酶解8 h所得海参提取物的ORAC值有显著降低(P<0.05),其中,复合蛋白酶酶解土耳其参所得提取物ORAC值最高,达到110.2 μmol trolox当量/g干海参。因此,适当延长酶解时间有利于海参提取物氧自由基吸收能力的提高,但酶解时间过长,会降低海参提取物氧自由基吸收能力。
2.3.4 7种海参提取物抗氧化活性聚类分析 以还原力值、ORAC值、OH值为指标,对不同酶解条件下所制得的63种海参提取物进行了聚类分析,可以分为7类。结果显示:(1)叶瓜参提取物的抗氧化能力最强,小北极海参提取物次之,其余海参较差;(2)使用复合蛋白酶所制备的海参提取物抗氧化活性最高,其次是木瓜蛋白酶,最次是风味蛋白酶;(3)随着酶解时间的延长,叶瓜参、花刺参、大/小北极海参提取物的抗氧化活性均有所提高;而土耳其海参、大连大乌参和澳洲海参提取物的抗氧化活性随酶解时间延长变化不大。
3 结论
本文以7种常见的低值可食用海参为研究对象,采用3种蛋白酶:复合蛋白酶、风味蛋白酶、木瓜蛋白酶,分别水解4,8,12 h,制备得到海参提取物,评价其抗氧化活性,结果表明:
(1)使用复合蛋白酶所制备的海参提取物得率、蛋白回收率最高,其次是木瓜蛋白酶,最次是风味蛋白酶;7种海参提取物得率为41.24%~55.57%,蛋白回收率为65.06%~98.4%。
(2)使用复合蛋白酶所制备的海参提取物抗氧化活性最强,其次是木瓜蛋白酶,最次是风味蛋白酶;7种海参提取物还原力值为3.41~8.34 μmol trolox当量/g干海参,OH值为 28.83~96.65 μmol trolox当量/g干海参,ORAC值为 38.99~133.08 μmol trolox当量/g干海参;叶瓜参提取物的抗氧化活性最强,小北极海参提取物次之,其余海参提取物较差。
(3)土耳其海参、大连大乌参、澳洲海参、叶瓜参和大北极海参提取物得率及蛋白回收率高,较易酶解;叶瓜参提取物的抗氧化活性最强,可作为具有强抗氧化活性的食品配料应用于功能性食品。
