细胞周期调节蛋白1在胰腺癌中的表达及临床意义
2019-10-12杜秋国张日新叶啸朱岭
杜秋国,张日新,叶啸,朱岭
(华中科技大学同济医学院附属武汉中心医院后湖院区 肝胆胰外科,湖北 武汉,430014)
胰腺癌是致死性极高的恶性肿瘤,90%的胰腺癌起源于胰腺导管上皮,其1年和5年生存率分别为26%和8%,胰腺癌在确诊时大部分已发展为中晚期[1-3],预后较差。细胞周期调节蛋白1(speedy/RINGO cell cycle regulator family member A,Spy1)是Speedy/Ringo 细胞周期调控蛋白家族成员之一,通过激活周期蛋白激(cyclin-dependent kinases,CDKs)控制细胞增殖[4-5]。Spy1的表达能够在细胞周期G1晚期和整个S期中特异性结合并激活周期素依赖性激酶2(cyclin-dependent kinase 2,CDK2),促进CDK抑制因子p27降解从而促进细胞增殖[6]。Spy1的功能在多种肿瘤中已有报道,在乳腺癌中,Spy1蛋白高表达,敲低Spy1表达可抑制乳腺癌细胞增殖[7]。Spy1在肝细胞癌中表达水平高于对应的癌旁组织,Spy1高表达的肝细胞癌患者预后差[8]。Spy1在结肠癌组织中高表达,且其表达水平与结肠癌患者临床病理因素显著相关[9],然而Spy1在胰腺癌组织中的表达鲜见报道。本文旨在探讨Spy1在胰腺癌组织中的表达,探讨其表达水平与患者临床病理参数及预后的关系。
1 材料与方法
1.1 组织标本收集
收集2012年12月—2014年12月在华中科技大学同济医学院附属武汉中心医院肝胆胰脾外科接受胰腺癌切除术的患者,共85例,其中胰体尾切除术有35例,胰十二指肠切除术有50例。病理类型分布:鳞癌5例,胰腺导管腺癌60例,黏液癌20例。TNM分期中I+II期66例,III期18例,IV期1例。纳入标准:⑴ 经手术或病理诊断确诊为胰腺癌的患者;⑵ 临床检验及随访资料完整;⑶ 胰腺癌的治疗遵循NCCN指南[10]。剔除标准:⑴ 临床或随访资料不全者;⑵ 患者存在其他部位肿瘤者。组织标本经手术切除后分别做成石蜡标本和-80 ℃冰箱冷冻保存备用。本研究经医院伦理委员会批准同意并实施。
1.2 病历收集及随访
收集患者年龄、性别、肿瘤大小、TNM分期(美国癌症协会第七版)[11]、肿瘤分化程度等资料。采用门诊或电话随访,每3个月随访1次,行腹部彩超或CT及肿瘤标志物检查,随访内容包括患者复发及死亡情况。无瘤生存时间定义为从术后到肿瘤复发或随访截止时间,总生存时间定义为从术后到患者死亡或随访截止时间。随访截止至2018年12月,最长随访时间6年,共2例失访。
1.3 实验试剂
Spy1兔抗人多克隆抗体购自美国BD公司,羊抗鼠或羊抗兔二抗购自美国Invitrogen公司,两步法免疫组化试剂盒购自美国Invitrogen公司。
1.4 免疫组化和免疫组化评分
石蜡标本经切片制作4 μ m 石蜡切片,切片于65 ℃烘片2 h,经二甲苯和梯度酒精常规脱蜡至水。3%双氧水室温灭活内源性过氧化物酶10 min。抗原修复方法采用柠檬酸钠缓冲液微波加热至沸腾5 min,自然冷却后清洗3遍。3%牛血清蛋白封闭20 min后甩去多余液体,滴加Spy1抗体稀释液(1:200)4 ℃孵育过夜,清洗3次。加入二抗(1:500),并于37 ℃下孵育2 h,显色剂显色,出现棕黄色时终止反应,并用苏木素染核。计分规则如下:p为阳性细胞百分比。0分,阳性细胞<5%;1分,阳性细胞5%~35%;2分,阳性细胞36%~65%;3分,阳性细胞>66%。i为染色深浅,0分为不显色;1分代表浅黄色;2分代表棕黄色;3分代表深褐色。对胰腺癌组织进行评分,总分计算依据∑pi,其中总分≥5分,为高表达组,共55例;总分<5分,为低表达组,共30例。
1.5 统计学处理
采用SPSS20.0(USA,Chicago)统计软件。服从正态分布的计量资料以平均值±标准差表示,组间比较采用独立样本t 检验,不服从正态分布的计量资料以中位数和四分位间距表示,组间比较采用秩和检验,计数资料以病例数或率表示,组间比较采用χ2检验或Fisher确切概率法,Kaplan-Meier和Log-rank用于分析和比较无瘤生存率和总生存率差异,Cox风险比例模型用于单因素和多因素分析,P<0.05为差异有统计学意义。
2 结 果
2.1 Spy1 在胰腺癌组织中的表达
免疫组化示:胰腺癌组织中Spy1主要表达于细胞核,部分在细胞浆中(图1),在85例患者中,Spy1高表达者有55例(64.7%),Spy1低表达者有30例(35.3%)。
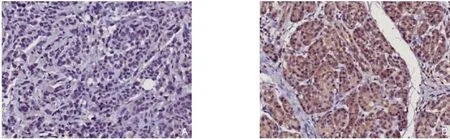
图1 免疫组化检测胰腺癌组织中Spy1 蛋白表达(×200) Figure 1 Immunohistochemichal staining for Spy1 expression in pancreatic cancer tissues (×200)
2.2 Spy1 表达与胰腺癌临床病理特征 的关系
Spy1蛋白表达与年龄、性别、淋巴结转移、血管浸润、肿瘤部位和病理类型无明显关系(均P>0.05),而与肿瘤大小、TNM分期和分化程度明显相关(均P<0.05)(表1)。
2.3 Spy1 表达与胰腺癌患者预后的关系
Spy1高表达组1年无瘤生存率为49.3%,Spy1低表达组为72.8%,Spy1高表达组1年无瘤生存率低于Spy1低表达组(P<0.01);Spy1高表达组3年无瘤生存率21.6%,Spy1低表达组3年无瘤生存率为49.4%,Spy1高表达组3年无瘤生存率低于Spy1低表达组(P<0.01)。Spy1高表达组1年总生存率为59.6%,Spy1低表达组为82.3%,Spy1高表达组1年总生存率低于Spy1低表达组(P<0.01);Spy1高表达组3年总生存率为25.6%,Spy1低表达组为57.1%,Spy1高表达组3年总生存率低于Spy1低表达组(P<0.01)(图2)。
2.4 影响胰腺癌患者无瘤生存率的危险因素分析
单因素分析示Spy1高表达(P=0.018)及淋巴结转移(P=0.001)为影响胰腺癌患者无瘤生存的危险因素;多因素分析示Spy1高表达(P=0.023)及淋巴结转移(P=0.005)为影响无瘤生存率的独立危险因素(表2)。
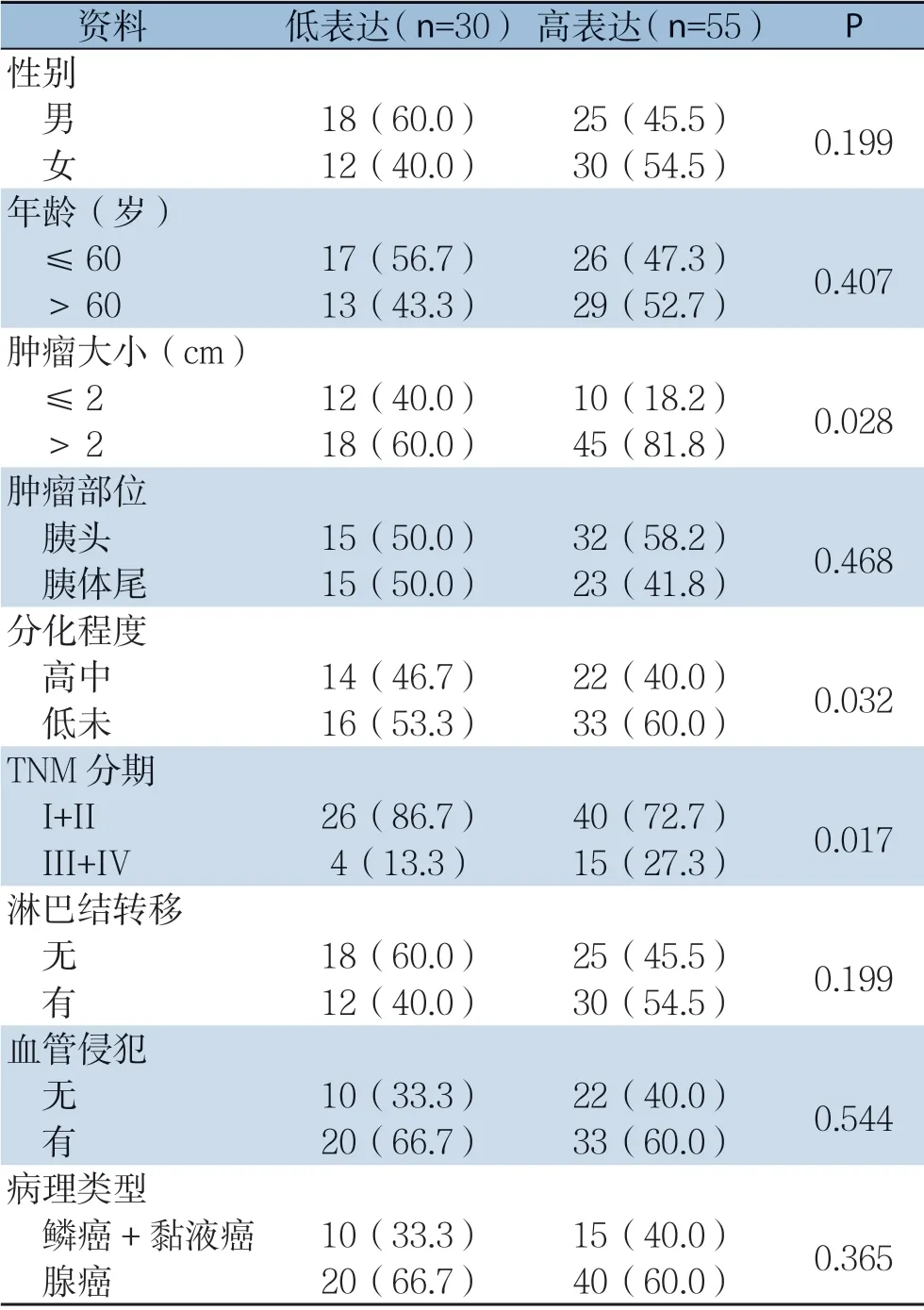
表1 Spy1 表达与临床病理特征的关系[n(%)]Table 1 The relations of Spy1 expression with the clinicopathologic characteristics [n (%)]
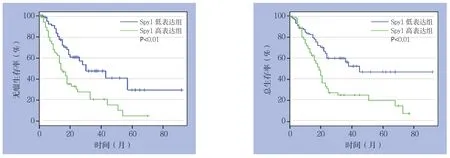
图2 不同Spy1 表达水平胰腺癌患者的生存曲线Figure 2 The survival curves of pancreatic cancer patients with different Spy1 expression levels
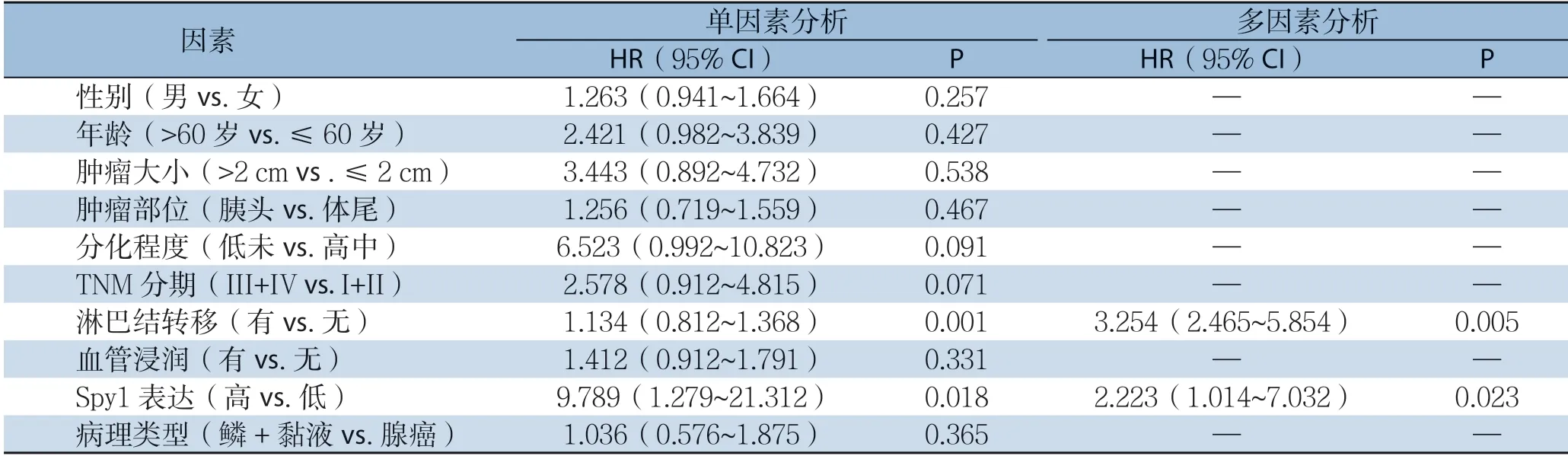
表2 影响胰腺癌患者无瘤生存率的单因素和多因素分析Table 2 Univariate and multivariate analysis of the risk factors for disease-free survival rates in pancreatic cancer patients
2.5 影响胰腺癌患者总生存率的危险因素分析
单因素分析示分化程度(P=0.031)、TNM分期(P=0.041)及Spy1表达(P=0.018)为影响患者总生存的危险因素;多因素分析示Spy1高表达(P=0.035)及TNM分期(P=0.037)为影响胰腺癌患者总生存的独立危险因素(表3)。

表3 影响胰腺癌患者总生存率的单因素和多因素分析Table 3 Univariate and multivariate analysis of the risk factors for overall survival rates in pancreatic cancer patients
3 讨 论
由于胰腺癌具有高侵袭性和转移早的特点,预计2030年胰腺癌将成为第二大致死性肿瘤[12]。大约有20%的胰腺癌患者在诊断时为可手术切除的局部肿瘤,有15%~20%的患者确诊时为不可手术的局部晚期肿瘤[13-14]。胰腺癌的发生不受年龄和性别影响,其5年生存率仅8%[15-16]。尽管目前有多种手段治疗胰腺癌,但其中位生存期仅6~12个月[17]。寻找和鉴定与胰腺癌患者预后相关的分子标志物对指导胰腺癌治疗和改善预后尤为重要。
细胞周期蛋白依赖性激酶(CDKs)是一类丝氨酸/苏氨酸激酶,在细胞分裂和转录翻译中具有重要作用,其功能的发挥受到一系列周期蛋白的调控[18-19]。Spy1是一个新的细胞周期调控蛋白。Porter等[6]发现Spy1可消除细胞周期抑制蛋白P27对细胞周期的阻滞,增强CDK2对组蛋白H1的蛋白激酶活性,通过促进G1/S期转换促进细胞增殖。在细胞发生DNA损伤时,Spy1表达水平显著升高,通过激活CDK2来应对DNA损伤从而保护细胞存活[20]。Spy1在疾病中的作用也有所报道[21],Spy1可通过依赖c-Jun氨基末端激酶信号通路调控轴突维持因子的磷酸化和降解,在损伤性轴索变性疾病中发挥重要功能。在肿瘤中,Spy1在调控胶质瘤干细胞CD133+的细胞群体分裂中发挥重要作用[22]。在上皮性卵巢癌中,Spy1随肿瘤级别的增高表达量增加,高表达Spy1与卵巢癌预后不良相关,在细胞系中敲低Spy1表达,显著抑制卵巢癌细胞增殖并促进细胞凋亡[23]。研究[9]发现,Spy1高表达于结肠癌组织中,其表达水平与恶性临床病理因素相关,并可作为评估结肠癌患者预后的独立危险因素。
本研究发现Spy1 在胰腺癌组织中表达存在差异,其中Spy1高表达占64.7%,Spy1低表达占35.3%,提示胰腺癌组织中Spy1以高表达为主,这与其他肿瘤表达情况报道一致[23]。本研究发现Spy1 蛋白表达与肿瘤大小、TNM 分期和分化程度等恶性临床病理特征相关,这些恶性因素正是患者术后预后不佳的原因。Spy1高表达组的胰腺癌患者术后无瘤生存率及总生存率也低于低表达组。单因素和多因素Cox风险比例回归模型示,Spy1是影响胰腺癌患者术后预后不良的独立危险因素。
Spy1发挥肿瘤生物学功能的机制已有报道。Spy1一方面通过直接结合CDK2影响其活性,另一方面,Spy1直接结合P27影响其稳定性,通过调节CDK2活性和P27稳定性来调控细胞周期,进而影响细胞增殖[24]。McGrath等[25]进一步通过解析Cdk2-Spy1和p27-Cdk2-Spy1复合物的晶体结构揭示,Spy1通过结合CDK2改变其空间构象从而影响其活性,Spy1缺少周期蛋白结合位点,导致P27对CDK-Spy1复合物的亲和力下降,从而影响细胞周期和增殖。报道[26]显示Spy1通过激活ERK信号通路导致雌激素受体α的激活,促进肿瘤细胞对化疗药物如他莫昔芬的耐受。
当然,本研究仅限于分析胰腺癌患者临床病理因素与Spy1表达水平的关联性研究,缺乏机制研究。根据本研究结果,结合之前的报道推测,Spy1 在胰腺癌中异常高表达的原因和在胰腺癌中所起的作用可能包括:首先,Spy1在胰腺癌中高表达的原因可能是表观遗传修饰的改变,包括微小RNA调控缺失及本身基因的突变等;其次,Spy1 在胰腺癌中的作用可能是促进肿瘤细胞生长、加速肿瘤进展和远处转移等。然而,Spy1在胰腺癌进展中的具体分子机制值得进一步研究。
综上,Spy1在胰腺癌组织中高表达,且与预后不良相关。Spy1高表达为影响胰腺癌患者预后的独立危险因素。
