腹腔镜胰体尾切除治疗胰腺体尾部肿瘤的安全性及疗效分析
2019-10-12陈杰邵月秦雷陈勇
陈杰,邵月,秦雷,陈勇
(1.四川省自贡市第四人民医院 肝胆外科,四川 自贡 643000;2.重庆医科大学研究生院,重庆 400016;3.重庆医科大学附属第一医院 肝胆外科,重庆 400016)
胰体尾切除术是治疗胰腺体尾部肿瘤的主要手术方式,早期胰体尾切除术以开腹为主。近年来随着腹腔镜技术的迅速发展,已有部分胰腺外科手术在腹腔镜下完成[1]。胰腺恶性肿瘤容易侵犯周围的器官和血管并容易出现较早的神经侵犯和淋巴结转移,因此其手术切除率和远期生存率不高[2]。在过去的一个多世纪胰腺外科发展历程中,为了提高切除率,改善远期疗效,许多学者对胰腺肿瘤进行了各种手术探索[3]。胰腺外科因手术难度大、操作复杂,腹腔镜手术治疗的发展相对缓慢,胰腺恶性肿瘤的腹腔镜切除目前仍有争议,如微创手术的安全性和治疗效果是否能达到开腹手术的水平。
本研究通过回顾腹腔镜胰体尾切除病例(LDP)与开腹(ODP)胰体尾切除病例资料,并对比两者的短期临床结果,R0切除率和淋巴结清除个数,评价LDP的安全性和可行性及临床效果。
1 资料与方法
1.1 病例来源
收集自贡市第四人民医院肝胆外科20 13年1月—2017年12月期间实施的41例LDP与46例ODP病例,排除术后病检为良性病变者(LDP 3例,O D P 2 例)及中转开腹者(2 例,中转率为4.1%),共36例LDP与44例ODP纳入本研究。所有手术均由本医疗机构实施,其中LDP均为同一人主刀,该医生已经开展III级以上的腹腔镜手术超过200台。ODP分别由2名外科医生实施,该2名医生均已经独立开展该手术5年以上。
1.2 手术方法
随着对脾脏的免疫和造血功能的进一步理解以及外科技术的进步,保留了脾脏的免疫功能,同时可避免脾切除术后凶险性感染的可能[4],越来越多的外科医生在腹腔镜下实施保留脾脏的胰体尾切除术[5-6]。但目前早期胰体尾癌确诊率很低,绝大部分患者发现时已属中晚期,存在脾脏侵犯[7],且保留脾脏对于手术者要求很高,不便于清扫第9、10、11、18组淋巴结[8]。目前,我院针对于胰体尾恶性肿瘤患者均行联合脾脏切除。胰体尾癌切除术标准的淋巴清扫范围:脾门淋巴结(No.10),脾动脉周围淋巴结(No.11),胰腺下缘淋巴结(No.18),对于病灶位于胰体部者,可清扫腹腔动脉干周围淋巴结(No.9),上述淋巴结与标本整块切除。LDP:麻醉后,患者取截石位,手术台头部抬高约20°,术者站立于患者两腿之间,助手分别站在患者两侧,脐下方作一弧形切口,气腹针穿刺,建立气腹,然后放置10 mm穿刺套管,插入腔镜镜头,在镜头视野下,置入其它套管针。使用超声刀分离胃结肠韧带至胃网膜血管处,探查胰腺及肿块,暴露胰腺上缘,继续切开胃脾韧带、胃结肠韧带,整体暴露胰体,分离出脾脏动静脉后用Hemo-lock 夹夹闭或4-0 Prolene缝扎之后切断脾脏动静脉,使用直线型切割闭合器距胰腺体尾部肿瘤>1 cm处用Endo-GIA切断胰腺体部组织,如有胰腺残端出血,予以缝合止血。逐步游离至脾脏上极,离断胃短血管。用电钩、超声刀适当分离脾脏周围的韧带以建立脾后隧道,切除胰尾及脾脏。最后,游离脾脏后将胰体尾连同脾脏一起置入标本袋,经左上腹辅助切口粉碎并取出脾脏组织后,完整取出胰体尾部标本,创口止血后,于胰腺断面置腹腔引流管1根。ODP:以左上腹部L形切口或过脐的上腹部正中切口进腹,其余处理方式与腹腔镜手术一致。
1.3 术后管理
于术后第2天查引流管淀粉酶,隔天1次;术后常规使用奥曲肽抑酶、奥美拉唑抑酸治疗;术中安置胃管,一般于术后1~2 d,待患者无胃肠道反应、无消化道出血后,拔除胃管,并开始进食流质;待引流管淀粉酶低于血清淀粉酶正常上限(125 U/L)且每日引流液少于30 mL后拔出;术后第1~2天,常规泵注氟比洛芬酯+曲马多注射液镇痛。对所有患者进行门诊及电话随访。
1.4 观察指标
收集术前数据,包括患者年龄、性别、身体质量指数(BMI)、入院症状和美国麻醉师协会(ASA)分级、纽约心功能分级、合并症情况、胰管宽度等。手术数据包括手术时间、术中失血量、病理分型、胰腺质地、淋巴结清扫数量(以最终病理报告为准)。临床疗效评估指标包括:肛门排气时间、饮食开始时间、术后住院时间、切口愈合分级、重症监护病房治疗(ICU)时间,及胃肠漏、术后胰瘘(POPF)、肺部感染、腹腔感染、术后出血、术后继发糖尿病、胃排空延迟、二次手术等并发症的发生率和病死率等。手术时间指切皮开始到关腹结束间隔的时间。术后并发症,均为术后30 d内出现的症状。胰瘘,胃排空延迟和术后出血的定义均依据胰腺外科的国际研究小组(ISGPS)的定义界定[9-11]。采用距离切缘1 mm以上无肿瘤的原则定义R0切除,否则为R1切除。并按Clavien-Dindo分级系统进行并发症分级[12-13]。
1.5 统计学处理
分类变量以数值和百分比表示,数据分析采用方差分析和Fisher's Exact Test检验,连续变量则以中位数或均值±标准差(±s)表示,统计分析采用t检验,所有的统计分析使用SPSS Version 16.0,生存分析采用Kaplan-Meier法,并绘制生存曲线。P<0.05为差异有统计学意义。
2 结 果
2.1 LDP 组与OPD 组患者一般资料
两组患者在年龄、性别、BMI、入院症状、ASA 分级、合并症、胰管直径、肿瘤大小、胰腺质地、腹部手术史等方面无统计学差异(均P>0.05)(表1)。
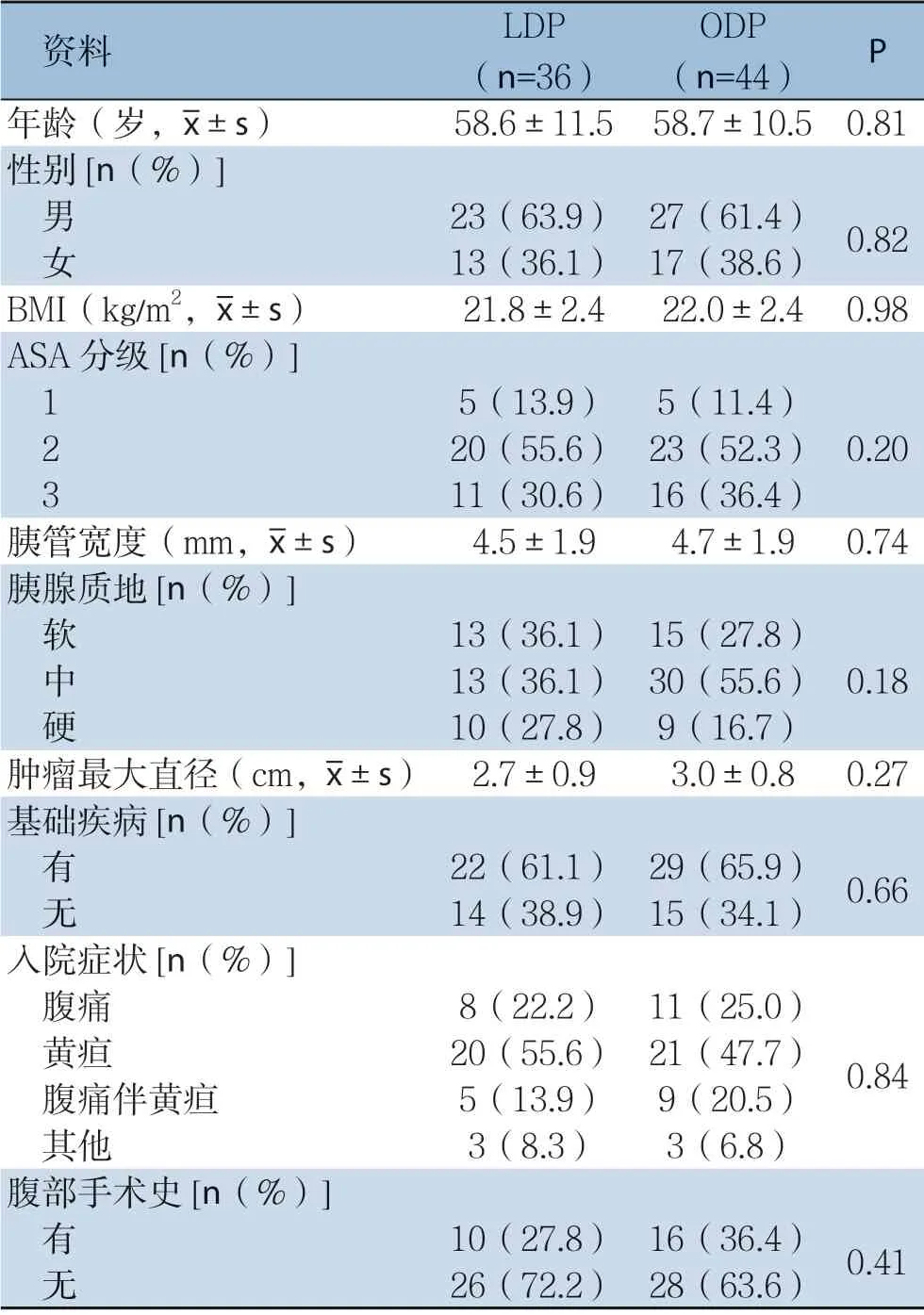
表1 两组患者一般资料比较Table 1 Comparison of the general data between the two groups of patients
2.2 LDP 组与OPD 组患者术中数据
与ODP 组比较,LDP 组手术时间明显延长(411.0 min vs.355.8 min,P<0.05),但术中出血、术中输血率及清扫淋巴结数目无统计学差异(均P>0.05)(表2)。
2.3 LDP 组与OPD 组患者术后病理结果
LDP组和ODP组在TMN分期(按照AJCC第7版标准)、R0切除率方面均统计学差异(均P>0.05)(表3)。
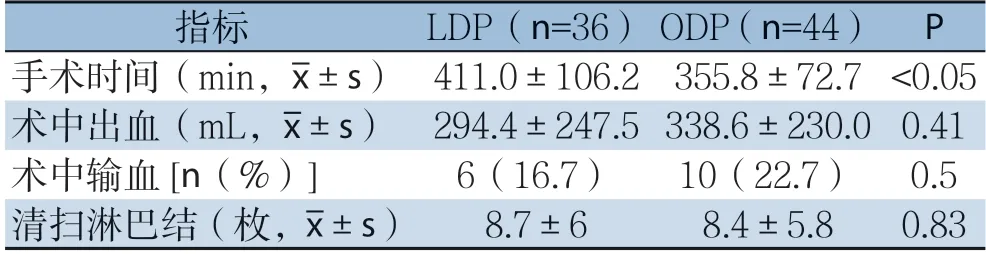
表2 两组患者术中资料比较Table 2 Comparison of the intraoperative data between the two groups of patients
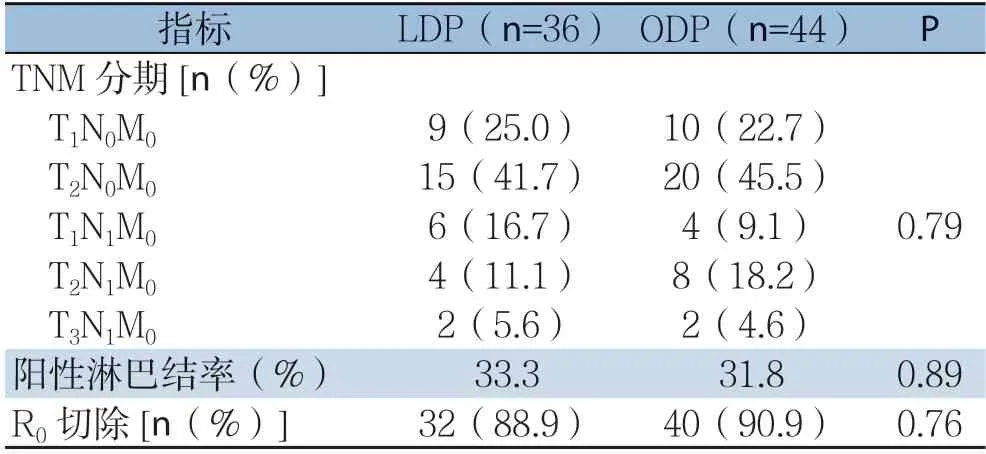
表3 两组患者术后病理资料比较Table 3 Comparison of the postoperative pathological data between the two groups of patients
2.4 两组患者术后情况
与ODP组比较,LDP组术后住院时间明显减少(7.9 d vs.11.5 d,P<0.01),ICU入住率明显降低(10/36 vs.30/44,P<0.01),肛门排气时间提前(1.6 d vs.3.2 d,P<0.01),下床活动时间提前(4.0 d vs.6.3 d,P<0.01);两组术后出血、术后胰瘘、术后腹部感染、术后肺部感染、再次手术率及术后30 d内病死率均无统计学差异(均P>0.05)(表4)。LDP组1例因术后出血保守治疗无效,急诊行介入血管栓塞术;ODP组1例因术后胃穿孔行胃穿孔修补术;另外,ODP组1例有因术后肺部感染导致感染性休克死亡。
2.5 术后随访
共有6例失访(其中ODP组失访4例,LDP组失访2 例),总失访率7.5%。中位随访时间44个月(95% CI=32.5~55.5),所有患者中位生存时间为24个月(95% CI=20.2~27.8),其中ODP 组中位生存时间为21个月(95% CI=18.8~23.2),LDP 组中位生存时间为24 个月(95% CI=20.8~27.2)。经Log-rank检验,两组中位生存时间差异无统计学意义(χ2=0.09,P=0.76)(图1)。
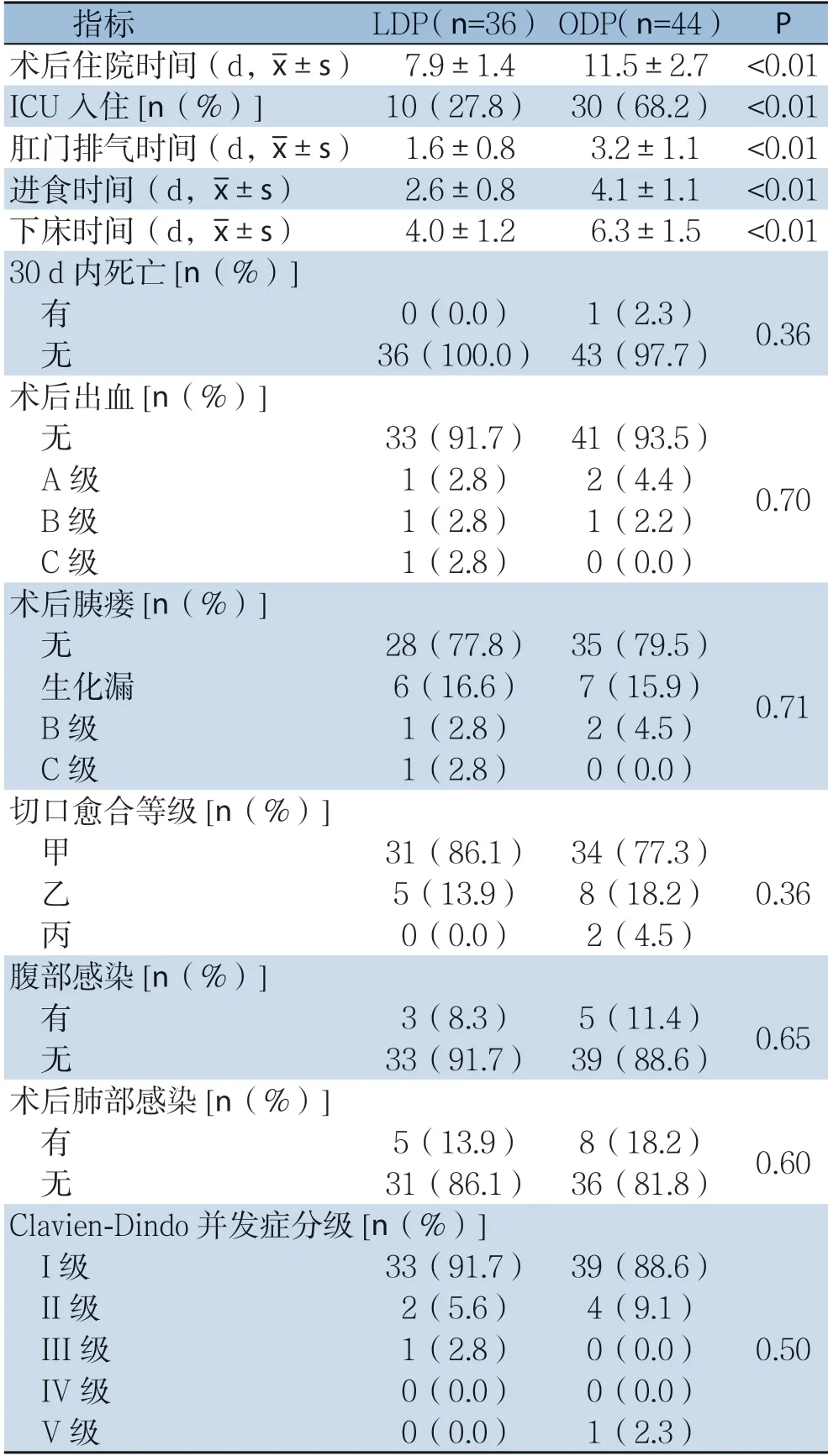
表4 两组患者术后情况比较Table 4 Comparison of the postoperative conditions between the two groups of patients
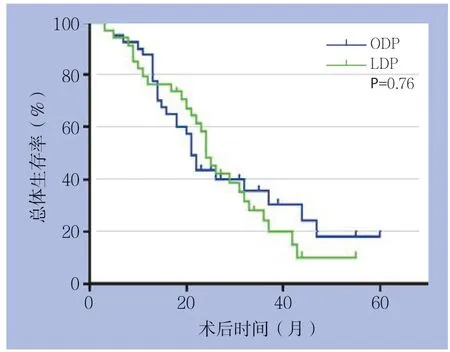
图1 两组患者术后生存曲线Figure 1 Postoperative survival curves of the two groups of patients
3 讨 论
胰腺外科因手术难度大、操作复杂,腹腔镜手术治疗的发展相对缓慢。近几年,腹腔镜胰体尾切除术处理胰腺恶性肿瘤的病例越来越多,但其应用仍存在争议[14],主要顾虑在于LDP能否做到与ODP一样的肿瘤根治效果及手术安全性。目前有部分文献[15-17]报告,与传统ODP相比,术中出血量小、术后恢复快及平均住院日短等优势。其术后并发症、胰瘘及近期肿瘤根治效果(R0切除率及淋巴结清扫数目)无明显差异,但总体病例数较少,缺乏前瞻性的或大宗病例对照研究。本研究中比较了36例LDP和44例ODP治疗胰体尾恶性肿瘤的手术疗效和肿瘤根治效果。
本研究发现,与ODP手术比较,LDP手术平均手术时间明显延长(411.0 min vs.355.8 min,P<0.05)。这可能与我院开展LDP手术时间较短、病例数偏少而开腹手术开展时间较长、手术技术较为成熟及腹腔镜胰腺手术存在学习曲线有关。与ODP手术比较,LDP手术术后住院时间显著减少(7.9 d vs.11.5 d,P<0.01),ICU入住率明显降低(10/36 vs.30/44,P<0.01),肛门排气时间提前(1.6 d vs.3.2 d,P<0.01),下床活动时间提前(4.0 d vs.6.3 d,P<0.01)。van Hilst等[18]进行了一项倾向得分匹配研究,共纳入共有来自11个国家、34个中心的1212例患者参与其中,于开腹手术相比,腔镜手术术中失血中位数(200 mL vs.300 mL,P=0.001)和住院时间(8 d vs.9 d,P<0.001)明显降低,本项研究与之结果相近,体现了微创手术术中损伤小、术后恢复快的固有优势。Clavien-Dindo分级系统已成为较好的定义胰腺术后并发症、评估严重程度的体系,对指导临床实践具有重要意义[19]。本研究Clavien-Dindo分级III级以上的病例少,且两组间的Clavien-Dindo分级、术后并发症率及胰瘘情况并无统计学差异,说明LDP治疗胰腺胰体尾恶性肿瘤安全可行,并具有创伤小、术后恢复快等微创手术优势。
目前手术仍是可切除胰腺癌患者获得长期生存的唯一机会,能否实现R0切除是其中的最关键因素[20-21]。在一个多中心对照研究中,Sharpe等[22]报道了来自美国国家癌症数据库的回顾资料,769例远端胰体尾导管腺瘤患者中144例LDP手术,LDP组R0切除率明显高于ODP组,但LDP组中肿瘤要小于ODP组并且LDP倾向于在教学机构展开。在本研究中,LDP组有32例(88.9%)达到R0切除,ODP组中40例达到R0切除(90.9%),与目前文献报告接近。
淋巴转移是胰腺恶性肿瘤转移的主要途径之一,淋巴结状态已被证明是生存中最有效的预测因子之一[23]。Kooby等[24]报告的LDP组清扫平均淋巴结数目为14.0,ODP 组为12.3,两组间无统计学差异(P=0.41)。Shin 等[25]报告的LDP组和ODP组均清扫淋巴结数目分别为12枚和10枚(P=0.22)。Stauffer等[26]报告的LDP组平均清扫淋巴结数目为25.9枚,而ODP组为12.7枚(P=0.0001)。在本研究中,LDP组平均清扫淋巴结数目为(8.7±6)枚,阳性淋巴结率为33.3%,ODP清扫淋巴结(8.4±5.8)枚,阳性淋巴结率为31.8%,两组间无统计学差异(P>0.05)。
LDP 组1例患者因急性动脉出血,保守治疗无效,行介入血管栓塞术,分析原因可能为手术分离中损伤了脾动脉分支,加上术后胰瘘导致出血。ODP组1例因术后胃穿孔行胃穿孔修补术,考虑原因为自发性胃穿孔。另外,ODP组有1例有因术后肺部感染导致感染性休克死亡,考虑原因为患者合并有慢性肺部疾病,术后因上腹部疼痛,咳嗽排痰减少、长期卧床诱发肺部感染。本研究提示胰体尾肿瘤术后存在较大的肺部感染几率,但LDP组与ODP组间无统计学差异(13.9% vs.18.2%,P=0.60),两者在术后肺部感染上是否存在差异,需要进一步行大样本的回顾性研究和前瞻性随机试验来证实。
胰体尾恶性肿瘤术后仍有较高的复发率,严重影响预后。术后长期生存状况是评价手术疗效的最重要指标之一。本研究的数据分析结果显示,LDP和ODP术后中位生存时间并无明显差异。
ODP手术和LDP手术治疗胰腺胰体尾恶性肿瘤具有相同的手术疗效和R0切除率,中位生存时间无明显差异,并且LDP手术治疗胰腺胰体尾恶性肿瘤是安全可行的,并具有创伤小、术后恢复快等微创手术优势。但本项目研究受限于回顾性设计,并且样本量较少。因此,研究结果尚需多中心、前瞻性的随机对照研究验证。
