猪脱细胞真皮基质对不同时间小鼠创面基质细胞衍生因子-1及蛋白激酶B表达的影响
2019-10-11胡映月李恭驰邹利军冯自波潘银根李炳辉
胡映月 李恭驰 邹利军 冯自波 杜 烨 王 知 潘银根 李炳辉
(1.华中科技大学同济医学院附属梨园医院创面修复科,湖北 武汉 430077; 2.华中科技大学同济医学院附属协和医院手外科,湖北 武汉 430022; 3.江苏省启东市人民医院整形美容科,江苏 启东 226200)
大面积创面及慢性难愈合创面的修复是医学难点,给患者个人及社会都带来沉重的医药负担[1-2]。大面积创面和慢性难愈合创面引起的全层皮肤损伤常伴有表皮和真皮的缺失。创面愈合的传统治疗方法主要针对炎症细胞,实际上创面治疗的目的不仅是表皮层、真皮层再生,更关键的是皮肤功能的恢复[3]。临床多用自体游离皮片移植治疗大面积深度烧伤创面或严重创伤导致的皮肤软组织缺损,效果良好,但往往患者自身供皮量有限,并且还存在着瘢痕愈合及供皮区额外损伤的缺陷。有研究发现,使用自体游离皮片或真皮替代物治疗创面,可明显减轻瘢痕挛缩,如果结合培养的表皮干细胞治疗,效果会更加明显[4-5]。我们团队在此前的实验中发现,大面积的皮肤缺损在没有皮肤移植和伤口未闭合的情况下,通过ADT(一种进口牛肌腱组织工程材料)治疗可以治愈,同时还有毛囊和汗腺再生的迹象[6]。由此我们猜想,国产类似的组织工程材料如猪脱细胞真皮基质(porcine acellular dermal matrix, pADM)可能也具有促进毛发生长的作用。我们采用7 d的创面模型进行研究,发现了与毛囊再生相关的因子如基质细胞衍生因子-1(stromal cell-derived factor-1, SDF-1) 及Wnt3a等表达的差异[7]。部分学者研究发现SDF-1 / CXCR4途径可以通过激活PI3K/AKT信号通路来调节细胞增殖和迁移[8-11]。为了进一步研究pADM对全层皮肤缺损创面及皮肤附件(主要是毛囊)修复的机制,我们观察了pADM作用不同时间后小鼠创面SDF-1及蛋白激酶B(protein kinase B,AKT)的表达,报告如下。
1 材料与方法
1.1 实验材料 SPF级健康C57BL/6小鼠18只,雄性,4周龄,体质量16~18 g,购自辽宁长生生物技术有限公司,许可证号:SCXK 2015-0001。饲养观察1周后用于实验。pADM由江苏优创生物医学科技有限公司赠送。产品注册证号:国械注准20173463366。4%多聚甲醛、PBS溶液、10×EDTA修复液、苏木素染液均购自武汉阿斯本生物技术有限公司,无水乙醇、二甲苯、过氧化氢、中性树胶均购自国药集团化学试剂有限公司,牛血清白蛋白(BSA)购自瑞士Roche公司,DAB显色试剂盒购自北京中杉金桥生物技术有限公司,一抗SDF-1购自英国Abcam公司,一抗AKT购自美国Cell Signaling Technology公司,二抗辣根过氧化物酶(HRP)购自武汉阿斯本生物技术有限公司。组化笔购自上海Genetech公司,普通光学显微镜、倒置显微镜、成像系统均购自日本OLYMPUS公司。
1.2 创面模型的建立 18只5周龄、体质量约(23±2) g的C57BL/6雄性小鼠,用5%水合氯醛腹腔注射麻醉,麻醉剂量按10 mg/kg计算。小鼠麻醉后背部剃毛,酒精消毒皮肤。以脊柱为中线,在左、右两侧各制作一个直径为6 mm的圆形全切除伤口,均用直径6 mm、高3 mm的柱状硅胶支撑架间断缝合于创面处,以隔离创面与临近皮肤,防止周围皮肤挛缩而影响创面愈合过程。硅胶支撑架的一端有一高1 mm、长2 mm缺口,缺口处形成创面窗,使得缺口成为连接创面与周围完整皮肤的唯一途径,用来观察是否有新生上皮通过缺口迁移到创面。小鼠背部左侧创面用生理盐水浸湿的纱布覆盖(对照组),将微粒状pADM用生理盐水调和成糊状后覆盖在右侧创面上(pADM组),左右两侧再同时用弹力绷带固定,观察小鼠的状态。模型建立后动物单笼喂养,自由摄食与饮水。
1.3 组织取材 分别于模型建立第1周、第2周、第3周、第4周、第6周、第8周,处死小鼠,每个时间点3只,每个创面取创缘组织(即未愈合创面组织与愈合的创面组织交界处)约150~200 mg,固定于4%多聚甲醛中,制作石蜡切片。
1.4 免疫组化检测SDF-1和AKT蛋白表达 石蜡切片置于65℃烘箱中烘片2 h,脱蜡至水,用PBS洗3次,每次5 min。切片置于EDTA缓冲液中微波修复,中火至沸后断电,间隔10 min低火至沸。自然冷却后PBS洗3次,每次5 min。切片置于3%过氧化氢溶液中,室温避光孵育10 min。PBS洗3次,每次5 min,甩干后5% BSA封闭20 min。去除BSA液,每张切片分别加入约50 μl稀释的一抗SDF-1(1∶100),AKT(1:300)覆盖组织,4 ℃过夜。PBS洗3次,每次5 min。去除PBS液,每张切片加50~100 μl相应种属的二抗HRP(1∶200),37 ℃孵育50 min。PBS洗3次,每次5 min。去除PBS液,每张切片加50~100 μl新鲜配制DAB溶液,显微镜控制显色。显色完全后,蒸馏水或自来水冲洗,苏木素复染,1%盐酸酒精分化(约1 s),自来水冲洗,氨水返蓝,流水冲洗。切片经过梯度乙醇(75%、90%、100%、100%)10 min,脱水干燥,二甲苯透明,中性树胶封固,显微镜下观察,利用图像分析软件测量图片染色程度,以积分吸光度(A)值反映蛋白表达量。
1.5 统计学处理 应用SPSS 24.0软件进行数据处理。计量资料以 表示,SDF-1及AKT两种因子在不同时间点多组间的比较采用重复测量方差分析(F检验),不同时间点两种因子在pADM组及对照组两组间的比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 创面大体观察 在模型建立1周后,pADM组、对照组创面均开始缩小,创面开口处出现肉眼可见的新生上皮组织,与我们前期的研究观察到的结果相同[7]。pADM组随着时间推移,创面逐渐缩小,至第3周时创面基本完全愈合。从第4周开始创面处开始出现零星白色毛发,之后逐渐丰富,至第8周时毛发基本覆盖创面。而对照组愈合速度较慢。
2.2 SDF-1和AKT的蛋白表达 免疫组化检测发现,在模型建立后的第 1、2、3、4、6、8周各观察时间段,SDF-1及AKT两种因子的蛋白表达不同,SDF-1蛋白表达积分A值不同观察时间之间的效应差异存在统计学意义(F=45.719,P=0.000),pADM组与对照组之间差异有统计学意义(F=47.513,P=0.002);AKT蛋白表达A值不同观察时间之间的效应差异也存在统计学意义(F=94.905,P=0.000),pADM组与对照组之间差异无统计学意义(F=2.978,P=0.159)。pADM组及对照组两组间的SDF-1蛋白表达不同,其中第3、8周时差异具有显著性(t3=8.559,P=0.001;t8=-7.042,P=0.002),其他时间两组间差异无显著性。AKT蛋白表达则在第2、3、4、6、8周时两组间差异具有显著性(对应t2=6.097,P=0.004;t3=8.462,P=0.001;t4=-9.711,P=0.001;t6=-8.296,P=0.001;t8=-6.079;P=0.004),第1周时两组间差异无显著性。AKT与SDF-1两种因子在pADM组中具体有相似的变化趋势,均于第2周开始升高,于第3周达高峰,此时两种因子在pADM组和对照组中表达差距最大;从第3周开始下降,到第8周又出现回升。见表1和表2。
2.3 创缘组织SDF-1和AKT蛋白表达的病理学观察 免疫组化结果显示,SDF-1及AKT在创面组织中表达,阳性细胞主要分布在毛囊细胞周围,且pADM组中SDF-1及AKT的表达明显高于对照组。见图1(封二)。
3 讨 论
脱细胞真皮基质作为生物支架,起着再生框架的作用,用于支持宿主细胞整合和新的胶原沉积,在复杂伤口修复、腭裂修复等颅面手术、腹壁缺损修复、假体乳房重建和美容手术等外科组织重建手术中发挥重要作用,后逐渐应用于创面修复[12]。
表1 不同时间的创缘SDF-1蛋白表达积分吸光度的比较(,n=3,A值)
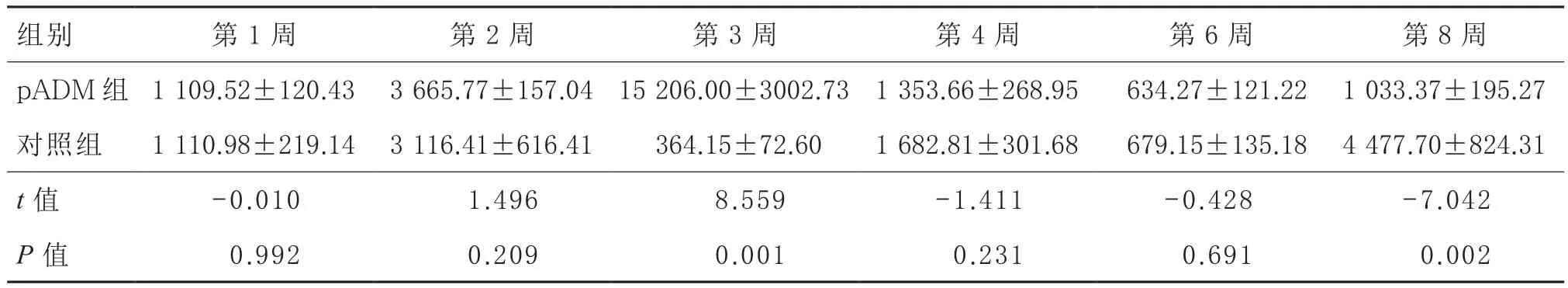
表1 不同时间的创缘SDF-1蛋白表达积分吸光度的比较(,n=3,A值)
组别 第1周 第2周 第3周 第4周 第6周 第8周pADM组 1 109.52±120.43 3 665.77±157.04 15 206.00±3002.73 1 353.66±268.95 634.27±121.22 1 033.37±195.27对照组 1 110.98±219.14 3 116.41±616.41 364.15±72.6000 1 682.81±301.68 679.15±135.18 4 477.70±824.31 t值 -0.010 1.496 8.559 -1.411 -0.428 -7.042 P值 0.992 0.209 0.001 0.231 0.691 0.002
表2 不同时间创缘AKT蛋白表达的比较(,n=3,A值)
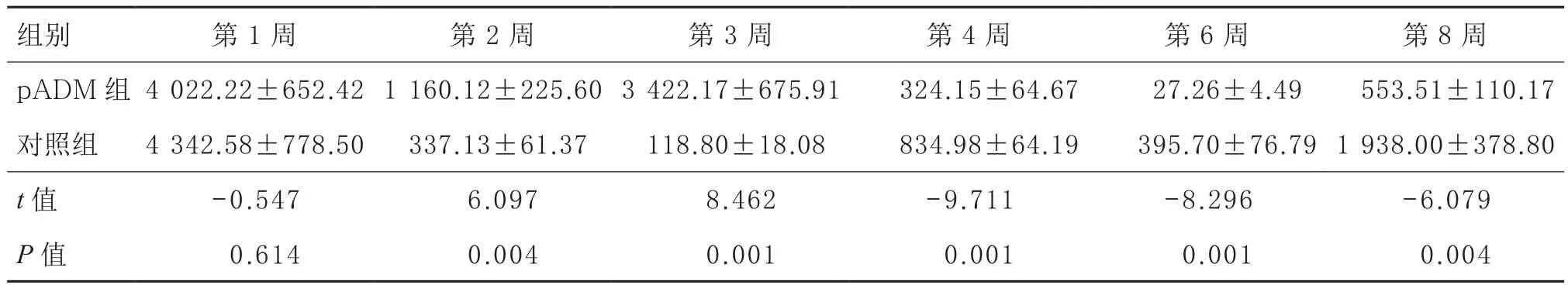
表2 不同时间创缘AKT蛋白表达的比较(,n=3,A值)
组别 第1周 第2周 第3周 第4周 第6周 第8周pADM 组 4 022.22±652.421 160.12±225.603 422.17±675.91 324.15±64.67 27.26±4.490 553.51±110.17对照组 4 342.58±778.50 337.13±61.370 118.80±18.080 834.98±64.19 395.70±76.791 938.00±378.80 t值 -0.547 6.097 8.462 -9.711 -8.296 -6.079 P值 0.614 0.004 0.001 0.001 0.001 0.004
在创面愈合过程中,创面组织再生的微环境具有重要作用。脱细胞真皮基质是将供体皮肤用特殊方法去细胞化,在真皮基质中保留其结构和生物活性物质,可支持宿主细胞再生[13]。同时脱细胞真皮基质可以提供防止污染的屏障,维持潮湿的伤口环境,有助于促进血管和细胞再生[14-16]。pADM是一种猪来源的工程化皮肤组织,其所有细胞成分都已被去除,在国内应用于创面治疗中[17]。研究显示,pADM可以最大程度地保留创面残留的真皮组织和上皮细胞,保护内部组织,帮助加速上皮细胞和干细胞的再生,促进肉芽组织的生长[18]。
SDF-1及其受体CXCR4在多种类型组织中参与调节与损伤修复相关的干细胞的迁移[19]。SDF-1被认为是未成熟造血干细胞的强效化学诱导剂[20]。研究表明,SDF-1与CXCR4结合后,可通过激活多种信号转导通路介导其生物学行为,如调控细胞趋化、增殖、凋亡、存活和分化等生物功能[21]。同时SDF-1/CXCR4轴在皮肤创伤愈合中起重要作用[22]。本实验中我们发现,从第2周开始,创缘组织AKT蛋白表达变化与SDF-1蛋白表达具有相似变化趋势,这可能给我们提供了一条思路,在创面愈合过程中的不同时间,SDF-1/CXCR4轴可能通过激活PI3K/AKT而诱导毛囊干细胞等的增殖或迁移来促进创面全层皮肤的愈合甚至是皮肤附属器如毛囊的再生。
本次研究中第3周时SDF-1和AKT两种因子在pADM组达到上升高峰,从第3周开始下降,到第8周开始回升,这可能是应用pADM逐渐改变了创面的微环境,包括SDF-1及AKT的表达变化,从而刺激某些干细胞从周围的正常组织迁移到伤口附近,启动再生。而对于 SDF-1在第3、8周时pADM组及对照组两组间的蛋白表达具有显著性差异,其他时间两组间无显著性差异;AKT在第2、3、4、6、8周时两组间的蛋白表达具有显著性差异,第1周时两组间则无显著性差异,以及两种因子上升及下降的变化与创面愈合程度的具体关联,考虑到样本量不大,且目前pADM促进创面愈合的确切机制尚不明确,暂无法肯定分析SDF-1及AKT不同时间点两组间这种差异的具体原因和它们上升及下降的变化与创面愈合程度的关联。后续我们将考虑扩大样本量,进一步研究pADM促进创面愈合的机制,必要时改进pADM这种材料。
既往研究发现,胚胎干细胞、间充质干细胞及表皮干细胞是皮肤种子细胞的重要来源,可以作为创面治疗的突破口,尤其是表皮干细胞,体外研究显示其能更稳定地向表皮细胞分化,起到促进创面愈合的作用[23]。已发现SDF-1可以促进表皮干细胞的迁移和增殖,从而加速皮肤伤口愈合[24-25]。本研究中通过免疫组化观察发现,SDF-1及AKT在创面组织中表达,且阳性细胞主要分布在毛囊细胞周围。由此我们猜测,在创面愈合过程中,SDF-1及AKT可能促进创面全层皮肤的愈合甚至是皮肤附属器如毛囊的再生,但其具体机制尚不明确。
总之, pADM可能通过促进SDF-1/CXCR4信号通路及下游信号因子AKT的表达而促进创面愈合或者毛囊修复,其机制还有待进一步研究。
