宁前胡内生真菌Fusarium tricinctum次生代谢产物研究
2019-10-11刘丛彬刘海涛杨家欣刘劲松王国凯
刘丛彬,刘海涛,杨家欣,刘劲松,王 刚,王国凯*
1 安徽中医药大学药学院 现代中药安徽省工程技术中心,合肥 230012;2 中国医药大学附设医院医学研究部,台中 40447
植物内生真菌是指那些在其成长过程中存在于植物组织内但并没有引起植物组织明显病变的真菌[1]。内生真菌次生代谢产物已经从中发现了许多具有抗菌,杀虫,细胞毒和抗癌作用的活性成分[2],且涵盖了生物碱,萜类,醌类,肽类,氧杂蒽酮类和酚类[3]等多种结构类型,因此植物内生真菌次生代谢产物具有生物活性多样、结构类型丰富等特点和优势。
前胡为伞形科白花前胡(PeucedanumpraeruptorumDunn.)干燥根,常用于风热感冒、咳嗽痰多、痰热喘满等症状[4]。宁国所产前胡具有个大、皮黑、肉白、条长、柔软、香味浓等特点,为传统道地药材“宁前胡”[5]。目前没有相关宁前胡内生真菌报道,前期研究从宁前胡中分离鉴定了41株内生真菌,分属于10属21种,其中Fusariumtricinctum为优势菌株[6]。为探讨宁前胡内生真菌次生代谢产物,从内生菌F.tricinctum液体发酵法的乙酸乙酯萃取物中分离鉴定了13个单体化合物,分别为cyclo-(L-pro-L-pro) (1)、cyclo-(S-pro-S-leu)(2)、cyclo-(L-phe-L-phe)(3)、cyclo-(D-pro-L-phe)(4)、cyclo-(L-pro-L-phe)(5)、cyclo-(D-pro-L-leu)(6)、cyclo-(S-pro-S-leu)(7)、cyclo-[D-(4-hydroxyprolinyl)]-(L)-leucine(8)、cyclo-[L-(4-hydroxyprolinyl)]-(L)-leucine(9)、cyclo-(trans-4-hydroxy-L-prolyl-L-phenylalanine)(10)、cyclo-(D-cis-hyp-L-phe)(11)、苯甲酸苄酯(12)和苯乙酸(13)。所有化合物均首次从内生真菌F.tricinctum中分离得到。体外抗肿瘤活性显示化合物4、6、7对CAR、CAL27、SCC-4、SCC-9、HSC-3五种口腔癌肿瘤细胞有一定的细胞毒活性,可为宁前胡内生真菌次生代谢产物的研究提供参考。
1 材料与方法
1.1 仪器与试剂
质谱由Waters Auto Premier P776质谱仪测定;核磁共振由Bruker AM-400、DRX 500和AVANCE Ⅲ-600测定;制备液相为Agilent 1260;分析液相为Agilent 1100;中压制备为BüCHI中压制备;硅胶由青岛海洋化工厂生产;Sephadex LH-20由GE公司生产。
1.2 菌种
新鲜宁前胡药材采自安徽宁国,经安徽中医药大学梁益敏副教授鉴定为伞形科前胡属白花前胡(P.praeruptorum),凭证编号QHX34。F.tricinctum菌株从宁前胡新鲜根中分离得到,药材及菌株保存于安徽中医药大学天然药物化学研究室。
1.3 真菌发酵
F.tricinctum菌株接种到新PDA活化,6 mm打孔器打孔使菌块均匀分布在液体培养基中。分装、灭菌,接种后放入培养箱,135 rpm、28 ℃振荡培养15 天。乙酸乙酯萃取发酵液,合并,得到浸膏13.6 g。
1.4 提取分离
发酵液乙酸乙酯萃取物浸膏经硅胶柱以氯仿-甲醇梯度洗脱,TLC检测合并,得到6个组分。组分3经MPLC法以甲醇/水梯度洗脱,组分3-2经Sephadex LH-20(甲醇)和制备液相(乙腈/水,10∶90 → 25∶75)纯化得化合物1(8.6 mg,20.5 min)和2(6.8 mg,23.3 min)。组分3-2以氯仿/甲醇经硅胶柱层析得到3个组份。组分3-2-2经Sephadex LH-20(甲醇)和制备液相(乙腈/水,20∶80 →35∶65)纯化得化合物3(5.5 mg,27.7 min)。组分3-3经Sephadex LH-20 (甲醇)洗脱得到3个组分。组分3-3-1经制备液相(乙腈/水,30∶70 → 45∶55)制备得化合物4(3.5 mg,34.5 min)和5(4.5 mg,38.0 min)。3-3-2组分经制备液相(乙腈/水,25∶75 → 40∶60)制备得化合物6(5.0 mg,31.2 min)和7(3.0 mg,33.4 min)。组分4以氯仿/甲醇经硅胶柱层析得到4个组分,组分4-1经Sephadex LH-20(甲醇)和制备液相(乙腈/水,30∶70 → 45∶55)纯化得化合物8(6.0 mg,26.5 min)和9(2.5 mg,27.4 min)。组分4-2以(甲醇/水,10∶100~100∶0)经MPLC梯度洗脱得到4个组分。组分4-2-1经Sephadex LH-20(甲醇)和制备液相(乙腈/水,20∶80 → 35∶65)纯化得化合物10(5.3 mg,28.9 min)和11(2.0 mg,30.4 min)。组分5经Sephadex LH-20(甲醇)洗脱,组分5-1经制备液相(乙腈/水,10∶90 → 25∶65)制备得化合物12(11.3 mg,23.2 min)。5-2经制备液相(乙腈/水,15∶85 → 30∶70)制备得化合物13(6.3 mg,22.6 min)。
1.5 抗肿瘤活性筛选
采用MTT法[7]测定化合物对CAR、CAL27、SCC-4、SCC-9、HSC-3五种口腔癌肿瘤细胞株(中国医药大学附设医院提供)的细胞毒活性。样品梯度稀释,肿瘤细胞分别接种于96孔板,每孔100 μL,加入不同浓度药物,20 h每孔加入5 mg/mL的MTT 10 μL,继续培养4 h后弃去上清液,加入100 μL DMSO,492 nm测定OD值。肿瘤细胞存活率是加药组与对照组比较,公式:Viability (%) =(Atreatment/Acontrol)×100%,计算IC50。
2 结果
2.1 结构鉴定
化合物1白色晶体 (CH3OH),ESI-MS:m/z217[M+Na]+;1H NMR (400 MHz,CD3OD)δ:4.36 (2H,t,J= 8.0 Hz,H-2,5),3.53 (2H,m,H-9,12),2.30 (2H,m,H-8,11),2.05 (2H,m,H-7,10);13C NMR (125 MHz,CD3OD)δ:61.7 (C-2,5),168.6 (C-3,6),24.1 (C-7,10),28.7 (C-8,11),46.1 (C-9,12)。上述数据与文献[8]报道基本一致,确定为cyclo-(L-pro-L-pro)。
化合物2白色粉末 (CH3OH),ESI-MS:m/z219[M+Na]+;1H NMR (400 MHz,CD3OD)δ:4.13 (1H,t,J= 8.2 Hz,H-6),4.05 (1H,s,H-9),3.63~3.69 (1H,m,H-3a),3.53-3.62 (1H,m,H-3b),2.68 (1H,m,H-4a),2.33-2.38 (1H,m,H-4b),1.88-2.06 (1H,m,H-10),1.09 (3H,d,J= 8.2 Hz,H-11),0.95 (3H,d,J= 8.2 Hz,H-12);13C NMR (125 MHz,CD3OD)δ:172.8 (C-1),46.3 (C-3),25.7 (C-4),29.0 (C-5),60.2 (C-6),167.9 (C-7),54.6 (C-9),30.3 (C-10),19.6 (C-11),16.8 (C-12)。上述数据与文献[9]报道基本一致,确定为cyclo-(S-pro-S-leu)。
化合物3白色晶体 (CH3OH),ESI-MS:m/z317[M+Na]+;1H NMR (400 MHz,CD3OD)δ:7.30~7.02 (5H,m,H-2′,3′,4′,5′,6′),4.07 (1H,dd,J= 3.6,13.4 Hz,H-3),2.08 (2H,dd,J= 8.0,13.4 Hz,H-3a);13C NMR (150 MHz,CD3OD)δ:166.2 (C-2),55.4 (C-3),136.5 (C-1′),129.8 (C-2′),128.2 (C-3′),126.5 (C-4′),39.6 (C-3a)。上述数据与文献[10]报道基本一致,确定为cyclo (L-phe-L-phe)
化合物4白色粉末 (CH3OH),ESI-MS:m/z267[M+Na]+;1H NMR (400 MHz,CD3OD)δ:7.29~7.18 (5H,m,H-2′,3′,4′,5′,6′),4.19 (1H,t,J= 6.8 Hz,H-9),4.05 (1H,m,H-6),3.53 (2H,m,H-3),3.33~3.28 (1H,dd,J= 4.0,9.4 Hz,H-10b),3.21~3.16 (1H,dd,J= 4.0,9.4 Hz,H-10a),3.00~2.85 (1H,dd,J= 4.8,13.9 Hz,H-6),2.63~2.59 (1H,m,H-5b),2.03-2.01 (1H,m,H-5b),1.90 (2H,m,H-4),1.68-1.57 (1H,m,H-5a);13C NMR (125 MHz,CD3OD)δ:167.4 (C-1),46.1 (C-3),22.4 (C-4),29.8 (C-5),59.0 (C-6),171.3 (C-7),59.7 (C-9),40.9 (C-10),136.7 (C-1′),131.2 (C-2′),129.6 (C-3′),128.5 (C-4′)。上述数据与文献[11]报道基本一致,确定为cyclo-(D-pro-L-phe)。
化合物5白色粉末 (CH3OH),ESI-MS:m/z267[M+Na]+;1H NMR (400 MHz,CD3OD)δ:7.27~7.22 (5H,m,H-2′,3′,4′,5′,6′),4.43 (1H,t,J= 1.9,5.0 Hz,H-9),4.05 (1H,m,H-6),3.54 (2H,m,H-3),3.36 (1H,m,H-10a),3.23~3.15 (1H,m,H-10b),2.08 (1H,m,H-5a),1.81~1.75 (2H,m,H-4),1.23~1.18 (1H,m,H-5b);13C NMR (125 MHz,CD3OD)δ:167.5 (C-1),45.9 (C-3),22.7 (C-4),29.3 (C-5),57.6 (C-6),170.9 (C-7),60.0 (C-9),38.2 (C-10),137.3 (C-1′),131.2 (C-2′),129.4 (C-3′),128.0 (C-4′)。上述数据与文献[11]报道基本一致,确定为cyclo-(L-pro-L-phe)。
化合物6白色粉末 (CH3OH),ESI-MS:m/z233[M+Na]+;1H NMR (400 MHz,CD3OD)δ:4.28 (1H,dd,J= 6.4,9.5 Hz,H-6),3.84 (1H,dd,J= 5.4,9.5 Hz,H-9),3.60 (1H,m,H-3a),3.57~3.46 (1H,m,H-3b),2.34 (1H,m,H-4a),2.02~1.88 (1H,m,H-4b),1.84 (2H,m,H-5),1.78 (1H,m,H-10a),1.67 (1H,m,H-10b),1.56 (1H,m,H-11),0.98 (3H,d,J= 6.4 Hz,H-12),0.95 (3H,d,J= 6.5 Hz,H-13);13C NMR (125 MHz,CD3OD)δ:171.6 (C-1),46.7 (C-3),23.0 (C-4),29.9 (C-5),61.3 (C-6),169.0 (C-7),59.3 (C-9),43.6 (C-10),25.5 (C-11),23.3 (C-12),21.9 (C-13)。上述数据与文献[9]报道基本一致,确定为cyclo-(D-pro-L-leu)。
化合物7白色粉末 (CH3OH),ESI-MS:m/z233[M+Na]+;1H NMR (400 MHz,CD3OD)δ:4.13 (1H,dd,J= 8.2 Hz,H-6),4.05 (1H,dd,J= 3.4,9.4 Hz,H-9),3.50 (2H,m,H-3),2.28 (1H,m,H-5a),2.03 (1H,m,H-5b),1.99 (2H,m,H-4a,H-10a),1.91 (2H,m,H-4b,H-10b),1.51 (1H,m,H-11),0.95 (6H,m,H-12,13);13C NMR (125 MHz,CD3OD)δ:172.8 (C-1),46.3 (C-3),23.6 (C-4),29.0 (C-5),60.2 (C-6),168.9 (C-7),54.6 (C-9),39.3 (C-10),25.7 (C-11),23.3 (C-12),22.2 (C-13)。上述数据与文献[12]报道基本一致,确定为cyclo-(S-pro-S-leu)。
化合物8白色粉末 (CH3OH),ESI-MS:m/z249[M+Na]+;1H NMR (400 MHz,CD3OD)δ:4.45 (1H,dd,J= 6.6,11.3 Hz,H-6),4.38 (1H,t,J= 4.2 Hz,H-8),4.15 (H,m,H-3),3.66 (1H,dd,J= 4.6,12.6Hz,H-9a),3.46 (1H,d,J= 12.4 Hz,H-9b),2.28 (1H,dd,J= 6.4,13.2Hz,H-7a),2.11 (1H,m,H-7b),1.99~1.78 (2H,m,H-10),1.65~1.36 (1H,m,H-11),0.96 (6H,m,H-12,13);13C NMR (125 MHz,CD3OD)δ:171.2 (C-2),57.5 (C-3),169.4 (C-5),69.2 (C-6),37.6 (C-7),54.4 (C-8),56.9 (C-9),43.3 (C-10),25.5 (C-11),23.0 (C-12),21.9 (C-13)。上述数据与文献[13]报道基本一致,确定为cyclo-[D-(4-hydroxyprolinyl)]-(L)-leucine。
化合物9白色粉末 (CH3OH),ESI-MS:m/z249[M+Na]+;1H NMR (400 MHz,CD3OD)δ:4.47 (1H,m,H-8),4.05 (1H,dd,J= 4.2,10.3 Hz,H-6),3.88 (2H,m,H-3,9a),3.56 (1H,dd,J= 4.6,12.4 Hz,H-9b),2.46 (1H,dd,J= 6.4,13.2Hz,H-7a),2.29 (1H,m,H-7b),1.99~1.78 (2H,m,H-10),1.65-1.36 (1H,m,H-11),1.03 (3H,d,J= 6.9 Hz,H-12),0.98 (3H,d,J= 6.9 Hz,H-13);13C NMR (125 MHz,CD3OD)δ:172.3 (C-2),56.9 (C-3),169.8 (C-5),59.7 (C-6),37.7 (C-7),69.4 (C-8),55.4 (C-9),43.1 (C-10),25.2 (C-11),23.4 (C-12),21.5 (C-13)。上述数据与文献[14]报道基本一致,确定为cyclo-[L-(4-hydroxyprolinyl)]-(L)-leucine。
化合物10白色粉末 (CH3OH),ESI-MS:m/z283[M+Na]+;1H NMR (400 MHz,CD3OD)δ:7.29~7.17 (5H,m,H-2′,3′,4′,5′,6′),4.32~4.30 (2H,m,H-9,H-8),4.20 (1H,t,J= 4.4 Hz,H-4),3.72 (1H,dd,J= 5.1,13.0 Hz,H-3b),3.21 (1H,d,J= 13.4 Hz,H-3a),3.02 (2H,dd,J= 3.3,5.2 Hz,H-10),1.99 (1H,dd,J= 6.0,13.0 Hz,H-5a),1.08 (1H,m,H-5b);13C NMR (125 MHz,CD3OD)δ:171.3 (C-1),38.9 (C-3),67.9 (C-4),55.4 (C-5),167.5 (C-7),57.3 (C-8),59.7 (C-9),40.9 (C-10),136.5 (C-1′),131.1 (C-2′,6′),129.7 (C-3′,5′),128.5 (C-4′)。上述数据与文献[15]报道基本一致,确定为cyclo-(trans-4-hydroxy-L-prolyl-L-phenylalanine)。
化合物11白色粉末 (CH3OH),ESI-MS:m/z283[M+Na]+;1H NMR (400 MHz,CD3OD)δ:7.27~7.18 (5H,m,H-12,13,14,15,16),4.32~4.24 (2H,m,H-3,8),3.72 (1H,dd,J= 5.1,13.0 Hz,H-9b),3.21 (1H,m,H-9a),3.02 (2H,dd,J= 4.8,13.3 Hz,H-10),2.78 (1H,t,J= 9.6 Hz,H-6),2.21 (1H,dd,J= 6.6,12.8 Hz,H-7a),1.94 (1H,m,H-7b);13C NMR (125 MHz,CD3OD)δ:167.5 (C-2),59.7 (C-3),171.3 (C-5),57.1 (C-6),38.9 (C-7),67.9 (C-8),55.4 (C-9),40.9 (C-10),136.5 (C-11),131.1 (C-12,16),129.7 (C-13,15),128.5 (C-14)。上述数据与文献[15]报道基本一致,确定为cyclo-(D-cis-hyp-L-phe)。
化合物12淡黄色油状物 (CH3OH),ES I-MS:m/z235[M+Na]+;1H NMR (400 MHz,CD3OD)δ:7.45~7.29 (5H,m,H-4,5,6,7,8,9),7.27~7.11 (5H,m,H-2′,3′,4′,5′,6′),3.30 (2H,s,H-3);13C NMR (100 MHz,CD3OD)δ:173.5 (C-1),63.2 (C-3),137.6 (C-4),123.6 (C-5,9),125.8 (C-6,8),124.0 (C-7),130.8 (C-1′),127.5 (C-2′,6′),125.2 (C-3′,5′),132.3 (C-4′)。上述数据与文献[16]报道基本一致,确定为苯甲酸苄酯。
化合物13白色粉末 (CH3OH),ESI-MS:m/z136[M]+;1H NMR (400 MHz,CD3OD)δ:7.31~7.22 (5H,m,H-2,3,4,5,6),3.58 (2H,s,H-7);13C NMR (125 MHz,CD3OD)δ:136.2 (C-1),130.2 (C-2,2′),129.4 (C-3,3′),127.8 (C-4),42.1 (C-7),175.9 (C-8)。上述数据与文献[17]报道基本一致,确定为苯乙酸。
2.2 抗肿瘤活性结果
化合物1~13进行了对5种口腔癌细胞株 CAR、CAL27、SCC-4、SCC-9、HSC-3抗肿瘤活性的细胞毒筛选,结果发现化合物4、6、7具有中等的抑制作用,结果见表1。以IC50表示半抑制浓度,其中化合物4对5种口腔癌细胞株IC50分别是45.33 ± 3.21、39.42 ± 2.19、40.23 ± 2.72、40.22 ± 3.21、39.44 ± 2.98 μM/mL。化合物6对5种口腔癌细胞株IC50分别是46.43 ± 3.98、41.23 ± 2.19、40.89 ± 2.98、43.22 ± 2.11、40.42 ± 2.96 μM/mL。化合物7对5种口腔癌细胞株IC50分别是48.98 ± 2.33、43.21 ± 1.12、41.23 ± 3.23、45.22 ± 2.23、42.42 ± 3.01 μM/mL。
3 结论
从道地药材宁前胡内生菌F.tricinctum液体发酵液中分离并鉴定了13个单体化合物,所有化合物均首次从F.tricinctum内生真菌中分离得到。体外抗肿瘤活性显示化合物4、6、7对CAR、CAL27、SCC-4、SCC-9、HSC-3五种口腔癌肿瘤细胞有一定的细胞毒活性。
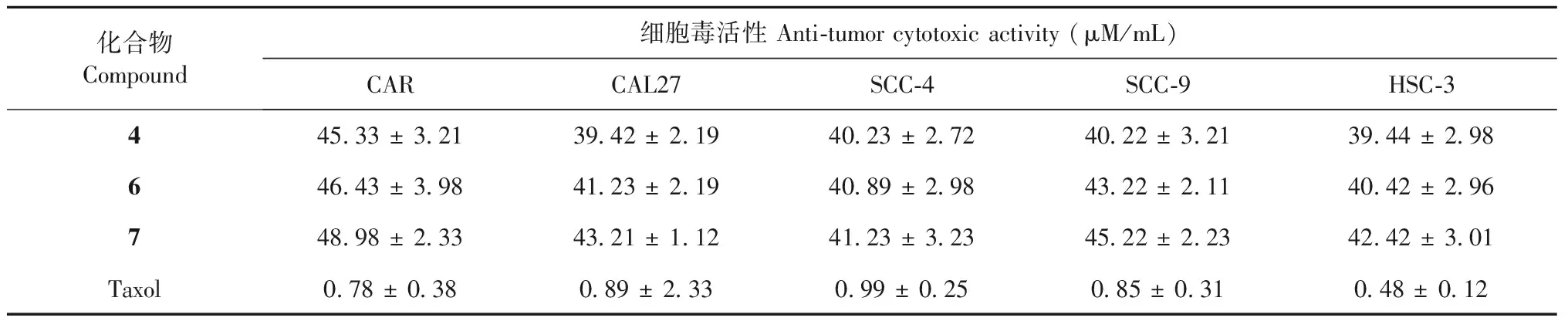
表1 化合物抗肿瘤细胞毒活性
