细叶远志皂苷在Aβ23-35诱导SH-SY5Y细胞氧化损伤中的作用及机制研究
2019-10-11金桂芳余河汉
王 琳,金桂芳,余河汉,李 巧,杨 红
广东药科大学生命科学与生物制药学院,广州 510006
阿尔茨海默病(Alzheimer’s disease,AD)是一种以认知和记忆损害为特征的神经退行性疾病,以细胞外β-淀粉样蛋白(β-amyloid protein,Aβ)在脑内异常沉积为主要病理特征[1]。Aβ在脑内沉积会引起ROS过量产生,造成脂质、蛋白质和核酸等生物大分子过氧化,从而引起细胞和机体损伤,最终导致神经系统损伤[2,3]。在AD研究中,常使用Aβ片段如Aβ25-35及Aβ1-42在细胞上造AD模型进行体外研究,该类模型具有与AD患者相似的生物学特性,如原纤维形成,诱导自由基生成,神经毒性等[4]。自噬起到消除异常聚集蛋白和受损细胞器的关键作用,对维持细胞内稳态非常重要[5]。自噬功能会随着年龄增长而减退,导致细胞内毒性蛋白的异常聚集,从而增加AD发生的风险[6]。研究发现,自噬诱导剂能通过激活自噬,减少线粒体ROS 释放,减轻Aβ1-42诱导的PC-12细胞损伤,而自噬抑制剂会加剧Aβ1-42引起的细胞损伤[7,8]。
中药远志具有安神益智的功效,常用于心肾不交导致的失眠多梦、健忘惊悸,神志恍惚等症。细叶远志皂苷是远志的主要活性成分,能够显著抑制Aβ25-35引起的PC12细胞凋亡和小鼠认知功能障碍,并显著改善海马注射Aβ25-35后小鼠的认知缺陷[9]。TEN化学性质稳定,且其在脑脊液中的消除半衰期长[10],这些发现提示了TEN在临床上防治AD的潜力。最近研究发现,远志可通过诱导自噬减少Aβ的分泌起神经保护作用[11]。因此,本研究讨论TEN通过调控细胞自噬,减少人神经母细胞瘤细胞株(SH-SY5Y)细胞Aβ25-35诱导的氧化反应,并探讨TEN抑制Aβ25-35毒性的作用和机制,为TEN防治AD提供基础研究依据。
1 材料与方法
1.1 材料
TEN购自成都普菲德生物技术有限公司,纯度为99.8%;Aβ25-35购自美国Sigma公司;MTT购自广州翔博生物科技有限公司;3-MA购自美国Selleck Chemicals公司;ROS、SOD、过氧化氢酶检测试剂盒购自碧云天生物技术有限公司;MDA、GSH-Px检测试剂盒购自南京建成生物工程研究所;引物由华大基因设计;PrimeScriptTMRT Master Mix(Perfect Real Time)、SYBR®Premix Ex TaqTM(TliRNaseH Plus)购自日本TaKaRa公司;Rabbit anti-β-actin、Goat anti-Rabbit二抗购自北京博奥森生物技术有限公司;Rabbit anti-Beclin-1、Rabbit anti-LC3、Rabbit anti-mTOR、Rabbit anti-AMPK、Rabbit anti-ULK1(Abcam公司)。
1.2 SH-SY5Y细胞培养
SH-SY5Y细胞接种于含10%胎牛血清的DMEM完全培养基中,于37 ℃、5% CO2的细胞培养箱中培养。当细胞密度达到70%~80%时,可进行细胞传代,取对数生长期的细胞进行实验。
1.3 MTT检测细胞活力
SH-SY5Y细胞生长至对数期,以5×103个/孔随机接种于96孔板中,每组5个复孔。分组如下:Control;Aβ25-35(20 μmol/L);TEN(50 μmol/L);3-MA(10 mmol/L);Aβ25-35(20 μmol/L)+ TEN(50 μmol/L);3-MA(10 mmol/L)+ Aβ25-35(20 μmol/L);3-MA(10 mmol/L)+ TEN(50 μmol/L)+ Aβ25-35(20 μmol/L)。先加入TEN或3-MA预处理2 h,再加入Aβ25-35共同处理24 h。每孔加入5 mg/mL 的MTT试剂10 μL,37 ℃孵育4 h后避光吸弃孔内液体,每孔加入DMSO 150 μL,于摇床上低速震摇10 min,充分溶解结晶,用酶标仪在490nm波长处测定A值。实验重复3次,细胞存活率%=(A实验组-A调零组)/(A对照组-A调零组)×100%。
1.4 观察细胞形态
取对数生长期的SH-SY5Y细胞,以3×104个/孔接种于6孔板中。分组如1.3。37 ℃孵育24 h后,倒置显微镜下观察细胞形态并拍照。
1.5 DCFH-DA 荧光探针检测ROS水平
SH-SY5Y细胞生长至对数期,以3×104个/孔接种于6孔板中。分组如下:Control;Aβ25-35(20 μmol/L);Aβ25-35(20 μmol/L)+ TEN (50 μmol/L);3-MA(10 mmol/L)+ TEN (50 μmol/L) + Aβ25-35(20 μmol/L)。先加入TEN和3-MA预处理2 h,再加入Aβ25-35共同处理24 h。收集细胞,将细胞重悬吸至1.5 mL EP管中,每管加入10 μM的DCFH-DA 200 μL,37 ℃孵育30 min。每隔3~5min颠倒混匀一下,使探针和细胞充分接触。用DMEM培养基洗涤细胞3次,充分去除未进入细胞内的DCFH-DA。使用荧光酶标仪对各组细胞荧光值进行检测。实验重复3次。
1.6 试剂盒检测MDA、SOD、GSH-Px和过氧化氢酶(CAT)含量
按1.5培养细胞,收集细胞上清液及裂解液,按说明书进行操作,测定SH-SY5Y细胞内MDA、SOD、GSH-Px和过氧化氢酶含量,实验重复3次。
1.7 RT-qPCR分析
按1.5培养细胞,用Trizol提取细胞总RNA,并用微量紫外/可见分光光度计测OD260/280值及RNA浓度。按照TaKaRa的PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明书进行逆转录反应。将得到的cDNA按TaKaRa的SYBR®Premix Ex TaqTM(TliRNaseH Plus)试剂盒说明书用CFX96Real-Time PCR Detection System进行荧光定量PCR反应。引物序列见表1。
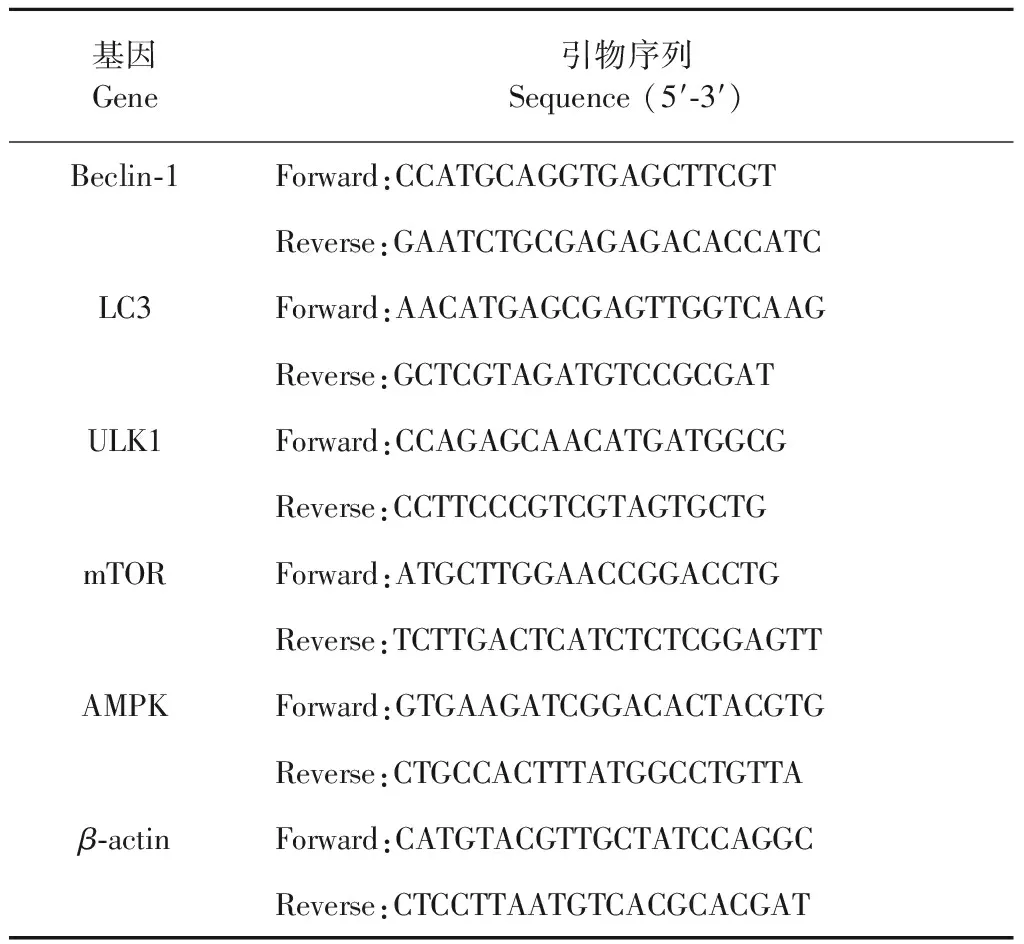
表1 引物序列
1.8 Western blot 分析
按1.5培养细胞,用含有PMSF的RIPA裂解液提取细胞总蛋白,以12 000 g、4 ℃离心5 min,BCA法测定蛋浓度。根据蛋白分子量,配制12%和6%的分离胶及5%的浓缩胶,设置80 V、30 min和120 V、60 min进行SDS-PAGE电泳,设置200 mA、90 min进行湿转,5%脱脂奶粉封闭,一抗4 ℃孵育过夜,二抗室温孵育1 h。TBST洗膜后用ECL 显色液激发化学发光,曝光,β-actin 作为内参。应用Image J 软件对条带进行灰度值比较。
1.9 统计学分析
用统计软件SPSS 21.0进行分析,当P<0.05时有统计学意义。各组间比较采用单因素方差分析(One-way ANOVA),两组间比较采用t检验,实验数据以mean±SD的方式表示,所有实验均重复3次。
2 结果
2.1 TEN对Aβ25-35诱导的细胞活力的影响
如Fig.1所示,MTT结果显示,Aβ25-35组细胞活力显著降低(P<0.01),TEN组细胞活力基本无变化,3-MA组细胞活力下降,但与对照组比无显著性差异,TEN+ Aβ25-35组细胞活力显著高于Aβ25-35组,含有3-MA的实验组细胞活力都显著下降(P<0.05)。结果表明,TEN对Aβ25-35诱导的SH-SY5Y细胞活力损伤具有保护作用,其作用可被3-MA抑制。
2.2 TEN对Aβ25-35诱导的细胞形态的影响
如Fig.2 所示,Control组细胞密度大,贴壁能力强,生长状态好(图2A),Aβ25-35组细胞数量明显减少,贴壁性变差,折光性减弱,形态变差(图2B)。TEN组细胞生长状态好(图2C),3-MA组细胞胞体出现明显皱缩,胞体边缘模糊(图2D),Aβ25-35+TEN组细胞折光性变强,细胞状态良好(图2E),Aβ25-35+3-MA组细胞出现明显聚集状态,折光性变差(图2F),TEN+3-MA+Aβ25-35组,细胞数比TEN+Aβ25-35组少,但细胞生长状态基本正常(图2G)。结果表明,TEN能改善Aβ25-35诱导的SH-SY5Y细胞形态损伤,其作用可被3-MA抑制。
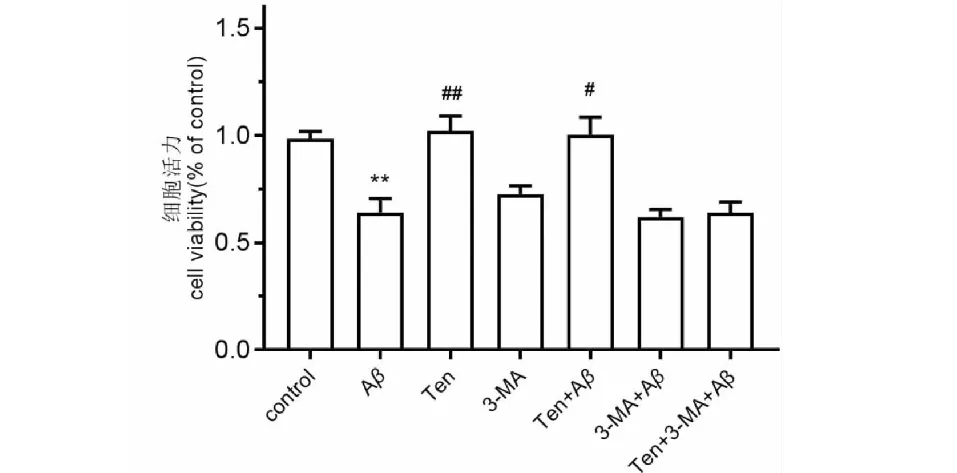
图1 Aβ25-35和TEN对SH-SY5Y细胞活力的影响Fig.1 The effects of Aβ25-35 and TEN on the viability of the SH-SY5Y cells注:与正常组相比,**P<0.01;与Aβ25-35组比较,## P < 0.01,#P< 0.05。Notes:**P<0.01 vs control;#P< 0.05 vs Aβ25-35 ;##P<0.01 vs Aβ25-35.
2.3 TEN对Aβ25-35诱导的氧化应激的影响
如Fig.3所示,Aβ25-35组SH-SY5Y细胞的ROS、MDA水平显著增加(P<0.05,P<0.01),而SOD、GSH-Px和过氧化氢酶的活性显著降低(P<0.05,P<0.01);与Aβ25-35组相比,TEN能显著减少ROS、MDA的产生而增加GSH-Px和CAT酶的活性(P<0.05,P<0.01),同时3-MA会拮抗TEN的作用。结果表明,TEN显著提高Aβ25-35诱导的SH-SY5Y细胞氧化应激水平,其作用部分可被3-MA拮抗。
2.4 TEN对自噬标志蛋白Beclin-1和LC3表达水平的影响
如Fig.4A RT-PCR结果显示,Aβ25-35显著增加Beclin-1(P<0.01)和LC3(P<0.05)的mRNA水平,与Aβ25-35组相比,TEN进一步增加了Beclin-1和LC3 mRNA的表达(P<0.05),而3-MA减少TEN诱导的Beclin-1和LC3 mRNA的表达。Fig.4BC Western blot结果显示,Aβ25-35显著增加了Beclin-1 蛋白表达水平(P<0.01),但对LC3-II/I 蛋白表达水平影响没有显著性差异,与Aβ25-35组相比,TEN进一步增加了Beclin-1和LC3-II/I 蛋白表达水平(P<0.01),而3-MA减少TEN诱导的Beclin-1和LC3-II/I 蛋白表达。以上结果表明Aβ25-35诱导增加SH-SY5Y细胞内自噬的发生,而TEN作用进一步增加自噬的发生。
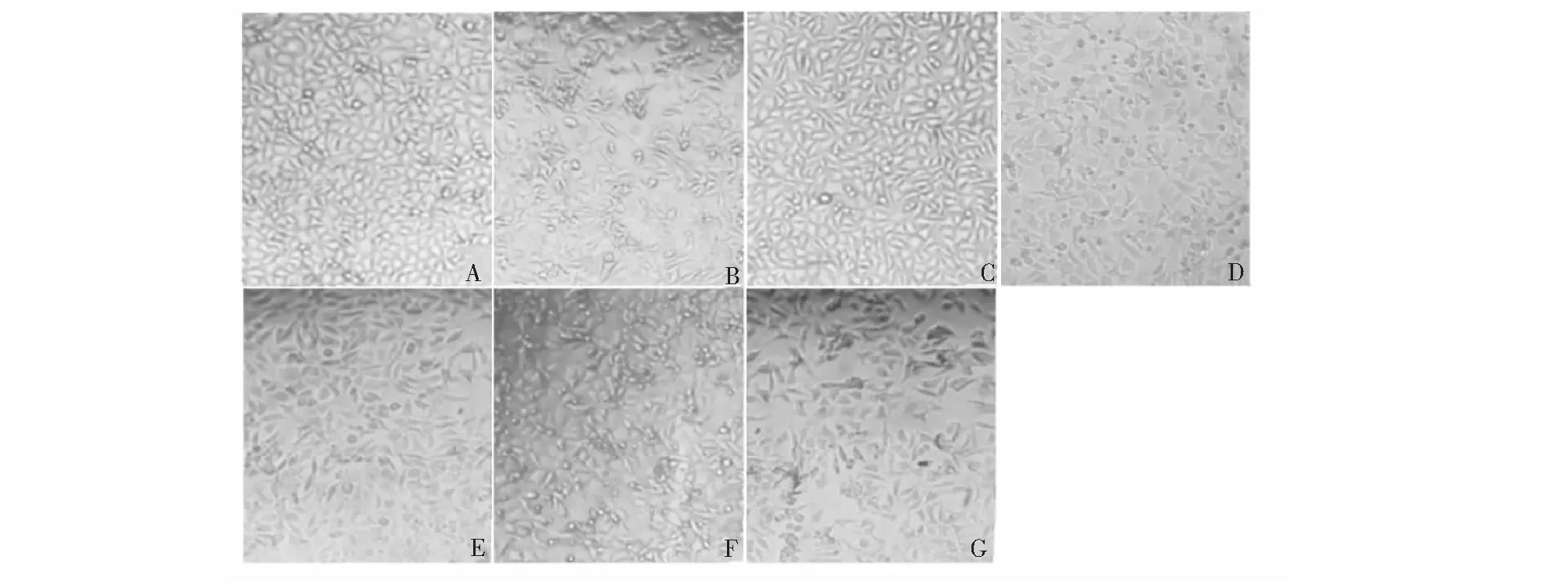
图2 Aβ25-35和TEN对SH-SY5Y细胞的形态学的影响(×200)Fig.2 Morphological changes of SH- SY5Y cells by Aβ25-35 and TEN treatment (×200)

图3 TEN对Aβ25-35诱导的氧化应激的影响Fig.3 The effects of TEN on the oxidative stress induced by Aβ25-35注:与正常组相比,**P<0.01,*P<0.05;与Aβ25-35组比较,## P < 0.01,#P< 0.05。Notes:*P <0.05 vs control;**P <0.01 vs control;#P< 0.05 vs Aβ25-35;## P <0.01 vs Aβ25-35.
2.5 TEN对SH-SY5Y细胞中的mTOR、AMPK和ULK1表达水平的影响
如Fig 5.A RT-PCR结果显示,Aβ25-35显著增加了mTOR mRNA表达水平(P<0.01),并显著降低了AMPK和ULK1 mRNA水平(P<0.01),与Aβ25-35组相比,TEN显著降低了mTOR mRNA表达水平(P<0.01),并显著升高了AMPK和ULK1 mRNA水平(P<0.01),而3-MA增加TEN诱导的mTOR和ULK1 mRNA的表达,减少TEN诱导的AMPK mRNA的表达。图5.BC Western blot结果显示,Aβ25-35显著增加了mTOR蛋白表达水平(P<0.01),并显著降低了AMPK和ULK1蛋白表达水平(P<0.01),与Aβ25-35组相比,TEN显著降低了mTOR蛋白表达水平(P<0.01),并显著升高了AMPK和ULK1蛋白表达水平(P<0.01),而3-MA增加TEN诱导的mTOR和ULK1 蛋白表达,减少TEN诱导的AMPK mRNA的蛋白表达。结果表明,TEN可能通过调控AMPK/mTOR/ULK1通路激活细胞自噬,起到神经保护作用。
3 结论
AD 是常见的神经退行性疾病,其病理特征主要包括脑内Aβ异常沉积,Tau蛋白过度磷酸化所致神经元纤维缠结,神经元死亡等[1]。Aβ25-35是Aβ的毒性片段,可导致神经元纤维形成,诱导自由基生成,产生神经毒性等[12],广泛用于AD动物模型和细胞模型的建立。远志是中草药中记载的药用植物,长期用于治疗记忆丧失和改善认知功能[13]。TEN是一种提取自远志的活性成分,其极易进入大脑并显著改善老年小鼠的记忆和学习能力[9,10],此外,TEN被证明可以保护PC12细胞免受Aβ25-35诱导的细胞凋亡[9]。通过建立Aβ25-35诱导的细胞模型,我们发现TEN可以改善Aβ25-35诱导的SH-SY5Y细胞形态变异和活力下降,而自噬抑制剂3-甲基腺嘌呤(3-Methyladenine,3-MA)能拮抗TEN的作用。
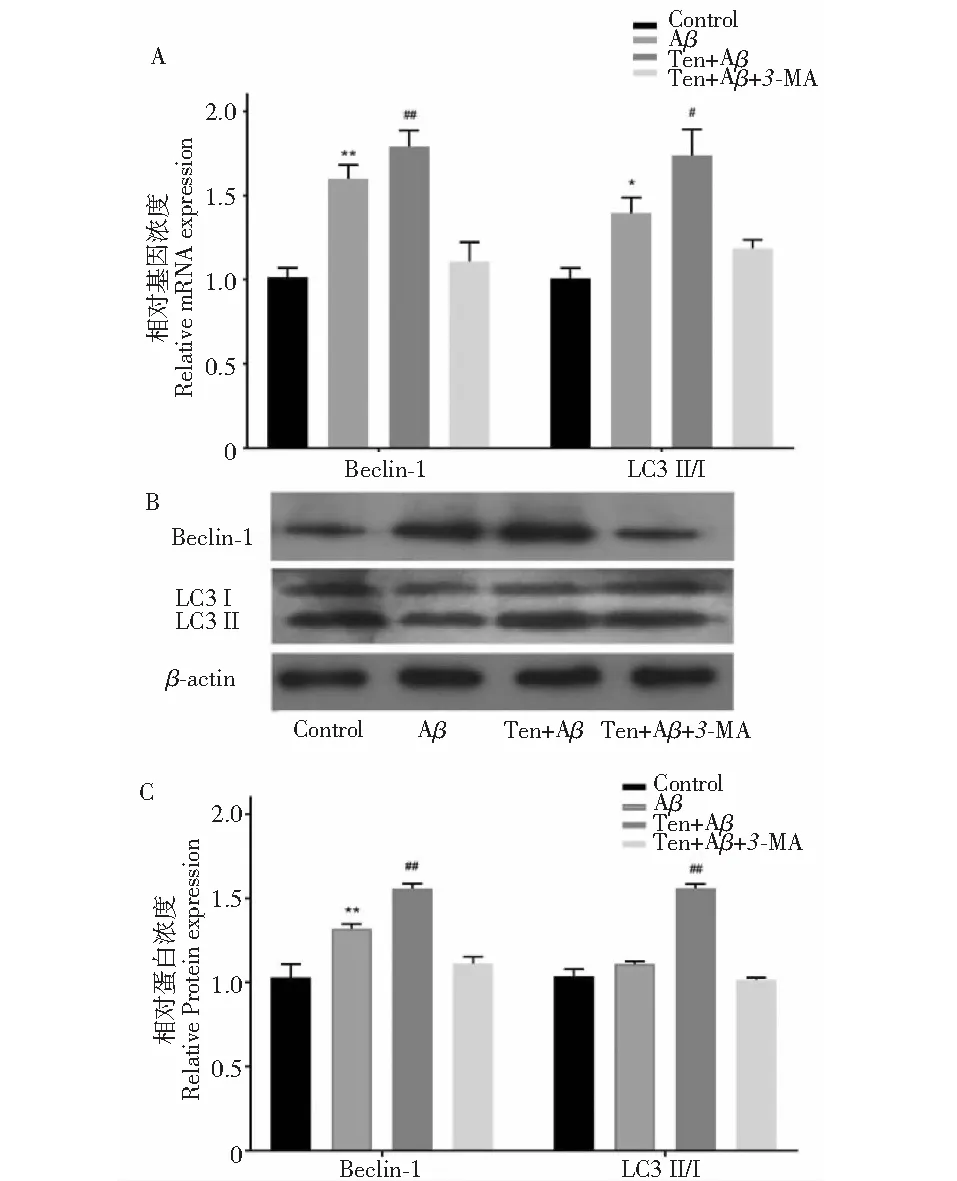
图4 TEN对Aβ25-35诱导的SY5Y细胞中LC3-Ⅱ和Beclin-1表达的影响 RT-PCR(A),Western blot(B)和定量分析(C)Fig.4 Effects of TEN on expression of LC3-Ⅱ and Beclin-1 in SY5Y cells induced by Aβ25-35 detected by RT-PCR(A),Western blot(B) and confocal microscope(C)注:与正常组相比,**P<0.01,*P<0.05;与Aβ25-35组比较,## P < 0.01,#P< 0.05。Notes:*P <0.05 vs control;**P <0.01 vs control;#P< 0.05 vs Aβ25-35;## P <0.01 vs Aβ25-35.
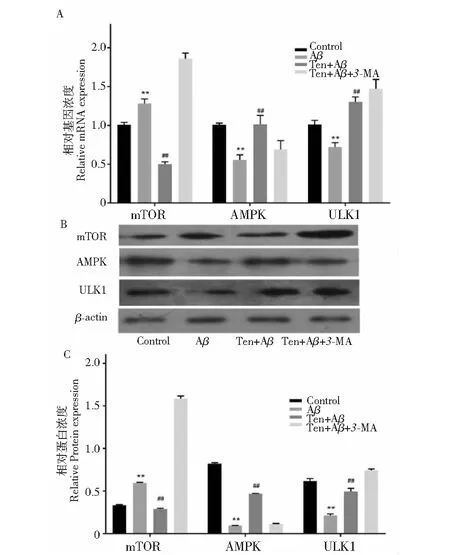
图5 TEN对Aβ25-35诱导的SH-SY5Y细胞中mTOR,AMPK和ULK1表达的影响 RT-PCR(A),Western blot(B)和定量分析(C)Fig.5 Effects of TEN co-treatment on expression of mTOR,AMPK and ULK1 in SY5Y cells induced by Aβ25-35detected by RT-PCR(A),Western blot(B)and confocal microscope(C)注:与正常组相比,**P<0.01,*P<0.05;与Aβ25-35组比较,## P < 0.01,#P< 0.05。Notes:*P <0.05 vs control;**P <0.01 vs control; #P< 0.05 vs Aβ25-35;## P <0.01 vs Aβ25-35.
氧化还原平衡是细胞生存的必要条件[14]。Aβ在脑内沉积能引起氧化应激,而氧化应激也能反过来促进Aβ在脑内的聚集,导致DNA受损、线粒体功能紊乱、膜稳定性降低和细胞凋亡等神经毒性,进一步加快AD发展[15]。Song Y 等[8]发现雷帕霉素通过上调自噬,增强PC12细胞对损伤线粒体的清除能力,继而减少了H2O2诱导的ROS释放,降低细胞死亡率。相反,3-MA下调自噬,抑制线粒体自噬过程,导致损伤线粒体在细胞中累积,并释放大量ROS进入细胞质导致细胞死亡,提示激活自噬能拮抗氧化应激损伤。张晶等[16]发现远志皂苷元能减少H2O2模型鼠海马神经元的MDA含量,升高SOD活性,从而提高海马神经元的抗氧化能力。本研究结果表明,TEN能减轻Aβ25-35对SH-SY5Y细胞的氧化应激作用,其作用可被而3-MA逆转。
细胞通过自噬-溶酶体降解机制,对异常蛋白质和受损细胞器进行分解,维持细胞内稳态,增强细胞的活力[17]。Beclin-1是调节自噬体起始物质组装的分子平台,其激活可以上调自噬。有研究表明,Beclin-1基因敲除的小鼠会因缺乏自噬活性而导致神经退行病变[18]。此外,当自噬发生时,LC3-I 会脂化为LC3-II定位于自噬体上,因此LC3-II/I常作为自噬的标志性蛋白来检测自噬水平。研究发现,远志能通过mTOR/AMPK通路加速异常蛋白的清除以及减少APP/BACE1细胞中Aβ的产生[19]。哺乳动物雷帕霉素靶酶(mammalian target of rapamycin,mTOR) 是一种蛋白激酶,是自噬的负调控因子,对维持神经细胞正常功能起重要作用。腺苷酸活化蛋白激酶(adenosine 5′-monophosphate AMP-activated protein kinase,AMPK) 可在细胞内缺乏能量时被激活,被活化的AMPK 会抑制 mTOR,从而促进自噬体形成。ULK1是Atg1的同源物,激活mTOR能够抑制ULK1活性而抑制自噬,而AMPK能诱导ULK1的磷酸化而激活自噬[19]。本研究结果显示,TEN增加Aβ25-35诱导的细胞内Beclin-1和LC3-II/I水平,其激活细胞自噬的过程可能与mTOR/AMPK/ULK1信号通路有关。
总之,我们的研究结果表明TEN可通过调控mTOR/AMPK/ULK1通路增强细胞自噬,降低Aβ25-35诱导的SH-SY5Y细胞氧化应激损伤,增强细胞活力和改善细胞形态,发挥抑制毒性的神经保护作用。调节细胞自噬是治疗AD的潜在策略之一,而TEN 可能是一种涉及到多机制的药物,其调控细胞自噬机制还需进一步的研究。
