链霉菌Streptomyces sp.KIB-H1424中的一个新的烷基间苯二酚类化合物
2019-10-11张周鑫侯冠雄马亚团黄建萍罗剑英颜一军黄胜雄
张周鑫,侯冠雄,马亚团,黄建萍,罗剑英,杨 静,颜一军,黄胜雄*
1云南大学化学科学与工程学院,昆明 650091;2中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明650201;3云南中医学院中药学院,昆明650500
放线菌(Actinomycetes)是广泛存在于各种自然生境中的一类微生物,种类繁多,代谢特征各异[1]。在迄今为止发现的近万种天然抗生素中,约70%是放线菌合成的。链霉菌是放线菌门中种类最多的一个属,广泛分布于土壤、海洋、极端环境以及一些生物体内[2]。链霉菌合成的抗生素数量更是占到了天然抗生素总量的52%[3-6]。烷基间苯二酚是一类从植物、海洋生物以及微生物中分离到的具有良好生物活性的天然产物[7-10],具有DNA解旋[8]、糖蛋白抑制[7]和甘油-3-磷酸脱氢酶抑制等活性[9]。此外,有些烷基间苯二酚还具有一定的抗真菌[11]、细菌[12]及细胞毒性[13]。在从微生物中寻找新的活性次生代谢产物的过程中[14,15],我们对一株链霉菌Streptomycessp.KIB-H1424发酵液的化学成分进行了研究,得到6个烷基间苯二酚类化合物(化合物1~6)。本文详细介绍了6个化合物的分离纯化、结构鉴定和生物活性。
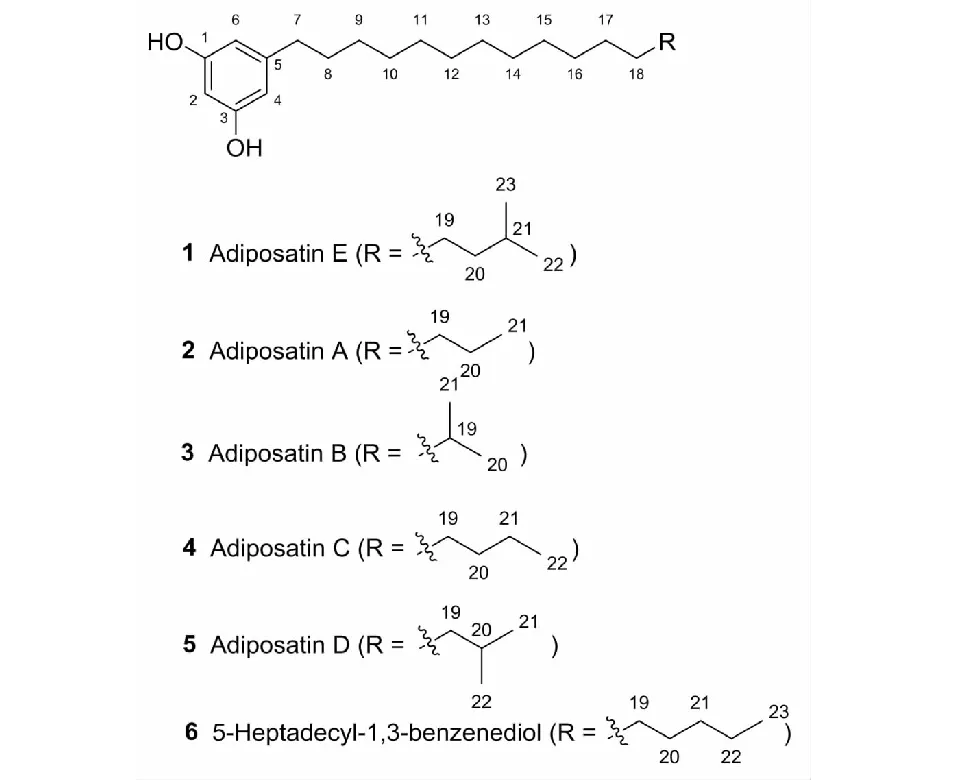
图1 化合物1~6的化学结构Fig.1 Chemical structures of compounds 1-6
1 材料与方法
1.1 仪器与材料
Bruker DRX-500、Avance III-400 核磁共振仪(TMS作为内标,δ为ppm),Waters Xevo TQ-S超高压液相三重四级杆联用质谱仪;ZQZY-HC恒温摇床(上海知楚仪器),日本三菱化学MCI GEL CHP 20P填料(70~150 μm),Sephadex LH-20(瑞典AIRTECH生物化学试剂公司生产),Hitachi Chromaster 5430 高效液相色谱仪器(日立),YMC-Triart C18型液相色谱柱(250×10 mm I.D.),中速滤纸(杭州新华纸业有限公司),YXQ-LS-18SI 高压蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂)。其他试剂为国产分析纯试剂(天津市大茂化学试剂厂,广东环凯微生物科技有限公司)。
1.2 发酵菌株
发酵菌株KIB-H1424分离自云南省玉溪市元江县采集的虾子花(Woodfordiafruticosa(L.)Kurz.)根部土壤样本。菌株经过16S rRNA基因测序分析,将测序结果与GenBank数据库中相关菌株进行同源性比对,发现其与Streptomycestumescensstrain OTP-4-2的基因序列的相似度达到99.0%。同时结合其形态学与培养特征,确定其为链霉菌属,命名为Streptomycessp.KIB-H1424。活性测试菌株金黄色葡萄球菌(StaphylococcusaureusATCC 6538)、枯草芽孢杆菌(BacillussubtilisATCC 6633)、斜卧青霉(PenicilliumdecumbensATCC 10436)购买自ATCC菌种库,小麦赤霉病菌(Fusariumgraminearum)、白色念珠菌(Moniliaalbican)、棉花枯萎病菌(Fusariumoxysporumf.sp.Vasinfectum)由西北农林科技大学马亚团提供。目前发酵与活性测试菌株均保存在中国科学院昆明植物研究所植物化学与西部植物资源可持续利用国家重点实验室。
1.3 培养基与培养条件
固体培养基:MS培养基,配方为大豆粉20.0 g/L(煮沸后过滤取滤液),甘露醇20.0 g/L,琼脂粉20.0 g/L,pH=7.0。
种子液培养基:TSB培养基,配方为胰蛋白胨17.0 g/L,大豆蛋白胨3.0 g/L,氯化钠5.0 g/L,磷酸氢二钾2.5 g/L,右旋葡萄糖2.5 g/L,pH=7.3 ± 0.2。
PDA培养基:200.0 g去皮土豆切碎后加入1.0 L自来水,煮沸30 min,四层纱布过滤后,滤液加入琼脂粉20.0 g,右旋葡萄糖20.0 g,定容1.0 L,自然pH。
LB培养基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠 10.0 g/L,琼脂粉20.0 g/L,pH=7.4。
发酵培养基:M15培养基,配方为右旋葡萄糖30.0 g/L,胰蛋白胨1.0 g/L,牛肉膏5.0 g/L,氯化钠l5.0 g/L,碳酸钙2.5 g/L,微量盐1.0 mL(微量盐配方:七水合硫酸亚铁1.0 g,五水硫酸铜0.45 g,七水合硫酸锌1.0 g,四水硫酸锰0.1 g,钼酸钾0.1 g溶于1.0 L蒸馏水中,加盐酸使溶液澄清),pH=7.2。
将MS平板上活化好的菌株接种至装有50 mL种子液的250 mL三角摇瓶中,置于摇床中,28 ℃、200 rpm培养2天。将种子液按5%接种量转接到装有250 mL发酵培养基的1 L三角摇瓶中,置于摇床中,在28 ℃、200 rpm条件下培养7天。
1.4 提取分离
发酵液以4 000 rpm 的转速离心20 min。上清液与菌丝体分别用等体积乙酸乙酯萃取3遍。经HPLC分析后,合并上清与菌丝体乙酸乙酯萃取物共4.0 g。粗提物经MCI依次用甲醇-水(10∶90- 100∶0)梯度洗脱,得到Fr1~Fr9共九个组分。Fr7组分经Sephadex LH-20(甲醇洗脱),TLC分析后合并,得到Fr7A~Fr7D四个组分。Fr7D组分经HPLC分离,以80%乙腈等度洗脱得到六个化合物分别是2(tR=16.8 min,11.7 mg),3(tR=18.2 min,15.0 mg),4(tR=19.2 min,12.9 mg),1(tR=21.1 min,8.7 mg),5(tR=22.0 min,9.4 mg),6(tR=23.0 min,12.3 mg)。
1.5 活性测试(滤纸片法)
将保存在20%甘油中的指示菌株金黄色葡萄球菌(StaphylococcusaureusATCC 6538)、枯草芽孢杆菌(BacillussubtilisATCC 6633)、小麦赤霉病菌(Fusariumgraminearum)、斜卧青霉(PenicilliumdecumbensATCC 10436)、白色念珠菌(Moniliaalbican)、棉花枯萎病菌(Fusariumoxysporumf.sp.Vasinfectum)分别接种至PDA与LB培养基上活化培养,分别以28 ℃与37 ℃避光培养4天,待其菌落基本长满培养基待用。将被测化合物和多菌灵均配置成浓度2.0 mg/mL的丙酮溶液备用。将活化好的指示菌株分别加入到约40 ℃的PDA与LB培养基中(300 mL培养基中加入一个培养皿的菌体)并倒入培养皿中(每个培养皿倒入约25 mL培养基),待琼脂凝固后,十字线标记。在无菌滤纸片(直径5 mm)中心滴加5 μL待测化合物的丙酮溶液,待丙酮挥发后将其放置到培养基上。每块培养基平板均以丙酮作阴性对照,分别以卡那霉素(2.0 mg/mL)、放线菌酮(2.0 mg/mL)与制霉菌素(2.0 mg/mL)作阳性对照。最后,真菌在28 ℃,细菌在37 ℃培养箱中培养24~48 h后观察抑菌圈大小,用十字交叉法测量抑菌圈直径。
2 结果与分析
2.1 化合物结构鉴定
化合物1白色粉末;UV (MeOH)λmax (logε) 203 (2.5),219 (2.0),277 (1.3).IR (KBr)νmax3 355,3 063,2 954,2 920,2 869,2 850,1 598,1 469,1 156 cm-1;。HR-ESI-MS (negative)图谱给出m/z347.2954[M-H]-(calcd for 347.2956),结合13C-NMR确定分子式为C23H40O2。13C-NMR中整个谱图明显的分成低场和高场两部分。高场部分δC30.7存在大量重叠的碳信号并且氢谱在δH1.29也存在大量重叠的信号,推测有脂肪链的存在。低场部分碳谱信号δC100.9,107.9,146.3,159.3结合氢谱信号δH6.08 (1H,t,J=2.2 Hz),6.12 (2H,d,J=2.2 Hz)(见表1)推测可能存在1,3,5取代的间苯二酚结构单元。结合HMBC谱中δH6.08的氢与δC159.3,107.9存在HMBC的相关,同时δH6.12也存在与δC159.3,107.9,100.9,37.0的HMBC相关信号,进一步确定了间苯二酚结构单元的存在,并且间苯二酚单元在5位上与δC37.0相连(见图2)。结合δH1.22~1.37 (22H,m),1.55 (2H,m)与2.43 (2H,t,J=7.6 Hz)的1H-1H COSY相关确定脂肪链的一端通过δC37.0与间苯二酚相连。与此同时δH1.53 (1H,m),1.17 (2H,m)与0.88 (6H,d,J=6.6 Hz)的1H-1H COSY相关揭示了脂肪链的另一端为异丙基单元。综上,确定化合物1的结构如图所示(见图1)。化合物1的核磁及其它相关详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
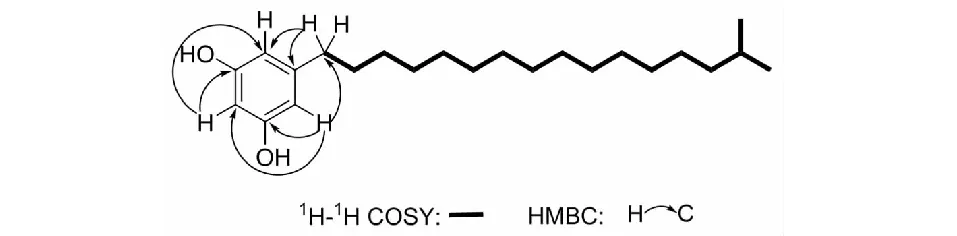
图2 化合物1 的关键COSY和HMBC相关信号Fig.2 The Key COSY and HMBC correlations of compound 1

原子编号PositionAdipostatin E (1)δCδH(mult,J in Hz)1,3159.3-2100.96.08 (1H,t,J=2.2 Hz)4,6107.96.12 (2H,d,J=2.2 Hz)5146.3-737.02.43 (2H,t, J = 7.6 Hz)832.41.55 (2H,m)930.61.22~1.371030.7~30.81.22~1.371130.7~30.81.22~1.371230.7~30.81.22~1.371330.7~30.81.22~1.371430.7~30.81.22~1.371530.7~30.81.22~1.371630.7~30.81.22~1.371731.01.22~1.371830.31.22~1.371928.51.22~1.372040.31.17 (2H,m)2129.21.53 (1H,m)22,2323.00.88 (6H,d,J=6.6 Hz)Data were measured in methanol-d4
化合物2白色粉末;分子式C21H36O2;ESI-MS:m/z319[M - H]-;1H NMR (CD3OD,400 MHz)δ:6.12 (2H,d,J=2.2 Hz,H-4,H-6),6.08 (1H,t,J=2.2 Hz,H-2),2.43 (2H,t,J=7.6 Hz,H-7),1.56 (2H,m,H-8),1.37~1.22 (24H,m,H-9~H-20),0.90 (3H,t,J=6.7 Hz,H-21);13C NMR (CD3OD,100 MHz)δ:159.3 (C-1,C-3),146.3 (C-5),107.9 (C-4,C-6),100.9(C-2),37.0 (C-7),33.1 (C-19),32.4 (C-8),30.8~30.3 (C-9~C-18),23.7 (C-20),14.5 (C-21)。以上数据与文献[16]报道一致,故鉴定为Adipostatin A。
化合物3白色粉末;分子式C21H36O2;ESI-MS:m/z319[M- H]-;1H NMR (CD3OD,400 MHz)δ:6.12 (2H,d,J=2.2 Hz,H-4,H-6),6.08 (1H,t,J=2.2 Hz,H-2),2.43 (2H,t,J=7.6 Hz,H-7),1.56 (2H,m,H-8),1.37~1.22 (18H,m,H-9~H-17),0.90 (6H,t,J=6.6 Hz,H-20,H-21);13C NMR (CD3OD,100 MHz)δ:159.3 (C-1,C-3),146.3 (C-5),107.9 (C-4,C-6),100.9 (C-2),40.2 (C-18),37.0 (C-7),32.4 (C-8),30.8~30.4 (C-9~C-16),29.1 (C-19),28.5 (C-17),23.0 (C-20,C-21)。以上数据与文献[16]报道一致,故鉴定为Adipostatin B。
化合物4白色粉末;分子式C22H38O2;ESI-MS:m/z333[M- H]-;1H NMR (CD3OD,400 MHz)δ:6.12 (2H,d,J=2.2 Hz,H-4,H-6),6.08 (1H,t,J=2.2 Hz,H-2),2.43 (2H,t,J=7.6 Hz,H-7),1.56 (2H,m,H-8),1.37~1.22 (26H,m,H-9~H-21),0.90 (3H,t,J=6.7 Hz,H-22);13C NMR (CD3OD,100 MHz)δ:159.3 (C-1,C-3),146.3 (C-5),107.9 (C-4,C-6),100.9 (C-2),37.0 (C-7),33.1 (C-20),32.4 (C-8),30.8~30.4 (C-9~C-19),23.7 (C-21),14.5 (C-22)。以上数据与文献[16]报道一致,故鉴定为Adipostatin C。
化合物5白色粉末;分子式C22H38O2;ESI-MS:m/z333[M- H]-;1H NMR (CD3OD,400 MHz)δ:6.12 (2H,d,J=2.2 Hz,H-4,H-6),6.08 (1H,t,J=2.2 Hz,H-2),2.43 (2H,t,J=7.6 Hz,H-7),1.55 (2H,m,H-8),1.52 (1H,m,H-20),1.37~1.22 (20H,m,H-9~H-18),1.15 (2H,m,H-19),0.86 (6H,m,H-21,H-22);13C NMR (CD3OD,100 MHz)δ:159.3 (C-1,C-3),146.3 (C-5),107.9 (C-4,C-6),100.9 (C-2),40.3 (C-19),37.0 (C-7),32.4 (C-8),31.0 (C-9),30.8~30.7 (C-10~C-15),30.6 (C-16),30.3 (C-17),29.2 (C-20),28.5 (C-18),23.0 (C-21,C-22)。以上数据与文献[16]报道一致,故鉴定为Adipostatin D。
化合物6白色粉末;分子式C23H40O2;ESI-MS:m/z347[M- H]-;1H NMR (CD3OD,400 MHz)δ:6.12 (2H,d,J=2.2 Hz,H-4,H-6),6.08 (1H,t,J=2.2 Hz,H-2),2.43 (2H,t,J=7.6 Hz,H-7),1.56 (2H,m,H-8),1.37~1.22 (28H,m,H-9~H-22),0.89 (3H,t,J=6.7 Hz,H-23);13C NMR (CD3OD,100 MHz)δ:159.3 (C-1,C-3),146.3 (C-5),107.9 (C-4,C-6),100.9 (C-2),37.0 (C-7),33.1 (C-21),32.5 (C-8),30.8~30.4 (C-9~C-20),23.7 (C-22),14.5 (C-23)。以上数据与文献[17]报道一致,故鉴定为5-Heptadecyl-1,3-benzenediol。
2.2 化合物抑菌活性实验
以6株指示菌金黄色葡萄球菌(StaphylococcusaureusATCC 6538)、枯草芽孢杆菌(BacillussubtilisATCC 6633)、小麦赤霉病菌(Fusariumgraminearum)、斜卧青霉(PenicilliumdecumbensATCC 10436)、白色念珠菌(Moniliaalbican)、棉花枯萎病菌(Fusariumoxysporumf.sp.Vasinfectum)为指示菌株检测6个化合物的抗菌活性。结果显示6个化合物对所选的6株指示菌均无明显抑制活性。
3 讨论
本研究从链霉菌Streptomycessp.KIB-H1424 的发酵液中分离得到了6个间苯二酚类化合物——1个新的烷基间苯二酚类化合物1和5个已知的化合物(化合物2~6)。化合物2和3第一次被发现是作为甘油-3-磷酸脱氢酶抑制剂在链霉菌S.cyaneus2299-SV1中被分离得到[9]。后来,Mostafa等[16]对化合物2~5的研究又发现了其对成年马来丝虫(Brugiamalayi)的杀灭活性。本研究中的6个间苯二酚化合物对所选的6株指示菌虽没有明显的抗菌活性,但丰富了间苯二酚类化合物的种类,为链霉菌来源化合物的药物开发利用提供了一定的化学基础,为医药及天然产物开发提供了理论和物质基础。
