利用SSR构建甜菜品种的分子身份证
2019-10-11栗媛王茂芊邳植吴则东
栗媛 ,王茂芊 ,邳植 ,吴则东
(1.黑龙江大学生命科学学院,哈尔滨150080;2.中国农业科学院甜菜研究所/黑龙江大学农作物研究院,哈尔滨150080;3.黑龙江省甜菜工程技术研究中心,哈尔滨150080)
0 引言
糖用甜菜(Beta vulgarisL.)属于藜科、甜菜属、二年生草本植物[1]。栽培甜菜分为糖用甜菜、饲用甜菜、叶用甜菜和食用甜菜。我国糖用甜菜主要分布在黑龙江、新疆、内蒙古等地,是除了甘蔗之外的另一个主要糖来源,也是我国北方一种重要的经济作物[1]。近年来,甜菜分子生物学发展迅速,目前已经有多种分子标记技术在甜菜分子生物学中得到了应用,包括:SSR[2-3]、ISSR[4]、SRAP[5]以及RAPD[6]等。其中,由于SSR分子标记技术操作简单并且所得产物具有共显性、重复性好等特点[10],因此在作物遗传多样性以及品种的鉴定研究中得到广泛应用,例如:水稻[7]、小麦[8]、玉米[9]、烟草[10]、甘薯[11]以及甘蔗[12]等,均利用SSR分子标记技术构建了相应的分子身份证,并建立了标准。
对于甜菜来说,2017年国家对甜菜品种实行登记制度,然而目前鉴别品种纯度和真实性的方法主要是形态学鉴定法,形态学鉴定的方法一般需要整个生长周期,不仅鉴别时间长,还有时效性的问题,而且对于亲缘关系较近的品种难以鉴别,这样甜菜种植者一旦买到假冒伪劣的种子,将会极大地影响他们当年的收入以及育种公司的利益。而分子标记技术可以实现对近似品种的鉴别,并且不受生育期的限制,随时提取DNA即可鉴别。因此新登记的品种亟需利用分子标记技术构建指纹图谱,而利用SSR分子标记技术构建甜菜品种的指纹图谱是目前比较好的一个选择。本试验利用SSR引物对2018年农业农村部全国农业技术推广服务中心提供的39份甜菜登记品种进行分子身份证的构建,为将来利用SSR分子标记技术鉴定甜菜品种的纯度和真实性提供技术依据。
1 材料与方法
1.1 试验材料
1.1.1 供试品种
实验用到的39份甜菜品种均来自于农业农村部全国农业技术推广服务中心,品种名称及其编号见表1。
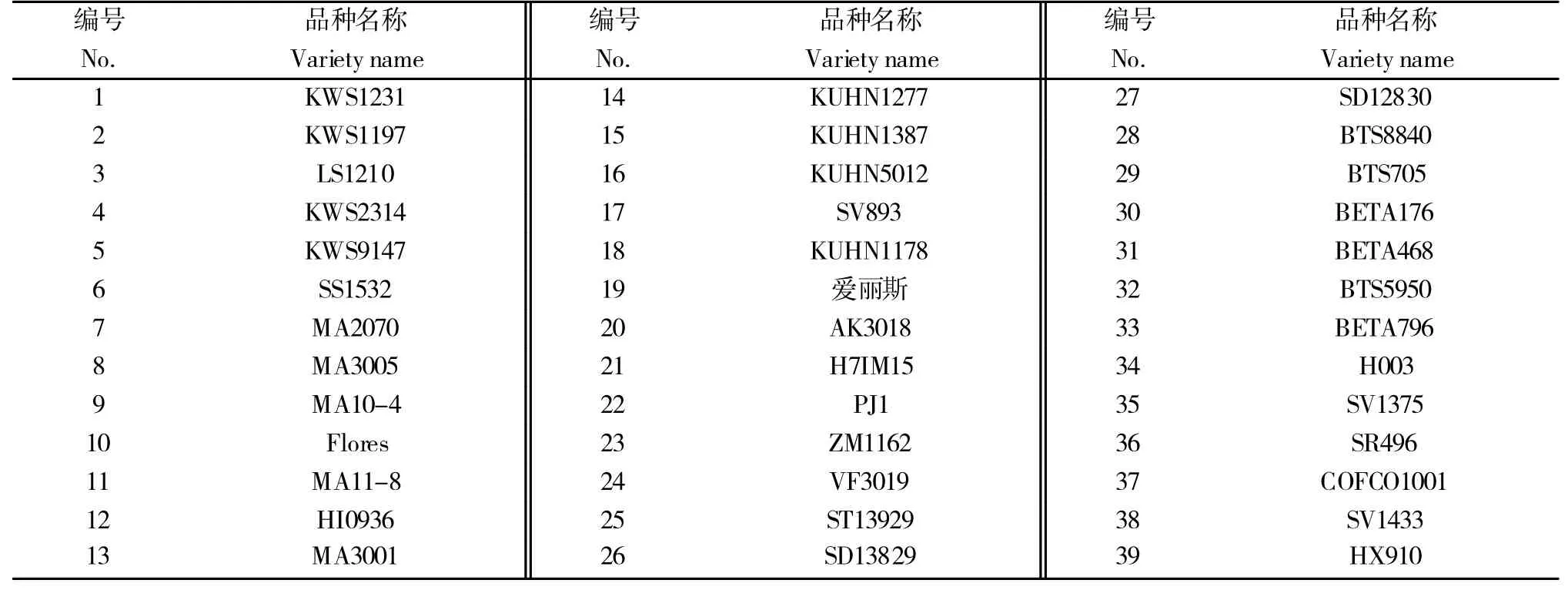
表1 供试甜菜品种编号及名称Table 1 Number andname of sugar beet varieties for trial
1.1.2 引物
实验中用到的 17 对核心引物,分别为 BVGTT6、BVV45、BVV21、BVV23、C74、LNX38、LNX95、SB06、SB13、SB15、SSD6、TC55、TC58、TC83、TC122、TC123和TC129。
1.2 实验方法
1.2.1 甜菜DNA的提取
本实验中用到的甜菜品种是在光照培养室进行培养,播种时每个品种取15粒,待其长出4片真叶时,从每个品种里挑选10株新鲜健康的幼苗,然后利用改进过的CTAB法[13]提取甜菜基因组DNA。最后每个离心管加入100µL TE缓冲液溶解DNA,利用核酸蛋白测定仪最终得到DNA原液并取部分稀释至10 ng/µL,剩下的母液放到-20℃的冰箱中保存。
1.2.2 甜菜SSR-PCR扩增反应体系及程序
甜菜SSR-PCR的反应体系来自于文献[14],反应程序采用Touchdown程序,退火温度由65℃到56℃,1℃两个循环,最后55℃20个循环。
1.2.3 电泳及银染
利用8%的非变性聚丙烯酰胺凝胶电泳对PCR扩增产物进行分离,每个孔加入PCR产物2µL,电压180 V,时间为90 min。电泳结束后,使用快速银染法对其染色[15],最后拍照记录。

图1引物TC129对39个甜菜品种的扩增结果Fig.1 Amplification results of 39 sugar beet varieties by primer TC129
2 结果及分析
2.1 39个甜菜品种指纹图谱的构建
把这17对引物作为核心引物,对已提取出的39份甜菜品种的基因组DNA进行扩增,便成功构建出39个甜菜品种的SSR指纹图谱。通过对SSR-PCR扩增产物的检测,在同一迁移率位置,有带记为1,无带记为0,利用0、1数据构建甜菜品种的指纹图谱。图1为引物TC129对39个甜菜品种的扩增条带。利用5对引物LNX38、LNX95、SSD6、SB06、SB13,便可完全鉴别出39个甜菜品种(0、1数据略)。
2.2 聚类分析
利用17对SSR引物所扩增的条带,依据0、1数据,按照UPGMA进行聚类分析,得到了39份甜菜品种的遗传关系树状图,亲缘关系树状图在分子水平上显示了甜菜品种间的亲缘关系,可以为今后甜菜育种亲本的选配提供理论依据。聚类图见图2。
在遗传距离0.17的位置,39份甜菜品种被分成5个类群,包括了4个较大的类群和1个小类群,聚类的结果与品种的来源有较好的一致性,也就是一般说来来源于同一种子公司或者同一地区的品种聚在了一起。如BETA176和BETA468聚在了一起,这两个品种均为美国Betaseed公司的品种;KUHN1178和SV1375聚在了一起,这两个品种均为荷兰的品种;HI0936和MA3001聚在了一起,这两个品种同属于瑞典的HilleshögMaribo公司。这种现象说明一定程度上,目前生产方面同一公司反复使用同一不育系或授粉系配制品种,从而才造成了遗传基础狭窄这一事实。因为甜菜的遗传基础本来就比较狭窄,未来甜菜育种工作只有加强国内外的合作才有可能组配、选育出更加优良的甜菜品种。

图2 39个甜菜品种的聚类图Fig.2 Clustergram of 39 sugar beet varieties
3 讨论
目前,虽然有多篇文献记载关于甜菜指纹图谱的构建,但构建标准却各不相同,例如:甜菜基因组DNA的提取[16]、PCR反应程序[17]、SSR扩增产物不同的检测方法[18]等。这些因素均会对我们的实验结果产生或大或小的影响,因此我们不断地改进DNA提取方法以及反应体系、反应程序,最终利用SSR核心引物成功地构建出39份甜菜品种的指纹图谱,实现了快速鉴定甜菜品种真实性以及纯度的目的。这对于减少种植者的损失,以及维护甜菜品种市场的秩序均具有重大的意义。
