桑葚总多糖对对乙酰氨基酚诱导小鼠急性肝损伤的保护作用
2019-10-11舒广文邱韵涵付千段欢余惠凡邓旭坤
舒广文,邱韵涵,付千,段欢,余惠凡,邓旭坤
(中南民族大学 药学院,民族药学国家级实验教学示范中心,武汉 430074)
对乙酰氨基酚(APAP)是一种广泛用于临床的解热镇痛药[1].APAP服用过量时可在肝脏内诱导剧烈的氧化应激,迅速引发严重的肝损伤,进一步恶化为致命的肝衰竭[2].目前,临床上主要采取抗氧化剂N-乙酰半胱氨酸来应对APAP诱导的肝损伤[3],但治疗效果并不十分令人满意.
桑葚(MorusalbaL.)为桑科植物桑的干燥果穗,其性寒,味甘、酸,归心、肝、肾经,功能滋阴补血,生津润燥[4].桑葚中含多糖、黄酮、生物碱等化学成分,多糖是一类广泛存在于植物内的生物大分子,具有广泛的药理活性.研究表明,桑葚中的多糖类成分对于酒精或四氯化碳诱导的肝损伤具有明显的保护作用[5,6],但目前尚不清楚其能否缓解APAP诱导的急性肝损伤.因此,本文探讨了桑椹总多糖(MFP)对APAP所致小鼠急性肝损伤的保护作用及可能机制.
1 材料与方法
1.1 材料和仪器
SPF级雄性8周龄昆明小鼠,体重18~23 g,由湖北省实验动物研究中心提供,实验动物生产许可证号:SCXX(鄂)2015-0018.动物饲养于SPF级动物房内,温度21~23 ℃,相对湿度65%~70%,明暗循环12/12 h,自由饮水进食,适应性喂养3 d后用于实验.
桑葚购于安徽亳州中药材市场;APAP(批号B19M8E36136,上海源叶生物科技);ALT, AST, LDH, MDA, GSH, T-SOD, T-AOC检测试剂盒(南京建成生物工程研究所);TNF-α, IL-1β, IL-6 ELISA检测试剂盒(美国RayBiotech);β-actin, NF-κB p65, HO-1, G6PD抗体(美国Santa Cruz);THERMO Multiskan GO全波长酶标仪(美国Thermo Scientific);WIGGENS D-130 手持式破碎匀浆机(德国Wiggen Hauser).
1.2 MFP的制备
参照文献[7],取干燥桑葚粉末(300 g),石油醚冷浸12 h 脱脂,滤渣加蒸馏水(质量/体积比为1∶8)加热回流提取3次,每次2 h.合并滤液并浓缩至一定体积,醇沉,过滤得桑葚粗多糖.取所得桑葚粗多糖加适量温热水溶解,采用过氧化氢脱色,Sevage法除蛋白,水相部分于流水中透析72 h,真空干燥得桑葚总多糖(1.58 g).以葡萄糖溶液为标准品,采用苯酚-硫酸法测得总多糖含量为72.9%.
1.3 细胞培养与细胞活力的测定
人肝癌HepG2细胞用含10%胎牛血清的DMEM液体培养基培养于含5% CO2的37 ℃培养箱中.取对数生长期的HepG2细胞接种于24孔板中(初始接种密度为60%),每组设3个复孔.待细胞贴壁后,分别加入不同浓度的MFP(100, 300 μg·mL-1)进行培养,对照组每孔加500 μL 的DMEM培养基.孵育24 h后,弃培养液,再向每孔中加入500 μL含10 mmol·L-1APAP的DMEM培养基.继续培养24 h后,向每孔中加入20 μL的MTT (5 mg·mL-1),避光培养2 h.再弃去孔内培养液,每孔中加入250 μL的DMSO,置于培养箱中孵育10 min.最后检测各孔中溶液在490 nm处的吸光度值,重复3次.
1.4 动物分组及处理
参考文献[8]并进行预实验后,32只雄性昆明小鼠随机分为4组,即正常组、模型组、MFP低剂量组(50 mg·kg-1)、MFP高剂量组(150 mg·kg-1),每组8只.持续灌胃给药7 d,每日1次.最后一次给药2 h后,除空白对照组外,其余各组腹腔注射APAP(300 mg·kg-1)建立急性肝损伤模型.
1.5 生化指标测定
APAP腹腔注射12 h后,麻醉小鼠,取血,离心(3000 r·min-1, 15 min)分离血清.根据试剂盒说明书,采用赖氏比色法检测血清中ALT, AST, LDH水平.取血后迅速处死小鼠,解剖取肝脏,置于冰生理盐水中,洗去血渍,称重并记录,并按下式计算肝脏指数:肝脏指数/%=肝质量/体质量×100.取适量肝组织,制备肝匀浆,依试剂盒说明书,检测肝组织中MDA, GSH, T-SOD, T-AOC的水平,并采用ELISA法测定肝组织中TNF-α, IL-1β, IL-6的含量.
1.6 组织学检查
将小鼠肝脏固定于10%甲醛溶液中,石蜡包埋并切片,依HE染液说明书进行组织切片染色.
1.7 免疫印迹分析
取适量肝脏组织,制备肝脏总蛋白提取物,蛋白定量后进行SDS-PAGE电泳(每泳道上样30 μg蛋白).电泳完成后将蛋白转移到PVDF膜上,将膜分别与β-actin,HO-1,G6PD, NF-κB p65的一抗孵育过夜,洗净一抗后再与碱性磷酸酶标记的二抗孵育2 h.洗净二抗后采用碱性磷酸酶显色试剂盒进行显色.扫描所得图像,用Image J软件进行半定量分析.文中所出示的免疫印迹结果,为每组中所有小鼠的代表性结果.
1.8 统计学分析

2 结果与分析
2.1 MFP缓解APAP对HepG2肝细胞的毒性效应
MFP缓解APAP对HepG2肝细胞的毒性效应结果见图1.如图1所示,经10 mmol·L-1的APAP处理24 h后,大量HepG2细胞形态变圆并失去贴壁能力,MFP明显缓解了APAP对HepG2肝细胞的毒性效应.过量APAP可使细胞活力显著下降(P<0.01),MFP剂量依赖性地缓解了APAP诱导的HepG2细胞死亡(P<0.01).
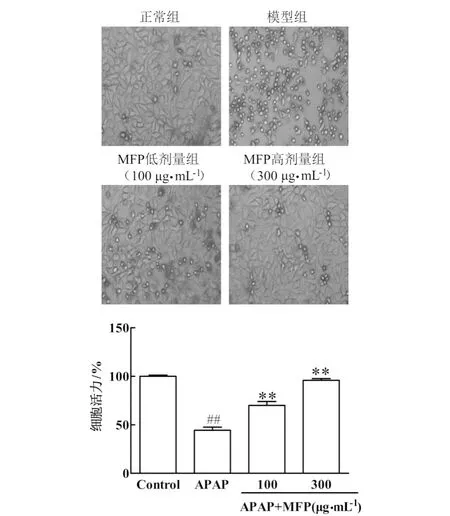
与正常组比较,##P<0.01;与模型组比较,**P<0.01
2.2 MFP对APAP诱导小鼠肝损伤的保护作用
血清ALT,AST,LDH水平均是肝损伤的敏感指标[9].MFP对APAP诱导小鼠肝损伤的保护作用结果见表1.如表1所示:与正常组相比,模型组小鼠肝脏指数和血清中ALT,AST,LDH的水平均显著升高(P<0.01).经不同剂量MFP处理后,小鼠肝脏指数和这3种酶的水平较模型组均显著降低(P<0.05或P<0.01).
表1 MFP对小鼠肝脏指数及血清ALT、AST和LDH水平的影响
2.3 MFP对APAP肝损伤小鼠肝组织病理变化的影响
MFP对APAP肝损伤小鼠肝组织病理变化的影响结果见图2.由图2可见:正常组小鼠肝细胞排列整齐且细胞形态正常;模型组小鼠肝细胞排列紊乱,可见明显的组织内出血和炎性细胞浸润;MFP低剂量组肝组织出血点减少,肝损伤程度明显减轻;MFP高剂量组肝组织结构接近正常.
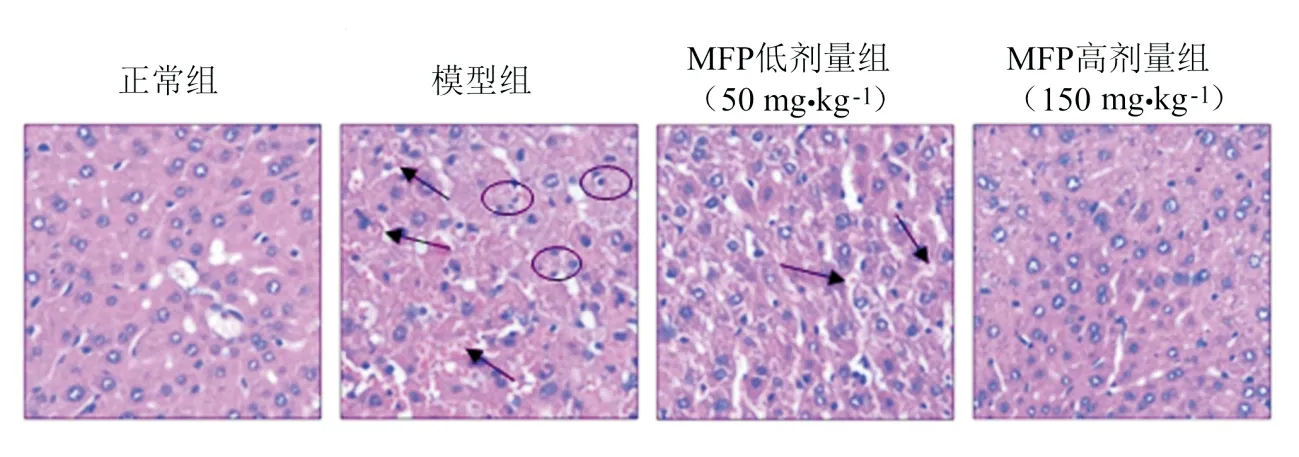
箭头指向肝组织出血点,圆圈圈出炎性细胞浸润现象
2.4 MFP缓解APAP诱导小鼠肝脏氧化应激
MFP缓解APAP诱导的肝脏氧化应激结果见表2.如表2所示:与正常组相比,模型组小鼠肝组织中MDA含量显著升高(P<0.05),GSH,T-SOD,T-AOC水平显著降低(P<0.01).经不同剂量MFP处理后,小鼠肝脏中的MDA水平较模型组显著降低(P<0.01),GSH, T-SOD, T-AOC的水平显著升高(P<0.05或P<0.01).

表2 MFP对小鼠MDA, GSH, T-SOD和T-AOC水平的影响
2.5 MFP抑制APAP诱导的小鼠肝脏炎症反应
TNF-α, IL-1β和IL-6是主要的炎症因子,MFP抑制APAP诱导的肝脏炎症反应结果见表3.如表3所示:在模型组小鼠的肝组织中,这3个细胞因子的含量较正常小鼠均有显著上升(P<0.01).在MFP低剂量组中,肝脏TNF-α水平由173.71 pg·mL-1降至145.20 pg·mL-1,IL-6水平由156.02 pg·mL-1降至130.32 pg·mL-1,差异具有统计学意义(P<0.05或P<0.01).高剂量的MFP可显著降低其中TNF-α, IL-1β, IL-6的含量(P<0.01).
表3 MFP对肝组织中TNF-α、IL-1β和IL-6含量的影响
2.6 MFP对小鼠肝脏中HO-1, G6PD和NF-κB p65蛋白表达水平的影响
HO-1和G6PD在细胞对抗各种因素引起的氧化应激过程中扮演了重要角色,NF-κB p65蛋白则对于介导机体炎症反应具有重要意义.MFP对小鼠肝脏中HO-1, G6PD, NF-κB p65蛋白表达水平的影响见图3.由图3可见:与正常组相比,模型组小鼠肝组织中的HO-1和G6PD的蛋白表达量有降低趋势,而NF-κB p65蛋白的表达水平则明显上升(P<0.05).与模型组相比,高剂量MFP可显著提高肝脏中HO-1和G6PD的蛋白表达量(P<0.01),并明显降低NF-κB p65的蛋白表达量(P<0.01).

与正常组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01
3 讨论
体外实验结果表明,MFP可明显缓解APAP诱导的HepG2细胞死亡.在APAP所致肝损伤模型小鼠体内,血清中ALT, AST, LDH的含量发生异常升高;经MFP处理后,这些指标均显著下降,还有效地改善了APAP诱导的小鼠肝组织病变,说明MFP对APAP诱导的肝损伤具有明显的缓解作用.
很多天然产物均能通过干预氧化应激来缓解各种因素引起的肝损伤[10,11].过量APAP消耗肝细胞内GSH,引发肝脏内的氧化应激,此时肝内MDA水平上升,T-SOD和T-AOC水平下降.MFP可明显提高模型小鼠肝脏中GSH, T-SOD, T-AOC水平,并降低其中MDA含量.说明在MFP保护APAP所致小鼠急性肝损伤过程中,增强肝脏抗氧化能力起关键性作用.
现有MFP干预酒精或四氯化碳诱导肝损伤的研究报道,但对于其分子机制尚缺乏系统深入的认识.HO-1催化血红素降解生成胆红素、一氧化碳和二价铁离子[12],G6PD是细胞通过磷酸戊糖途径产生还原型辅酶II(NADPH)的关键酶[13],而NADPH则是细胞抗氧化反应所需还原力的来源.HO-1和G6PD这两个酶所催化的反应有利于细胞对抗各种因素诱导的氧化应激,本文结果显示:150 mg·kg-1MFP可显著提高小鼠肝脏中HO-1和G6PD蛋白表达水平,50 mg·kg-1MFP对G6PD蛋白表达水平无影响,由于G6PD和HO-1这2个蛋白编码基因的表达调控机制不完全相同;说明MFP通过上调肝内HO-1和G6PD的表达抑制APAP诱导的氧化应激.因此,在MFP的作用下,APAP所致肝损伤模型小鼠肝内的MDA水平下降,T-SOD和T-AOC水平上升,这对实现MFP对抗APAP诱导的肝脏氧化应激具有重要意义.
研究表明,TNF-α等炎症因子参与了APAP所致肝损伤的病理过程[14].本文结果显示:模型组小鼠的肝脏中炎症因子TNF-α, IL-1β和IL-6的水平明显升高,说明发生了明显的炎症反应;而MFP则明显缓解了APAP诱导的肝脏炎症反应.夏娜等[7]也发现药桑多糖能缓解四氯化碳诱导的大鼠肝脏炎症反应.这均提示在MFP的肝脏活性保护中,对抗肝脏炎症反应起到了重要作用.
NF-κB p65蛋白可介导肝脏内的炎症反应.肝损伤发生时,肝脏内总NF-κB p65蛋白表达水平上调,活化NF-κB通路,诱导其下游炎症因子TNF-α, IL-1β和IL-6的转录,这些分子事件导致肝脏组织内的炎症反应[15].模型小鼠中,肝脏中NF-κB p65蛋白的表达水平明显增加;MFP则明显降低了NF-κB p65的表达水平.说明MFP能通过下调NF-κB p65蛋白的表达水平来缓解模型小鼠肝脏中的炎症反应.
综上所述,MFP能保护APAP所致的小鼠急性肝损伤,其机制与抑制氧化应激、缓解炎症反应有关,这为桑葚防治APAP所致肝损伤提供了理论依据.
