耐砷菌Pseudomonas 2-23T的分离鉴定及其对高砷沉积物中砷释放的影响
2019-10-10祝贤彬刘紫薇曾宪春
周 行,祝贤彬,刘紫薇,曾宪春
(中国地质大学(武汉)环境学院,湖北 武汉 430074)
石门具有亚洲最大的雄黄矿,长期露天人工开采导致矿场周围环境污染严重[1-3]。自然条件下,沉积物中砷的转移受微生物[4-5]、有机碳源[6]、磷酸盐和pH值[7]、硅酸盐[8]等影响。微生物为维持其自身的生命活动,进化出了多种耐砷机制[9]。这些微生物分布广泛,种类较多,如Bacillussp.C62、Pseudaminobacterarsenicussp.nov.CB3T、Luteimonasarsenicasp.nov.26-35T等[10-12]。自Migula首次提出假单胞菌(Pseudomonas)属于γ-变形菌门[13],此后对假单胞菌的研究不断出现,包含对假单胞菌的普遍描述[14]、分类[15-19]等,使得人们对它有了更深入的了解。假单胞菌包含多个种,如P.fluvescenssp、P.stutzeri、P.balearica、Azotobacterchroococcum等[16-19]。这些菌株具有不同的生理生化特性,如从核桃树溃疡病中分离到的假单胞菌P.fluvescensspB62,能产生荧光色素和黄色的细胞色素,能水解氧化酶[16];从支气管吸入物分离得到的P.monteiliiCFML 90-60,能产生荧光色素、过氧化氢酶和细胞色素氧化酶,还能水解精氨酸[19];从土壤中分离得到的Pseudomonassp.273,能利用1,10-二氯癸烷作为唯一的碳和能量来源,并且有脱氯作用[20]。
为了检测高砷沉积物中假单胞菌的生理生化特性,本试验首先对湖南省石门县雄黄矿区高砷土壤中[4,10]的菌株Pseudomonas2-23T进行分离与鉴定,然后通过分子生物学和微生物学手段对该菌株进行分类和生理生化检测,最后采用微生物学手段检测其对含砷沉积物的作用。该研究不仅为假单胞菌家族增添了新成员,而且让人们对假单胞菌不同的生活习性有了新的认识。
1 试验方法
1.1 样品采集
砷污染沉积物样品采自湖南省常德市石门县雄黄矿区(北纬29.7°,东经111.0°)土壤,本次采集大约100.0 g砷污染沉积物样品置于无菌的50.0 mL离心管中,快速运回实验室,并储存在4℃冰箱中保存。
1.2 沉积物中砷含量的测定
(1) 沉积物样品中总砷含量的测定:取沉积物样品用王水消解,按文献[21]描述的方法测定沉积物样品中总砷含量。
(2) 沉积物样品中可溶性砷含量的测定:直接称取0.5 g均匀沉积物样品,置于5 mL去离子水中,充分混匀后,放置2 h,中途摇动2~3次,抽取1.0 mL混合液,在10 000 r/min下离心10 min,收集上清液,用于检测沉积物样品中可溶性砷的含量。
1.3 菌株Pseudomonas 2-23T的分离与纯化
称取采集的沉积物样品1.0 g,放入含5.0 mL高温高压灭菌(121℃,0.1 MPa,20 min)的MMM培养基中[22],采用复合碳源(乳酸钠、甲酸钠、丙酮酸钠),添加1.0 mM的砷(As3+),在30℃条件下避光静置培养15 d,混匀培养液,取1.0 mL混合培养液转接到9.0 mL相同的培养基中继续培养15 d,取100.0 μL培养液逐级稀释为100、10-1、10-2、10-3浓度梯度的溶液,取各浓度梯度的溶液200.0 μL涂布在含1.0 mM As(III)和含10.0 mM复合碳源的MMM固体培养基中,于30℃培养48.0 h,挑取固体培养基上的单菌落于含砷的MMM液体培养基中,培养7 d,再转接到含砷培养液中继续培养,如此循环3次。分别取1.0 mL混合液用细菌基因组DNA提取试剂盒提取单菌落细菌DNA,采用Nanodrop 2000 (Thermo,USA)检测DNA浓度。用16S r RNA引物27F[23](5’-AGAGTTTGATCMTGGCTCAG-3’)和1541R(5’-AAGGAGGTGATCCAGCC-3’)扩增16S r RNA,PCR程序为94℃预变性5 min,94℃变性1 min,65℃退火45 s,72℃延伸1 min (以上变性、退火、延伸共35个循环),72℃延伸10 min。PCR产物用1.5%的琼脂糖凝胶电泳检测,挑选PCR产物条带在1 500 bp左右的菌液送至武汉天一辉远生物技术有限公司进行测序。
1.4 菌株Pseudomonas 2-23T的鉴定
菌株Pseudomonas2-23T的鉴定:菌株Pseudomonas2-23T经革兰氏染色后在光学显微镜下观察(对照菌:革兰氏阴性菌为大肠杆菌,革兰氏阳性菌为StaphylococcusaureusAB 94004)。
菌株Pseudomonas2-23T的生理生化特性检测:将菌株接种到人工合成地下水固体培养基上培养,待长出中等大小单一的菌落,挑取菌落按照梅里埃API 20 NE使用说明检测其生理生化特性。
1.5 测定菌株Pseudomonas 2-23T在不同碳源、温度和砷浓度下的生长曲线
扩大培养纯化后的菌株Pseudomonas2-23T,在4℃、5 000 r/min下离心15 min,收集菌体。为了检测该菌株在不同碳源下的生长曲线,将菌体分别接种至含乳酸钠、碳酸氢钠、草酸钠、乙酸钠、甲酸钠、丙酮酸钠和柠檬酸钠的无菌MMM培养基中,在30℃条件下振荡培养,所有碳源浓度均为10.0 mM。
为了检测该菌株在不同温度下的生长曲线,将菌体分别接种至含10.0 mM乳酸钠的无菌人工合成地下水中,分别置于0℃、4℃、30℃、37℃、50℃、75℃条件下培养。
为了检测该菌株在不同砷浓度下的生长曲线,将菌体分别接种至含0.0 mM、1.0 mM、5.0 mM、10.0 mM、20.0 mM、40.0 mM亚砷酸盐(As3+)的MMM培养基中,以10.0 mM的乳酸钠为碳源,于30℃条件下振荡培养。所有混合液均在试管中进行培养,每个变量设置3组试验。培养过程中,分别从0 h开始取样,按设计的间隔时间分别取样7次(不同碳源每次间隔9 h取样,直至63 h;温度和砷浓度每次间隔5 h取样,直至35 h),每次取样大约1.0 mL,测定波长为600 nm时的菌悬液光密度值(OD600值)。
1.6 菌株Pseudomonas 2-23T在有氧及厌氧条件下对含砷沉积物中砷释放的影响
为了检测菌株Pseudomonas2-23T在有氧及厌氧条件下对高砷沉积物中砷释放的影响,设置了如下试验:①灭菌沉积物+乳酸钠(有氧,O2浓度约为21%);②灭菌沉积物+乳酸钠+菌株Pseudomonas2-23T(有氧);③灭菌沉积物+乳酸钠(厌氧,O2<0.1%);④灭菌沉积物+乳酸钠+菌株Pseudomonas2-23T(厌氧)。具体操作过程如下:分别称取3.0 g均匀石门高砷沉积物样品置于试管和25.0 mL血清瓶中,按文献[21]准备好MMM培养基,分别加入10.0 mL MMM培养基。其中,有氧试验组用带橡胶塞的试管进行试验,厌氧试验组则用带橡胶塞和铝盖的血清瓶,并通入高纯N2(>99.9%)以除去液体中和容器上部空间的氧气后,密封。在所有试验体系中,沉积物浓度为3.0 g/10.0 mL。高温高压灭菌冷却充分后,将血清瓶转移到厌氧手套箱中,试验组加细菌2-23T;同时,在有氧试验组的试管中也加入细菌2-23T,在含有细菌的试验组中,细菌2-23T的初始浓度为2×107个/mL。所有试验都设置3组平行试验,并置于30℃条件下避光培养。从第0天开始,每24 h取样1次,共取样4次,测定溶液中可溶性砷的含量。
2 结果与分析
2.1 沉积物中砷含量的检测
经王水消解后,检测到沉积物样品中总砷的含量为96.7 mg/kg,可溶性砷的含量为29.3 mg/kg,说明采样所在地沉积物砷污染异常严重(世界卫生组织规定砷使用的安全标准浓度为10 μg/L[24])。微生物存在于这样的环境中,能进化出为适应环境的独特功能以维持其自身的生命活动。
2.2 菌株Pseudomonas 2-23T的分离与纯化
在挑选的102个单菌落中,经过3次转接到含砷的培养液中培养后,取液体混合物提取细菌DNA,检测到目标菌株的DNA浓度为39.6 ng/μL。经过DNA扩增、测序,得到序列2-23T(基因文库中基因编号为:MK774694)。利用BLAST软件分析基因序列,显示序列2-23T是假单胞菌属的细菌。用邻接法构建系统发育树,Bootstrap设置为1 000,选取菌株Klebsiellasp.CRRI-81_WR13A[25]作为系统发育树的外枝,见图1。
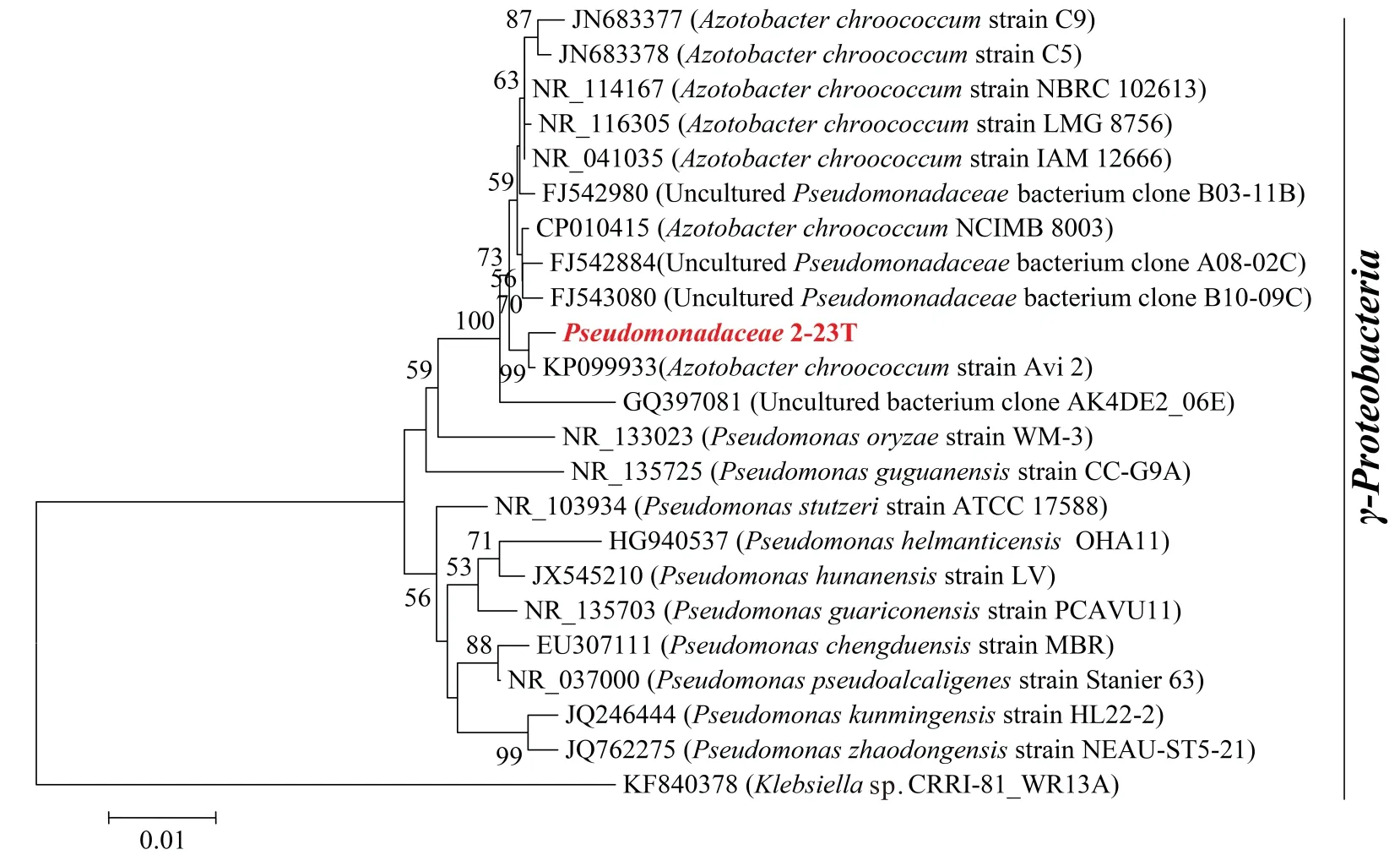
图1 菌株Pseudomonas 2-23T 16S rRNA系统发育树分析
经过同源系列比较分析显示,菌株Pseudomonas2-23T属于γ-变性菌门,与已知的γ-变性菌门中的圆褐固氮菌Avi 2[26]、C9[27]、 C5[27]、NCIMB 8003[28]等的同源性为97.45%~98.63%,与假单胞菌LV[29]、CC-G9A[30]、WM-3[31]、 MBR[32]、HL22-2[33]、NEAU-ST5-21[34]的同源性为95%~96%,表明菌株Pseudomonas2-23T是假单胞菌进化到圆褐固氮菌的中间体,它与系统发育树的外枝菌Klebsiellasp.CRRI-81_WR13A[25]的同源性为87%。
2.3 菌株Pseudomonas 2-23T的鉴定
菌株Pseudomonas2-23T的形态特性显示,其在MMM培养基上呈圆形、中间微隆起、黏稠光滑菌落;菌株Pseudomonas2-23T的革兰氏染色结果显示,其为革兰氏阴性菌。菌株Pseudomonas2-23T的生理生化特性检测结果,见表1。

表1 菌株Pseudomonas 2-23T的生理生化特性检测结果
注:“+”代表阳性反应;“-”代表阴性反应。
2.4 菌株Pseudomonas 2-23T在不同碳源、温度和砷浓度条件下的生长状况
2.4.1 菌株Pseudomonas2-23T在不同碳源下的生长状况
本试验采用不同的碳源检测菌株Pseudomonas2-23T的生长状况,发现在无机碳碳酸氢钠(NaHCO3)、甲酸钠、葡萄糖和蔗糖为碳源的试验组中未检测到菌株的生长,而在乳酸钠、草酸钠、柠檬酸钠、丙酮酸钠和乙酸钠为碳源的试验组中均检测到菌株的生长,且菌株到达稳定期的培养时间分别为45 h、45 h、45 h、45 h和36 h,其生长曲线见图2。上述试验表明菌株Pseudomonas2-23T是异养型菌株,且不能利用碳酸氢钠、甲酸钠、葡萄糖、蔗糖作为碳源。
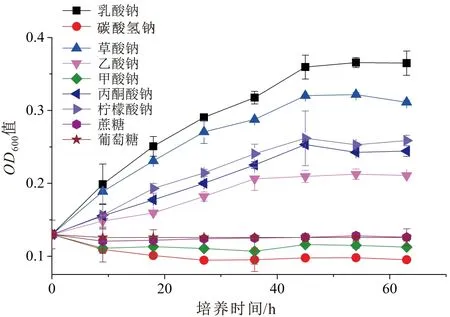
图2 不同碳源下菌株Pseudomonas 2-23T的生长曲线
2.4.2 菌株Pseudomonas2-23T在不同温度下的生长状态
不同温度下菌株Pseudomonas2-23T的生长曲线见图3。
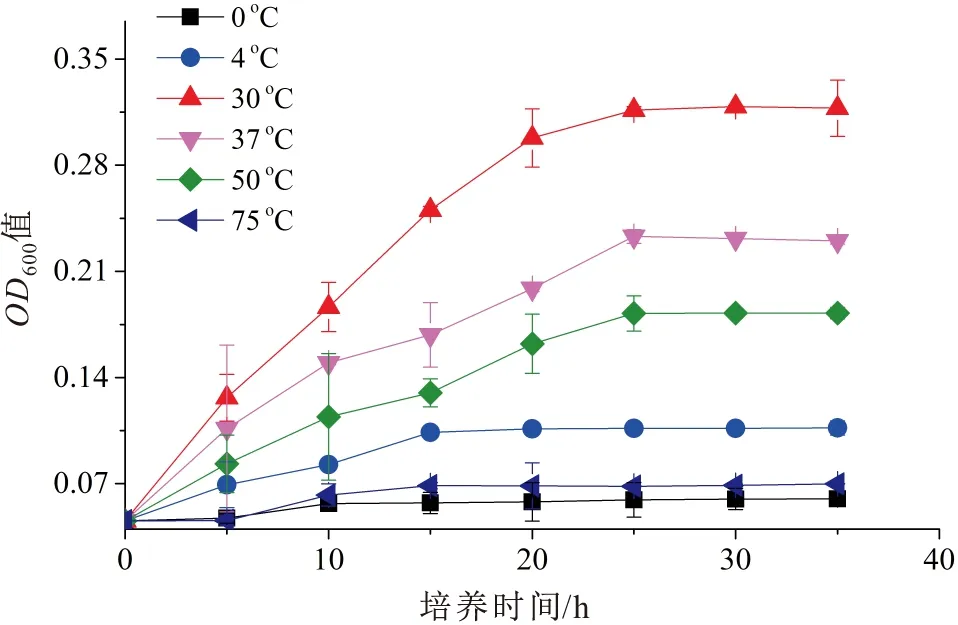
图3 不同温度下菌株Pseudomonas 2-23T的生长曲线
由图3可见,菌株Pseudomonas2-23T在4~75℃范围内都能生长,但在温度为30℃时最适于该菌株的生长,当温度高于或低于30℃时,菌株Pseudomonas2-23T的生长均受到抑制。可见,菌株Pseudomonas2-23T的最适生长温度为30℃。
2.4.3 菌株Pseudomonas2-23T在不同砷浓度下的生长状况
不同砷浓度下菌株Pseudomonas2-23T的生长曲线,见图4。
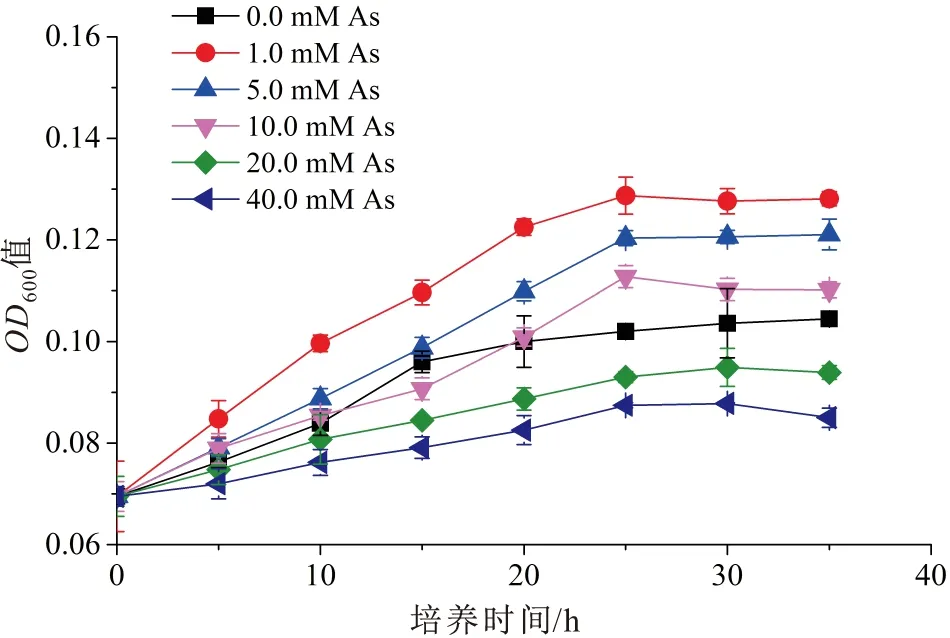
图4 不同砷浓度下菌株Pseudomonas 2-23T的生长曲线
由图4可见,利用乳酸钠为碳源时,菌株Pseudomonas2-23T在不同砷浓度(0.0 mM、1.0 mM、5.0 mM、10.0 mM、20.0 mM、40.0 mM)下,菌株的生长情况不同,该菌株的最适耐砷浓度为1.0 mM,当砷浓度高于1.0 mM时,菌株Pseudomonas2-23T的生长将受到抑制。
2.5 菌株Pseudomonas 2-23T在有氧及厌氧条件下对高砷沉积物中砷释放的影响
菌株Pseudomonas2-23T在有氧及厌氧条件下对石门沉积物中砷释放的影响,见图5。
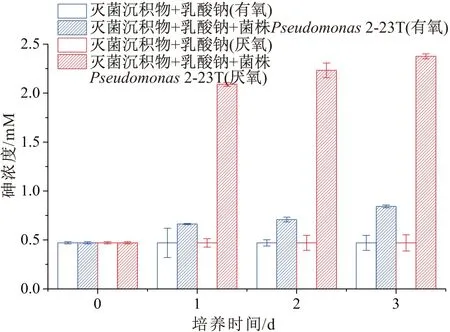
图5 菌株Pseudomonas 2-23T对石门高砷沉积物中砷释放的影响
由图5可见,菌株Pseudomonas2-23T在利用乳酸钠为碳源时,能够促进高砷沉积物中砷的释放,在含灭菌沉积物和菌株Pseudomonas2-23T的试验组中,有氧条件下溶液中的砷浓度在第1 d、第2 d和第3 d分别为0.66 mM,0.71 mM和0.78 mM,厌氧条件下溶液中的砷浓度在第1 d、第2 d和第3 d则分别为2.09 mM, 2.23 mM和2.44 mM;在有氧和厌氧条件下只含灭菌沉积物的对照组和试验组的第0 d,溶液中的砷含量为0.46±0.01 mM。由此可以看出,菌株Pseudomonas2-23T具有促进砷从沉积物中释放到地下水的功能,且在厌氧条件下菌株Pseudomonas2-23T促进沉积物中砷释放的能力强于有氧条件。
3 结论与展望
本研究采集了石门砷污染地区土壤沉积物样品,经分离与纯化得到耐砷菌株Pseudomonas2-23T经革兰氏染色鉴定其为革兰氏阴性菌,通过分析其16S rRNA序列可知该菌株属于假单胞菌;通过检测该菌株在不同碳源、温度和砷浓度下的生长状况,可知其最适生长温度为30℃,最适耐砷浓度为1.0 mM,能够利用乳酸钠、草酸钠、柠檬酸钠、丙酮酸钠和乙酸钠作为碳源,而不能利用碳酸氢钠、甲酸钠、葡萄糖和蔗糖作为碳源。微生物学试验结果显示,该菌株在厌氧条件下具有较强的促进沉积物中的砷释放到环境中的功能,表明该耐砷菌株大量存在于地下的缺氧环境中会加重地下水的砷污染。
菌株Pseudomonas2-23T在处理含砷矿物方面具有良好的应用前景,有望丰富活性土壤微生物种群的丰富度。该研究结果可为土壤环境修复提供一定的理论指导。
