遗传毒性基因突变评价方法的研究进展
2019-10-10王亚楠文海若
王亚楠,文海若*,王 雪*
(中国食品药品检定研究院,国家药物安全评价监测中心,药物非临床安全性评价研究北京市重点实验室,北京 100176)
基因突变(genemutation)指在分子水平上基因的碱基对组成或排列顺序的改变,如碱基对置换(substitution)、移码(translocation)、缺失(deletion)、插入(insertion)等。基因突变现象最初于1910年由Morgan等[1]在白眼果蝇中首次发现,从此奠定了染色体的遗传理论,Morgan也因此于1933年获得诺贝尔生理学奖。此后,人们就基因突变类型及其产生机制进行了大量研究。基因突变是癌症发生与发展的重要物质基础,已证实的具有致癌性的物质70%有致突变性。遗传毒性评价为食品(保健食品)、化妆品、药品和医疗器械上市前重要的安全性评价研究内容,其通过一系列试验来预测受试物的致癌性,从而降低相关接触人群的患癌风险。2018年3月由国家食品药品监督管理总局颁布的《药物遗传毒性研究技术指导原则》[2]中提到两种标准试验组合,而细菌回复突变试验(Amestest)和一项小鼠淋巴瘤细胞tk基因突变试验(mouselymphomaassay,MLA)是其中的重要组成部分。
与2007年起实施的《药物遗传毒性研究技术指导原则》相比,新的指导原则强调了体内遗传毒性试验的重要性,并明确列出转基因动物体内突变试验是体内试验的备选。可见,基因突变仍然是遗传毒性评价的重要检测终点。近年来,体内Pig-a基因突变试验也在国内安全评价领域得到进一步推广。随着分子生物学技术的飞跃,人们逐渐就基因突变检测方法的适用性和优化形成新认识。本文就指导原则中涉及的Ames试验、MLA、Pig-a基因突变试验和转基因动物基因突变试验等的试验原理、优势与局限及最新研究进展进行阐述。
1 细菌回复突变试验
我们所熟知的细菌回复突变试验,是由Ames在上世纪70年代建立并经十多年不断发展完善形成,俗称Ames试验。Ames试验利用营养缺陷型菌株在不发生突变的情况下,只能分裂数次形成显微镜下可见的菌落,而在诱变剂作用下可通过突变自行合成氨基酸,形成肉眼可见的菌落。试验通过对菌落计数,来评价受试物的致突变潜力。后期在组氨酸营养缺陷的鼠伤寒沙门氏菌的基础上又引入了含抗性因子质粒及色氨酸营养缺陷的大肠杆菌,进一步优化了试验的检测谱和检测灵敏度。Ames试验流程如图1所示[3]。
当前常用的Ames菌株包括TA97/TA97a、TA98、TAl00、TAl02、TAl04、TA1535、TA1537、WP2uvrA等。不同菌株检测的突变类型有差异,如TA98和TA1537的检测对象为移码型突变,而TA100、TA102、TA1535、WP2uvrA等检测对象为碱基对置换型突变[4]。因Ames试验方法操作较为简便、试验周期短,又与化学物质的潜在致癌性评价紧密相关,故在食品、药品、化妆品、医疗器械等领域应用广泛。然而,不同的研究领域对于菌株的选择也存在一定的差异(表1)。

表1 不同研究领域Ames试验中建议采用的菌株[4]
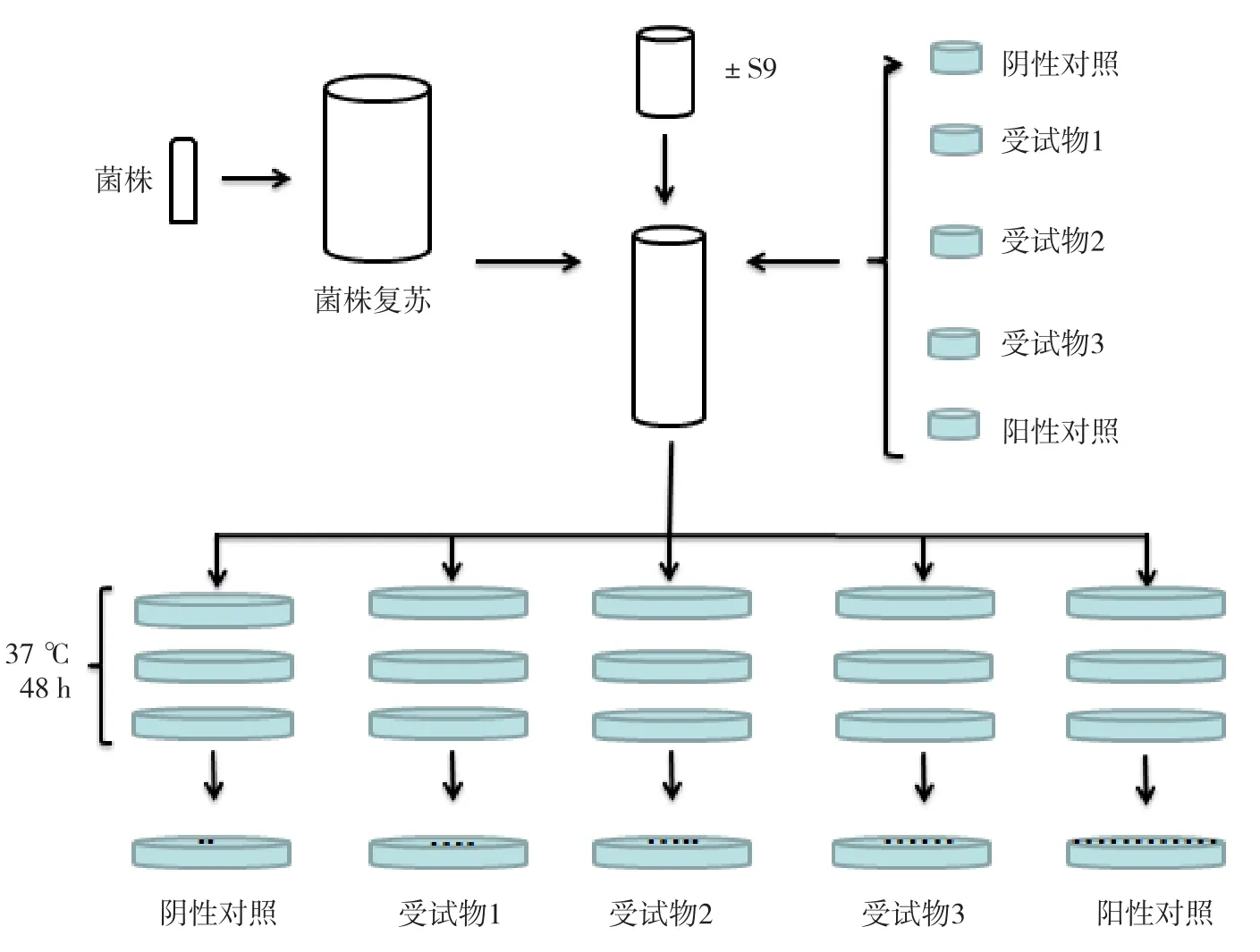
图1 Ames试验流程示意图
尽管Ames试验是基于细菌试验体系的致突变性评价方法,但它对啮齿类动物致癌性预测效果优于其他基于哺乳动物细胞试验体系的遗传毒性评价方法,可检出87.5%的恒河猴体内致癌物[5]。此外,Ames试验也是化合物构效关系(quantitative structure-activity relationship,QSAR)遗传毒性筛选数据库构建的重要基础,是环境诱变剂和新药研发初筛的首选遗传毒性试验方法[6]。尽管Ames试验具有不可替代的优势,但也存在一定短板。例如,大部分中药受试物为混合物,检测样本中可能含有色氨酸或组氨酸,对Ames试验结果产生影响。而一些具有抗菌功能的医疗器械产品也不适宜使用Ames试验来评价[7]。又如,有的中药或纳米材料本身颜色较深,可对琼脂及菌落染色,从而对计数结果的准确性产生一定影响。此外,使用Ames试验来检测纳米材料的适用性也受到了一定质疑[8]:碱性的固态培养条件,菌壁较厚且携带负电荷的革兰氏阴性菌均可导致纳米材料无法与细菌充分接触。马茂才等[9]研究发现在有或无添加S9体外代谢活化条件的情况下,2种不同浓度的光催化纳米材料对菌株TA97、TA98、TA100和TA102的诱发回变菌落数均未超过自发回变菌落数的2倍,即均未呈现致突变作用;而受试物在彗星、微核等试验中结果均为阳性。针对上述困境,有人提出可开展液态培养条件下酸化处理过的“波动Ames试验”,通过增加细菌对纳米材料的吞噬来提高检出率[10]。
作为最可靠的遗传毒性评价方法,科研人员长期以来对Ames试验方法进行了各种优化和改进,从而更好地发挥其长处。基于6孔板(mini-Ames)和24孔板(micro-Ames)的Ames试验可有效减少受试物的用量,仅为标准平皿(10 cm2)的1/5和1/20。研究提示mini-Ames与标准平皿Ames试验结果的一致性可达95%~98%,可很好地应用于药物遗传毒性早期的快速筛选[11]。“高通量”是现代毒理学研究的关键词,除96板和384孔板液态培养及显色的“波动Ames试验”和Ames II以外,Ames试验也通过构建含荧光报告基因质粒来实现高通量化[12]。经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)的药物遗传毒性试验Ames试验指导原则于1997年首次发布,当前OECD正在收集基于微孔板(含6孔、24孔、96孔及384孔)Ames试验的背景数据及试验操作细节,用于进行指导原则更新,从而使这项经典试验更好地服务于监管和安全评价领域。
2 小鼠淋巴瘤细胞基因突变实验
以哺乳动物为试验体系的MLA是以tk基因突变为检测终点的试验方法。tk基因编码的胸苷激酶(thymidine kinase,TK)在无突变时可通过将胸苷或其类似物如三氟胸苷(trifluorothymidine,TFT)整合入DNA序列导致DNA的失活和细胞死亡,而突变后的tk基因则无法将TFT整合进入DNA。因此,可通过检测细胞在给予TFT后的存活率,来检测是否存在致突变剂[13]。常用的试验方法包括软琼脂法和微孔法,两者对比见表2,微孔法在医疗器械及药物安全评价研究中较为常用。

表2 软琼脂法和微孔法优缺点比较[14]
MLA可以克服Ames试验的某些缺陷,当Ames试验不适用时,是备选的基因突变评价方法。如国内医疗器械遗传毒性评价标准(GB/T 16886.3-2008)中将哺乳动物细胞基因突变试验(多为MLA)明确列入遗传毒性评价必选项目中。对于具有杀菌或者抑菌作用的医疗器械产品,哺乳动物细胞基因突变试验的结果更有价值。然而也有文献指出[15],Ames试验和体外微核试验两项已足够用于预测啮齿类动物致癌性和体内遗传毒性,在两者的基础上增加MLA后,检出率仅从78%(316/405)提高至79.5%(322/405)。此外,tk基因自身存在tk+/+,tk+/-及tk-/-等多个基因型,在进行致突变研究之前,应对所需的基因型进行筛选,确保试验中所用的细胞表达目的基因型(即tk+/-)。
检测tk基因突变使用的细胞株包括小鼠淋巴瘤L5178Y以及人类淋巴母细胞TK6以及TK-E6等,MLA是以小鼠淋巴瘤L5178Y细胞为试验体系。与tk基因突变有相似之处的hprt基因突变是以hprt作为突变检测位点进行的哺乳动物细胞体外遗传毒性检测试验方法。hprt基因编码的次黄嘌呤-鸟嘌呤磷酸核糖转移酶(hypoxanthine guanine phosphoribosyl transferase,HPRT)参与细胞内嘌呤补救代谢途径,自身的缺乏或活性降低会引起核酸代谢异常,在无突变时可将嘌呤或其类似物如6-硫鸟嘌呤(6-Thioguanine,6-TG)整合入DNA序列,而导致DNA的失活及细胞死亡,而当hprt基因突变后则无法将6-TG整合进入DNA,根据此原理来检测hprt基因是否存在突变。张勇等[16]对TK6和TK-E6细胞tk和hprt基因突变进行了比较,其中将TK6和TK-E6两种细胞相比较:TK6-E6细胞的tk突变试验敏感性高,两种细胞在hprt位点敏感性一致。然而,不同细胞或者同一种细胞tk位点的突变敏感性均较hprt位点突变敏感性高,这主要与tk基因和hprt基因自身特点不同有关(表3)。有研究分别就L5178Y细胞与CHO细胞的tk基因突变试验和hprt基因突变试验结果进行对比,也得到一致结论[17]。OECD于2015年新增了TG490体外哺乳动物细胞tk基因突变试验,并新修订颁布了TG476体外哺乳动物细胞hprt和xprt基因突变试验。hprt基因的自发突变频率较低但特异性高,可与tk基因突变形成互补。

表3 tk基因突变与hprt基因突变的比较[17-18]
3 Pig-a基因突变试验
使用正常动物开展的体内Pig-a基因突变试验,是近年来逐渐走入安全评价领域并受到广泛重视的一项致突变性评价方法。位于人X染色体上的Pig-a基因发生突变时,可导致糖化磷脂酰肌醇(glycosylphos-phatidyl inositol,GPI)合成障碍,并进一步使细胞GPI锚蛋白缺失(图2[19])。Araten等[20]于1999年提出可以Pig-a基因作为报告基因建立体内基因突变试验方法,并逐渐将此方法推向临床前遗传毒性评价。由于GPI锚在不同物种间的生物合成高度保守,而且其合成起源于骨髓干细胞,在各类组织细胞及各类成熟红细胞中均有表达,因此,理论上Pig-a基因突变试验可在不同动物种属和不同类型组织中开展。但由于具体实体组织在进行单细胞悬液的制备过程中,会引起细胞表面重要靶蛋白的缺失或结构的异常,故试验中采用外周血为主要检测对象。体内Pig-a基因突变试验常用的检测方法主要包括流式细胞术检测法和有限稀释克隆法。流式细胞术方法利用Pig-a基因发生突变后细胞表面GPI锚合成异常,导致细胞表面锚链蛋白(如CD48、CD55、CD59等)缺失,从而可利用荧光标记GPI锚链蛋白以区分突变细胞与正常细胞,并使用另外一种荧光标记抗体和(或)流式设门策略将不同细胞群区分,来检测目标细胞群中突变细胞的数量。而有限稀释克隆法利用细菌原毒素气单胞菌溶素前体(proaerolysin,ProAER)可通过直接与正常细胞的GPI锚(而不是锚链蛋白)特异性结合诱导细胞膜完整性受损以致细胞死亡。存在Pig-a基因突变的细胞表面无法正常合成GPI锚时,气单胞菌溶素无法与GPI锚特异性结合,细胞得以存活;反之,Pig-a基因突变可致细胞死亡。Pig-a基因突变试验运用了上述试验原理对受试物诱导基因突变的潜力进行检测[21]。Dertinger等[22]在国际联合验证过程中进一步将高通量免疫磁性筛选技术高通量方法引入Pig-a基因突变试验,从而有效提高了细胞分析的数量与统计功效。

图2 Pig-a基因突变原理示意图
体内Pig-a基因突变试验的灵敏性和特异性已得到验证。一项41种化合物的大鼠Pig-a基因突变试验验证数据显示,大部分预期在试验中呈现阳性反应的受试物均可导致Pig-a基因突变[23]。除直接与DNA反应的烷化剂外,需经体内代谢活化后的遗传毒性阳性化合物,如2-乙酰氨基芴(2-acetylaminofluorene,2-AAF)、马兜铃酸(aristolochic acids,AAs)、环磷酰胺(cyclophosphamide,CY)、二乙基亚硝胺(diethylnitrosamine,DEN)、苯并[a]芘(benzo[a]pyrene,B[a]P)和7,12-二甲基苯并[a]蒽(7,12-dimethylbenz[a]anthracene,DMBA)等也可在Pig-a基因突变试验中获得阳性结果[24-25]。此外,Pig-a基因突变试验对于盐酸哌醋甲酯(methylphenidate hydrochloride,MPH)和芘(pyrene,Pyr)等非遗传毒性化合物也呈现较好的特异性。该方法有望成为体内试验中第二个遗传学终点检测的候选。流式法检测Pig-a基因突变较为简便,该方法以外周血为监测窗,除在临床前研究中更适合与重复给药毒性试验结合外,在职业暴露人群的环境诱变剂监测和临床抗肿瘤治疗疗效动态监测方面也有重要的应用价值[26]。然而,因体内Pig-a试验通常使用外周血开展,当受试物(如某些纳米材料)具有特殊的体内代谢动力学特征时,外周血的浓度不能代表其组织分布浓度,此时Pig-a基因突变试验的选择应谨慎。当前体内Pig-a基因突变试验指导原则的确立也列入了OECD的工作日程,计划于2020年正式发布。
近年来,以人类B淋巴细胞样细胞系TK6、MCL-5以及L5178Y等哺乳动物细胞系开展的Pig-a基因突变试验也取得了一些进展。当Ames试验结果不明确时,可选择体外Pig-a基因突变试验作为后续选择。研究[27]提示,使用不同细胞系开展体外Pig-a基因突变试验的结果可存在一定差异(不同细胞系自发突变率不同)。Krüger等[28]指出TK6细胞系在未处理的对照细胞中显示GPI(-)自发突变率较高,检测前需对GPI(-)进行清除以降低背景值。常规用于开展MLA的小鼠淋巴瘤细胞系L5178Y也可用于Pig-a基因突变试验,该细胞的自发突变率低于TK6细胞,这与TK6细胞中Pig-l基因的缺失有关。另外,也可收集经受试物处理的细胞克隆的Pig-a mRNA进行测序,来分析GPI(-)受试物作用后产生的基因突变特点。文献报道,L5178Y细胞经EMS处理后对其Pig-a mRNA进行测序,其突变特点主要表现为C-T转换,与文献报道相符[27,29]。体外Pig-a基因突变试验具有周期长(一般采用受试物处理后表达8 d进行检测)、不使用动物和适于进行机制研究的优势,但在正式走进安全评价领域之前,在细胞选择和标准化试验方法的验证等方面还需要开展大量工作。
4 转基因动物试验
体内遗传毒性试验的优点在于它的检测内容涵盖受试物进入体内并发挥作用的全程,可较好地模拟药物在机体内吸收、分布、排泄、代谢并产生毒性的过程。转基因啮齿动物基因突变模型作为经典的体内遗传毒性评价方法至今已有二十多年的历史。该方法突破了体内遗传毒性评价方法仅使用造血组织为检测终点的局限,可就肝、肾等不同组织的基因突变进行检测,对受试物的体内基因突变靶组织进行有效预测。可商业购买到的模型包括转基因小鼠MutaTMMouse和BigBlue等,这两种转基因啮齿动物模型均基于λ噬菌体体外包装原理。两者分别以lacZ和lacI为靶基因并使用转基因小鼠作为转基因受体,动物给予受试物后,通过分离不同组织来检测相应基因的突变率(图3[30])。OECD已于2011年颁布了TG488转基因动物突变试验的指导原则,然而因转基因动物成本较高,较大程度上限制了其应用范围。
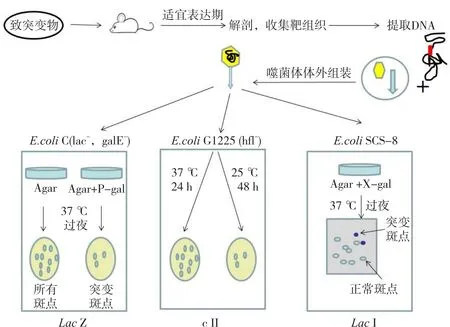
图3 转基因动物示意图
国内已使用转基因动物对马兜铃酸的遗传毒性及其致突变特性进行评价。栾洋等[31]使用LC-ESI-MS-MS和gpt delta转基因小鼠来确定肾脏中马兜铃酸I(aristolochic acid I,AAI)和马兜铃酸II(AAII)诱导的gpt基因DNA加合物的突变频率以及它们各自的突变谱特征,结果显示,溶剂对照组肾脏中gpt基因的自发突变率为2.37×10-6;AAI 1 mg/kg组(6.67×10-6)和AAI 5 mg/kg组的gpt基因突变率(16.72×10-6)分别比溶剂对照组高2.8和7.0倍;AAII 1 mg/kg组gpt基因的突变率(9.54×10-6)和AAII 5 mg/kg组(32.00×10-6)分别比溶剂对照组高4.0和13.5倍;5 mg/kg时AAII诱导的突变率几乎是AAI诱导的两倍。
此外,转基因啮齿动物培养细胞突变试验也成为相应体内致突变性试验可行的替代方法。如使用从C57BL/6或B6C3F1遗传背景的BigBlue小鼠胚胎中分离的原代小鼠胚胎成纤维细胞或从转基因BigBlue动物各种组织/器官制备的原代细胞进行细胞突变试验。因该方法使用原代组织细胞开展,非常适用于可疑诱变剂的初始测试[32]。
5 小结
随着新型药物的涌现以及对药物评价试验要求的不断提高,传统的试验体系也历经了一系列优化。然而,不同的致突变新检测方法对不同检测品种的适用性及其优势和局限不尽相同(表4)。本文就临床前安全性评价领域常用的,尤其是新版《药物遗传毒性研究技术指导原则》涉及的基因突变评价方法及研究进展进行总结,以期为相关科研及安全评价工作者提供借鉴。

表4 不同遗传毒性致突变检测方法的比较
