复合益生菌发酵液的功能特性及对对虾诱食效果
2019-10-10马青山
李 艳,马青山
复合益生菌发酵液的功能特性及对对虾诱食效果
李 艳1,马青山2※
(1. 中国海洋大学海水养殖教育部重点实验室,青岛 266003;2. 中国海洋大学医药学院,青岛 266003)
为探求复合菌发酵液的多种功能,该试验选择具有脱氮、产酶、抑菌等优良性能的酵母菌、乳酸菌及芽孢杆菌各1株,利用已优化的HJ培养基进行共培养,实时监测发酵过程,分时段取样,对复合菌发酵液的脱氮、产酶、抑菌、培藻及诱食等功能进行研究。结果表明,酿酒酵母菌NJ-02、屎肠球菌SC-01及枯草芽孢杆菌M7-1能够在HJ培养基中进行共发酵,连续培养24 h后3株微生物活菌数量分别达到3.88×108、2.41×1010、5.38×109CFU/mL。复合菌发酵液的脱氮、培藻性能同复合菌中枯草芽孢杆菌M7-1的活菌数相关较大,发酵至16 h其降解亚硝态氮和培藻性能最为理想,亚硝态氮降解率为89%,并使小球藻叶绿素a质量分数提升49.6%。复合菌发酵液具有同枯草芽孢杆菌M7-1相当的产酶(蛋白酶、淀粉酶、纤维素酶)活性及同屎肠球菌SC-01相当的抑菌(副溶血弧菌)活性。复合菌发酵液饲喂对虾,诱食效果明显好于对照组(<0.05),同化学诱食剂二甲基--丙酸噻亭(dimethyl-beta-propiothetin hydrochloride, DMPT)差异不显著,其肠道中乳酸菌、酵母菌数目显著高于对照组及化学诱食剂组(<0.05)。该研究所制备的脱氮、培藻、抑菌及诱食功能复合菌发酵液,为可持续生态水产养殖提供了新的微生物资源和技术方法。
发酵;脱氮性能;产酶性能;抑菌性能;诱食效果
0 引 言
中国是全球最大的水产养殖国家,养殖水产品总量逐年递增。据统计,2018年总量已达4 906万t,超过世界养殖水产品总量的70%[1]。水产养殖为中国优质蛋白质的供给与农业经济的发展及国家的粮食安全做出了巨大贡献。
目前,高密度、集约化已成为中国水产养殖的主要模式,这种模式以超量饲喂、人工增氧及抗生素的应用为主要维持手段[2],然而,养殖密度的不断提高极易打破池塘原有的生态平衡,过多的残饵、粪便无法被池塘中的微生物分解利用,导致氨氮、亚硝态氮等有害物质积累,影响养殖动物的健康[3];其次,化药及抗生素的应用,导致有害耐药细菌及有害藻类大量繁殖,同时,药残问题也无时不刻的影响着养殖动物的品质及安全[4]。因此,重建养殖池塘生态平衡,恢复环境中的正常菌相、藻相,通过生物手段降低抗生素及化药的应用,乃是解决这一矛盾的主要办法[5-6]。益生菌的应用能够促进藻类繁殖、稳定池塘生态系统,降解池塘氨氮、亚硝态氮等有害物质,并且能够提升水产动物摄食量、维持肠道正常菌群、保障动物肠道健康[7],可大幅度降低抗生素及化学药物等的应用。
以往研究的益生菌主要侧重于某一方面的功能或将功能性菌粉进行简单复配[8-10],研究结果表明,复配后益生菌功效会得到提升。Hao等[11]在对虾饲料中按2:1:1比例添加混合益生菌D4、D7 及D15,剂量为 107CFU/g,同应用单一益生菌相比,应用复合益生菌后明显提升了对虾的生长性能及抗病能力。但将上述脱氮、产酶、抑菌等功能的微生物进行混合发酵,赋予一种发酵液多种功能,并进一步研究复合发酵液的培养方法和用途的研究报道相对较少。多功能复合菌发酵可大幅度降低生产成本、简化应用流程、拓宽应用范围[7],具有潜在的应用价值,值得深入研究,益生菌的混合发酵涉及到功能性菌株活菌数的保障,菌株间的功效协作及协同效应的验证等多方面内容。本试验对复合菌发酵液的制备及其脱氮、培藻、抑菌及对虾诱食、肠道菌群调控等方面进行了研究,取得了较为满意的结果。
1 材料与方法
1.1 备选菌种和培养基
1.1.1 菌 种
选取实验室保藏的脱氮、产酶、抑菌等性能优良的酵母菌、乳酸菌及芽孢杆菌各1株(表1),初始发酵的菌株接种比例为1:1:1(活菌数均为107CFU/mL)。

表1 复合菌发酵菌种信息
复合菌发酵HJ培养基:可溶性淀粉10 g/L、蛋白胨10 g/L、葡萄糖10 g/L、磷酸二氢钾2 g/L、氯化钠1 g/L,蒸馏水1 000 mL。
亚硝态氮降解培养基:丁二酸钠4.72 g、亚硝酸钠2.5 mg、磷酸二氢钾1 g、七水硫酸铁0.05 g、无水氯化钙0.2 g、七水硫酸镁1 g、蒸馏水1 000 mL。
氨氮降解培养基:丁二酸钠4.72 g、氯化铵2.5 mg、磷酸二氢钾1 g、七水硫酸铁0.05 g、无水氯化钙0.2 g、七水硫酸镁1 g、蒸馏水1 000 mL。
小球藻培养基:糖蜜78%、硝酸铵5%、腐植酸钠7%、硅酸钠5%、过磷酸钙3%、磷酸二氢钾0.2%、硫酸锰0.6% 、硫酸铜0.25%、七水硫酸亚铁0.5%、钼酸铵0.1%、硼酸0.1%、硫酸锌0.25%。
LB肉汤培养基(Luria-Bertani Broth,LB)、乳酸细菌培养基(man rogosa sharpe medium,MRS)、酵母膏胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(thiosulfate citrate bile salts sucrose agar culture medium,TCBS)购于北京陆桥技术股份有限公司(北京,中国)。培养基中所应用的化学药品购于国药集团化学试剂有限公司(北京,中国)。
1.2 复合菌发酵及活菌计数
将上述3株菌应用HJ培养基分别培养后,取活菌数均为109CFU/mL的菌株种子液各10 mL,接入1 L的液体HJ培养基中进行培养,温度35 ℃,摇床转速120 r/min,起始pH值设置为7.2(本实验室试验优化,适合于3株微生物共发酵),连续培养24 h。于0、4、8、12、16、20、24 h对混合菌液取样并梯度稀释,分别在YPD、MRS、LB固体培养基上进行涂布,记录酵母菌、乳酸菌及芽孢杆菌活菌数。
1.3 复合菌发酵液脱氮试验
在超净台中,将0、4、8、12、16、20、24 h的复合菌发酵液接入50 mL亚硝态氮及氨氮降解培养基中,接种终浓度为5×105CFU/mL,对照组为空白,重复试验次数为3。30 ℃、180 r/min,培养24 h后进行取样测定。均匀吸取培养液1.5 mL至离心管中,12 000 r/min离心3 min,取上清200L加入96孔板,于550 nm比色测亚硝态氮浓度、450 nm比色测氨氮浓度。
应该多开通去这里的航班。美国北加利福尼亚沿海紫海胆泛滥成灾,摧毁了那里的巨藻林,而巨藻林的消失则意味着生态系统的崩溃,许多人的生计因此受到威胁。看来中国游客还不够多,才有了这后果。
1.4 复合菌发酵液的产酶、抑菌试验
产酶功能分析:用接种环取枯草芽孢杆菌M7-1及复合菌发酵液(HJ培养基,发酵20 h),分别点接在蛋白酶、淀粉酶、纤维素酶指示平板上,35 ℃培养20 h后,游标卡尺分别测定透明圈直径2及菌落直径1,计算2与1的比值(酶的相对活性)[12]。
抑菌功能分析:选用国标滤纸片法进行功能菌株的抑菌试验[13]。指示菌为经过37 ℃培养12 h的副溶血弧菌(实验室保藏),将其与生理盐水 1:9稀释,涡旋器混匀后涂布TCBS平板,加入载有屎肠球菌SC-01(HJ培养基,发酵20 h)、复合菌发酵液(发酵20 h)的滤纸片。37 ℃培养24 h,观察指示菌生长情况,游标卡尺测量抑菌圈直径。
1.5 复合菌发酵液培藻试验
取10 mL小球藻培养基到1 000 mL水中配制培藻试验基础培养基,灭菌后待用。设置空白对照组(培藻试验基础培养基)和试验组(在培藻试验基础培养基中加入0、4、8、12、16、20、24 h的复合菌发酵液),重复试验次数为3,接种终浓度为105CFU/mL。试验前同时加入1万个/mL的小球藻液体(实验室保藏)。光照2 000 lx,温度25 ℃条件下,培养72 h,培养过程中每隔4 h摇晃15次。分别从瓶中取10 mL样品进行叶绿素a质量分数的测定。
1.6 复合菌发酵液的诱食、健肠试验
选择300尾体质量为15 g左右的健康南美白对虾(正大集团,海南,中国)作为试验对象,试验共分5组(4个处理组及1个空白对照组),每组3个重复,每个重复20尾虾。参照专利《一种水产动物诱食剂的筛选方法》制备有色食丸[14],食丸分别添加1%的20 h复合菌发酵液、1%的20 h酿酒酵母菌NJ-02发酵液(HJ培养基)、1%的二甲基--丙酸噻亭(dimethyl-beta-propiothetin hydrochloride,DMPT)、1%的氧化三甲胺(trimetlylamine oxide,TMAO),同时投入水池同一位置,投入食丸10 min后,统计南美白对虾对不同颜色食丸的捕获与采食数量,依统计结果判断试验品的诱食性能。
饲喂食丸2 d后无菌解剖对虾,取出肠道,研磨后分别梯度稀释涂布MRS、YPD平板,进行乳酸菌、酵母菌活菌计数。
1.7 分析方法
亚硝态氮浓度测定采用N-(1-萘基)-乙二胺光度法,氨氮浓度测定采用纳氏试剂方法,叶绿素-a测定采用分光光度法[15]。
基础数据处理、显著性差异分析基于SAS (statistical analysis systems)统计软件,<0.05表示差异显著。
2 结果与分析
2.1 复合菌发酵活菌数及pH值变化
复合菌发酵活菌数结果如图1所示,可知3株菌共培养在4~10 h分别进入对数生长期,并于12~20 h酵母菌、乳酸菌及芽孢杆菌活菌数先后达到峰值,分别为3.88×108、2.41×1010、5.38×109CFU/mL。而后,逐渐进入生长平台期,活菌数趋于稳定。复合菌发酵的pH值呈现出先降低而后回升的趋势,发酵至12 h 时pH值回升至最高值6.34,而后发生回落。
通过结晶紫染色镜检观察复合菌发酵液可知,共培养16 h后,3株益生菌共生良好,显微镜镜检可同时观察到屎肠球菌SC-01、枯草芽孢杆菌M7-1及酿酒酵母菌NJ-02(图2)。
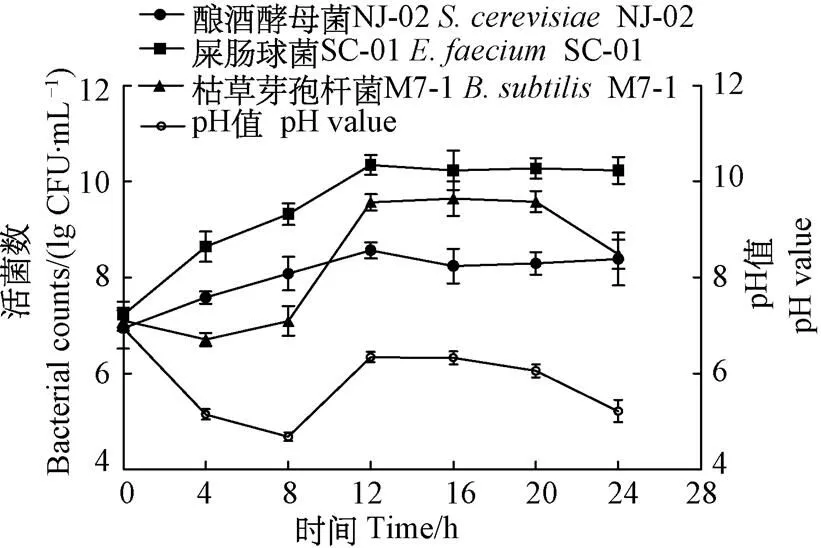
图1 复合菌发酵活菌数及pH值变化曲线
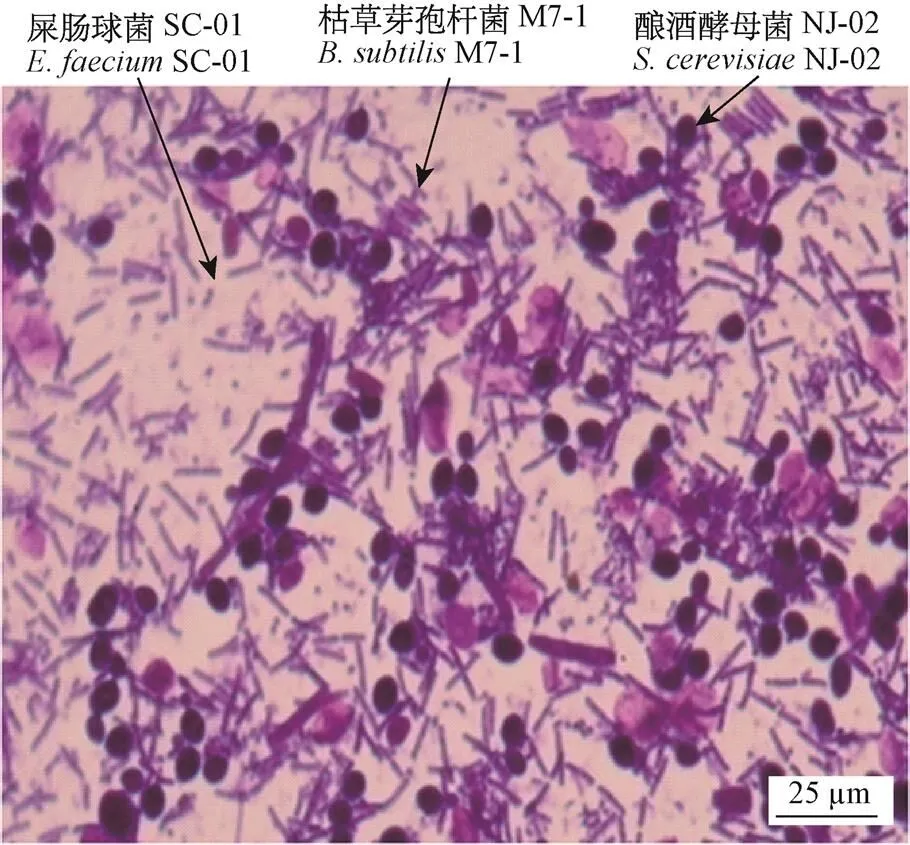
图2 复合菌发酵液显微镜镜检图(16 h,结晶紫染色,放大倍数:60×10)
本试验中选择了酿酒酵母菌NJ-02、屎肠球菌SC-01及枯草芽孢杆菌M7-1进行共发酵研究,这些菌株分别具有产酸、产多糖、脱氮、产酶、抑菌等方面的功能,但是在发酵过程中酵母菌、乳酸菌及芽孢杆菌偏好的最适pH值、培养温度等条件都是不同的[16]。本试验中,应用的培养基经过反复优化,并全程监控发酵过程,以保障这3株活菌的共生性,3株益生菌接种后,乳酸菌首先实现了快速生长,主要是由于试验中应用的屎肠球菌SC-01为经过紫外诱变过的菌株,pH值适应性强、生长快速,其快速生长导致pH值下降,出现了适应酵母菌增殖的酸性条件[17],从而促进了酿酒酵母菌NJ-02(适合于偏酸性环境)的生长。枯草芽孢杆菌M7-1的生长或许同发酵体系中微生物在生长过程中产生的代谢产物有关,这些代谢产物可成为微生物生长的基质及原料,存在一种共生增殖关系,促进了彼此的生长[18]。连续发酵24 h后,酿酒酵母菌NJ-02、屎肠球菌SC-01及枯草芽孢杆菌M7-1活菌数分别达到了3.88×108、2.41×1010、5.38×109CFU/mL。以往的研究中,Manoj等应用优化的培养基,将spp.和共培养,得到了较高的生物量[19]。在不同种属微生物共发酵方面,Liu等应用及共培养处理乳酸菌发酵废水,结果表明2种微生物生长良好,同单菌相比,复合菌发酵大幅度的降低了废水中总有机碳(total organic carbon,TOC)及总氮(total nitrogen,TN)浓度[20]。Pablo等将酵母菌及乳酸细菌进行共培养,监测其生长及代谢产物产生情况,发现菌种的混合发酵提升了乳酸菌及酵母菌活菌数,而且影响了代谢产物的产生情况[21]。本试验中将乳酸菌、芽孢杆菌及酵母菌进行共发酵培养,应用优化后的培养基,全程监控活菌数及pH值,共培养的3株菌都达到了较高的活菌数,复合菌发酵菌株的共生性较好。
2.2 复合菌发酵液脱氮性能分析
不同时间复合菌发酵液降解亚硝态氮及氨氮试验结果如图3所示。复合菌发酵液对亚硝态氮的降解率呈现出先下降后上升的趋势,16 h的复合菌发酵液亚硝态氮降解率达到峰值(降解率达到89%),复合菌中降解亚硝态氮的菌株为枯草芽孢杆菌M7-1,这同芽孢杆菌的生长曲线一致;不同时间复合菌发酵液对氨氮降解率则一直处于上升状态,20 h的复合菌发酵液对氨氮降解率也达到峰值(降解率达到94%),复合菌中酵母菌、乳酸菌及芽孢杆菌都可利用氨氮,因此氨氮的降解一直呈现上升趋势。芽孢杆菌在水产养殖中应用已经较为普遍,其中枯草芽孢杆菌地衣芽孢杆菌、凝结芽孢杆菌等都具有较好的生物脱氮活性[22-24],Huang等研究一株从海水养殖样本中分离的异养硝化-好氧反硝化海滨芽孢杆菌()时发现,该芽孢杆菌能够在42 h完成水体中氨氮、亚硝态氮的脱除,降解率分别为86.3%和89.3%[5],可能是由于菌种的差异导致同本试验中氨氮、亚硝态氮降解率有所区别。Song等研究发现,分离的枯草芽孢杆菌YX-6对亚硝态氮降解率在培养16 h达到峰值[25]。这同本研究的脱氮曲线类似,说明复合菌发酵液具备较好的脱氮功能。
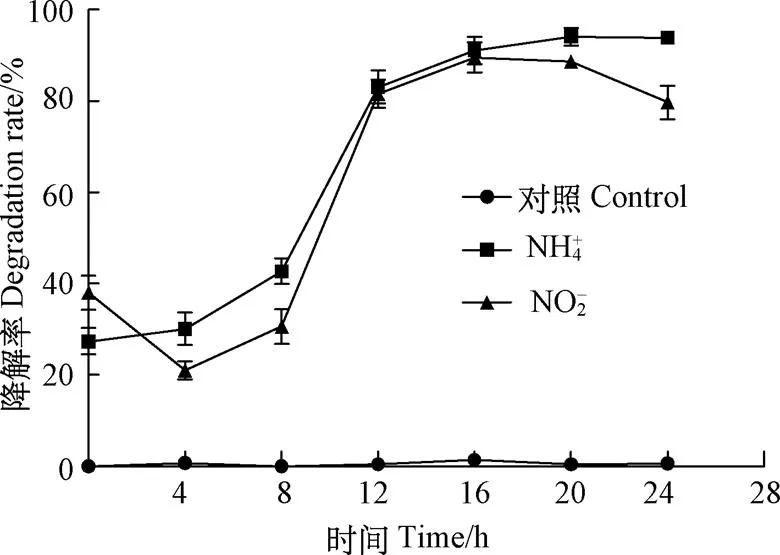
图3 不同时间复合菌发酵液氨氮、亚硝态氮降解率
2.3 复合菌发酵液酶活性及培藻性能分析
复合菌发酵中选择的3株益生菌中枯草芽孢杆菌M7-1功能为生物脱氮和产胞外复合酶(表1),其他2株益生菌的功效为诱食及拮抗病原菌,复合菌发酵液的胞外酶活性主要由菌株枯草芽孢杆菌M7-1产生,故而本试验选择枯草芽孢杆菌M7-1同复合菌发酵液进行酶活性对比试验。枯草芽孢杆菌M7-1及复合菌发酵液蛋白酶、淀粉酶及纤维素酶活性分析结果如表2所示,通过分析数据可知,复合菌发酵液具有同枯草芽孢杆菌M7-1相当的酶活性,能够较好的分解蛋白质、淀粉及纤维素类物质。
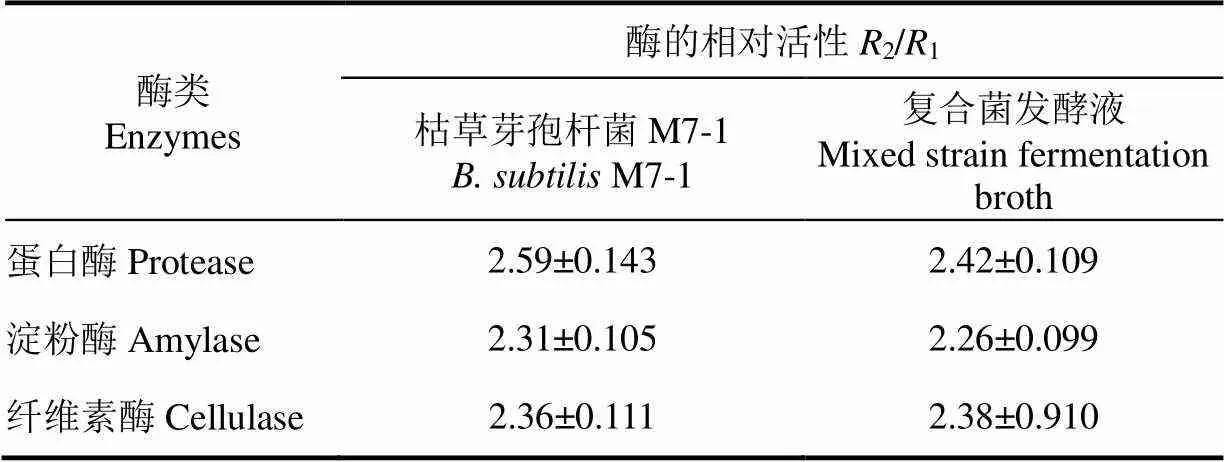
表2 枯草芽孢杆菌M7-1及复合菌发酵液酶活性的测定结果
如图4可知,不同时间复合菌发酵液处理组叶绿素-a含量都高于对照组,这同发酵液中益生菌分解大分子,产生易于小球藻利用的小分子物质有关[26-27]。且随时间推移,复合菌发酵液的培藻效果处于上升趋势,16 h的复合菌发酵液培藻效果最为理想,小球藻叶绿素a质量分数提升了49.6%。Hirata等研究发现,在鲤鱼养殖池塘中添加产酶益生菌后,同对照组相比,可明显观察到水色更绿,检测到小球藻含量明显升高,养殖的鲤鱼质量增加30%[28]。本研究中,枯草芽孢杆菌M7-1具有较好的产酶活性(表2),能够快速高效地分解有机质,促进物质的循环,提供小球藻生长所需要的营养物质。
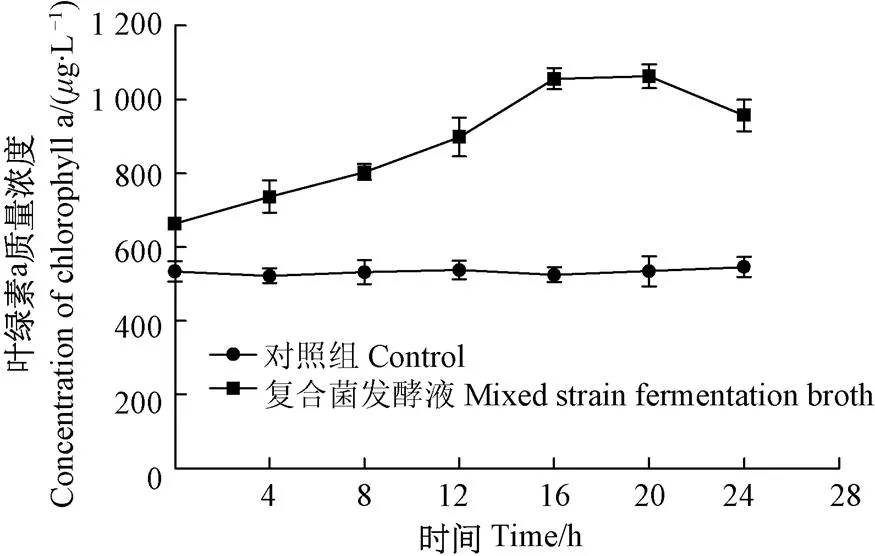
图4 不同发酵时间小球藻叶绿素a质量浓度
2.4 复合菌发酵液的诱食效果分析
如图5所示,统计诱食试验剩余食丸数发现,复合菌发酵液剩余食丸显著低于酵母菌组、氧化三甲胺(trimetlylamine oxide,TMAO)处理组及空白对照组,同化学诱食剂二甲基--丙酸噻亭(dimethyl-beta- propiothetin hydrochloride,DMPT)处理组剩余数目相当,其诱食效果显著高于对照组(图5)。
不同于陆生动物,水产动物处于水环境中,饵料投入水中后即开始了溶失,这不仅浪费了宝贵的饲料资源,而且严重污染水体环境。因此,需在饲料中添加能促进水产动物摄食的物质(即诱食剂)[29]。目前,市场上水产诱食剂主要分为如下几种:氨基酸类、动植物提取物、生物碱、含硫化合物、中药类、脂肪酸等[30]。而化学诱食剂如DMPT、TMAO等诱食效果突出,但成本较高,因此,开发绿色、廉价的生物水产诱食剂是必要的。以往的研究中,应用甜菜碱、牛磺酸、酵母提取物等作为诱食物质,促进水产动物摄食取得理想的结果[31-32]。陈昌福等研究发现,饵料中添加2 000 mg/kg的酵母水解物(富含核苷酸)后,中华鳖的摄食速度提升了 39.2%、摄食量提高了34.8%[33]。另有试验表明,将不同种类诱食剂进行复配,能够起到协同增效的作用,复合诱食剂(甜菜碱∶DMPT∶盐酸三甲胺∶柠檬酸∶甘氨酸∶牛磺酸:谷氨酸钠=5∶2∶10∶1∶1∶1∶1)按1%的比例添加到饲料中,结果表明,同对照相比能够明显提升牙鲆对饲料的摄食率,促进了牙鲆的生长[34]。本研究中,复合菌发酵液中的酿酒酵母菌NJ-02能够产生诱食核苷酸,同时屎肠球菌SC-01能够产生诱食氨基酸、有机酸等。含有多种诱食组分使得复合菌发酵液诱食效果优于酿酒酵母菌NJ-02,具备开发成为生物诱食剂的潜力。

Note: DMPT: Dimethyl-beta-propiothetin hydrochloride; TMAO: Trimetlylamine oxide; Different letters mean significantly different (P<0.05).
2.5 复合菌发酵液的抑菌、健肠效果分析
复合菌发酵中选择的3株益生菌中屎肠球菌SC-01功能主要为拮抗病原菌(表1),其他2株益生菌的功效主要为生物脱氮、分泌胞外酶及提升养殖动物免疫力,复合菌发酵液的抑菌功能主要由菌株屎肠球菌SC-01产生,故而本试验选择屎肠球菌SC-01同复合菌发酵液进行抑菌活性对比试验。屎肠球菌SC-01及复合菌发酵液抑菌活性分析结果如表3所示,通过分析数据可知,复合菌发酵液具有同屎肠球菌SC-01相当的抑菌活性,能够较好的抑制副溶血弧菌生长。
复合菌发酵液、酵母菌发酵液、DMPT、TMAO投喂处理组及空白对照组对虾肠道中乳酸菌和酵母菌活菌计数如图6所示,由图可知,应用复合菌发酵液拌料2 d后,对虾肠道中乳酸菌、酵母菌活菌数显著高于化学诱食剂及空白对照组。

表3 屎肠球菌SC-01及复合菌发酵液抑菌活性
注:“+++”表示抑菌作用显著,抑菌圈≥12 mm.
Note: “+++” : Inhibition zone≥12 mm (Significant inhibition).
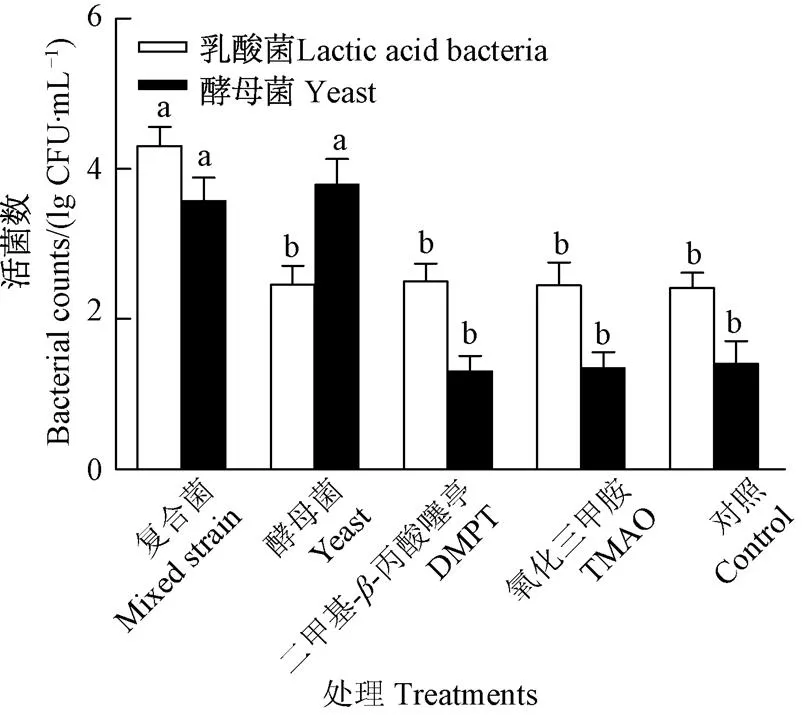
图6 对虾肠道中乳酸菌及酵母菌计数
作为水产养殖中广泛应用的益生菌,屎肠球菌能够调节水产动物肠道菌群平衡、拮抗病原菌,酿酒酵母菌能够提升水产动物免疫力、降低疾病发生[35]。已有研究表明,副溶血弧菌为对虾早期死亡综合征(early mortality syndrome,EMS)的主要病原菌,席卷全球的EMS给对虾养殖业造成了重大损失[36]。对虾肠道中存活的乳酸菌能够分泌乳酸,酸化肠道,降低pH值,而导致对虾EMS发生的病原菌—副溶血弧菌在酸性条件下生长会受到抑制[37]。已有研究表明,多数屎肠球菌具有较好的抑菌活性,作为益生菌制剂在人类医学上用来拮抗肠聚集性大肠杆菌[38]。Sun等于石斑鱼肠道中分离得到一株具有拮抗,及的屎肠球菌MM4,该菌能够显著提升石斑鱼免疫性能及生长性能[39]。此外,对虾肠道中的酵母菌能够提高对虾的免疫力,降低对虾发病[40]。He等研究表明,应用酿酒酵母菌后显著的提升了罗非鱼免疫性能[41]。Huang等研究发现日粮中添加1 g/kg Saccharoculture(包含活菌J 8734)可以明显提升鲤鱼肠道绒毛高度及免疫活性[42]。本试验中复合菌发酵液中的屎肠球菌SC-01具有良好的抑制副溶血弧菌活性(表3)、酿酒酵母菌NJ-02具有潜在的免疫提升活性,复合菌发酵液或许能够在提升对虾抗弧菌感染方面发挥较好作用。
3 结 论
脱氮、产酶、抑菌等性能优良的3株酵母菌、乳酸菌及芽孢杆菌能够在同一培养基HJ下共培养,连续发酵24 h,活菌数分别达到3.88×108、2.41×1010、5.38× 109CFU/mL,具备理想的脱氮、培藻性能(亚硝态氮降解率89%、氨氮降解率94%、小球藻叶绿素a质量分数提升49.6%),及同枯草芽孢杆菌M7-1、屎肠球菌SC-01相当的产酶、抑菌活性。饲喂对虾,显示出同化学诱食剂相当的诱食效果以及良好的肠道菌群调控作用。
综上,本研究成功制备了具备脱氮、培藻、抑菌及生物诱食健肠等多方面功能的复合菌发酵液。该复合菌发酵液有望应用于水产养殖中,改善水质、促进动物摄食、保持肠道健康,降低抗生素及化学药品等的应用,为水产养殖业绿色健康可持续的发展提供了新的微生物资源和方法。
[1] 农业部渔业渔政管理局.2018中国渔业统计年鉴[R].北京:中国农业出版社,2018.
[2] Liu Xiao, Steele J C, Meng Xiangzhou. Usage, residue, and human health risk of antibiotics in Chinese aquaculture: A review[J]. Environmental Pollution, 2017, 223: 161-169.
[3] He Zhengxiang, Cheng Xiangrong, Kyzas G Z, et al. Pharmaceuticals pollution of aquaculture and its management in China[J]. Journal of Molecular Liquids, 2016, 223: 781-789.
[4] Zhao Yanting, Zhang Xuxiang, Zhao Zhonghua, et al. Metagenomic analysis revealed the prevalence of antibiotic resistance genes in the gut and living environment of freshwater shrimp[J]. Journal of Hazardous Materials, 2018, 350: 10-18.
[5] Huang Fei, Pan Luqing, Lü Na, et al. Characterization of novelstrain N31 from mariculture water capable of halophilic heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 2017, 124 (5): 564-571.
[6] Wan Wenjie, He Donglan, Xue Zhijun. Removal of nitrogen and phosphorus by heterotrophic nitrification-aerobic denitrification of a denitrifying phosphorus-accumulating bacteriumHW-15[J]. Ecological Engineering, 2017, 99: 199-208.
[7] Wang Anran, Ran Chao, Wang Yanbo. Use of probiotics in aquaculture of China: A review of the past decade[J]. Fish and Shellfish Immunology, 2019, 86: 734-755.
[8] He Ruipeng, Feng Jie, Tian Xiangli, et al. Effcts of dietary supplementation of probiotics on the growth, activities of digestive and non-specifi immune enzymes in hybrid grouper (male×female)[J]. Aquaculture Research, 2017, 48 (12): 5782-5790.
[9] Wu Zhuoqi, Jiang Chao, Ling Fei, et al. Effcts of dietary supplementation of intestinal autochthonous bacteria on the innate immunity and disease resistance of grass carp ()[J]. Aquaculture, 2015, 438: 105-114.
[10] Li Jianguang, Xu Yongping, Jin Liji, et al. Effcts of a probiotic mixture (YB-1 andYB-2) on disease resistance and non-specifi immunity of sea cucumber,(Selenka)[J]. Aquaculture Research, 2015, 46 (12): 3008-3019.
[11] Hao Kai, Liu Jiayan, Ling Fei, et al. Effcts of dietary administration ofD4,D7 andD15, single or combined, on the growth, innate immunity and disease resistance of shrimp,[J]. Aquaculture, 2014, 428/429: 141-149.
[12] 张纪忠.生物分类学[M].上海:复旦大学出版社,1990.
[13] 黄秀梨.微生物学[M].北京:高等教育出版社,1998.
[14] 蔡春芳,叶元土.一种水产动物诱食剂的筛选方法[P].200510038890.6,2005-04-12.
[15] 海洋调查规范:GB/T 12763.6-2007 [S].
[16] Holt J. Bergey's Manual of Determinative Bacteriology, Ninth Edition[M]. Philadelphia Lippincott: Williams & Wilkins, 1994.
[17] 贺银凤.传统发酵乳制品中乳酸菌和酵母菌的互作关系[J].中国乳品工业,2010,38(10):43-45. He Yinfeng. Interaction between lactic acid bacteria and yeastsin traditional fermented milks[J]. Dairy Industry, 2010, 38(10): 43-45. (in Chinese with English abstract)
[18] 张克强,野李.复合枯草芽孢杆菌和乳酸菌微生物制剂的制备方法[P].200510136003.9,2005-12-28.
[19] Manoj J, Prasanna D, Larysa B, et al. Multi strain probiotic production by co-culture fermentation in a lab-scale[J]. Engineering in Life Sciences, 2016, 16(3): 247-253.
[20] Liu Jiyun, Shi Peifu, Ahmad S, et al. Co-culture ofandefficiently treatsfermentation wastewater[J]. AMB Express, 2019, 9(1): 15-21.
[21] Pablo Á M, Ana B F, Ana H B, et al.Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J]. Food Control, 2008, 19(1): 62-70.
[22] Arig N, Suzer C, Gokvardar A, et al. Effects of probioticsp) supplementation during larval development of gilthead sea bream ()[J]. Turkish Journal of Fisheries & Aquatic Sciences, 2013, 13(3): 407-414.
[23] Nimrat S, Suksawat S, Boonthai T, et al. Potentialprobiotics enhance bacterial numbers, water quality and growth during early development of white shrimp ()[J]. Veterinary Microbiology, 2012, 159 (3/4): 443-450.
[24] Zokaeifar H, Babaei N, Che R S, et al. Administration ofstrains in the rearing water enhances the water quality, growth performance, immune response, and resistance againstinfection in juvenile white shrimp,[J]. Fish & Shellfish Immunology, 2014, 36 (1): 68-74.
[25] Song Zengfu, An Jian, Fu Guanghui, et al. Isolation and characterization of an aerobic denitrifyingsp. YX-6 from shrimp culture ponds[J]. Aquaculture, 2011, 319 (1): 188-193.
[26] Ferrier M, Martin J L, Rooney-Varga J N. Stimulation of Alexandrium fundyense growth by bacterial assemblages from the Bay of Fundy [J]. Journal of Applied Microbiology, 2002, 92(4): 706-716.
[27] Guillermo Q, Juan S A, Germán B. Microalgal-bacterial aggregates: Applications and perspectives for wastewater treatment[J]. Biotechnology Advances, 2017, 35(6): 772-781.
[28] Hirata H, Tei T, Niiro M. Effects of probiotic additive feeding on water quality an algal growth potential in an culture of the Carp[J]. Memoirs of the Faculty of Agriculture of Kinki University, 2001, 34: 89-93.
[29] 罗实亚.诱食剂在水产养殖中的应用研究进展[J].贵州农业科学,2012,40(9):183-185. Luo Shiya. Research progress of application of attractant in aquaculture[J]. Guizhou Agricultural Sciences, 2012, 40(9): 183-185. (in Chinese with English abstract)
[30] 王安利,苗玉涛,王维娜,等.水产动物诱食剂的研究进展[J].中国水产科学,2002,9(3):265-268. Wang Anli, Miao Yutao, Wang Weina, et al. Research progress on feed attractant for aquatic animals[J]. Journal of Fishery Sciences of China, 2002, 9(3): 265-268. (in Chinese with English abstract)
[31] Felix N, Sudharsan M. Effect of glycine betaine, a feed attractant affecting growth and feed conversion of juvenile freshwater prawn[J]. Aquaculture Nutrition, 2015, 10(3): 193-197.
[32] Hartati R, Briggs M R P. Effect of feeding attractants on the behaviour and performance of juvenileFabricius[J]. Aquaculture Research, 2010, 24(5): 613-624.
[33] 陈昌福,王绍辉,王茜,等.饵料中添加酵母水解物对中华鳖成鳖的诱食效果[J].养殖与饲料,2007(4):54-56.
[34] 陈京华,张文兵,麦康森,等.复合诱食剂对牙鲆摄食生长的影响[J].中国水产科学,2006,13(6):959-965. Cheng Jinghua, Zhang Wenbing, Mai Kangsen, et al. Effects of a compound feeding attractant on feed intake and growth of Japanese flounder(Temminck et Schlegel)[J]. Journal of Fishery Sciences of China, 2006, 13(6): 959-965. (in Chinese with English abstract)
[35] Wang A R, Ran C, Wang Y B, et al. Use of probiotics in aquaculture of China: A review of the past decade[J]. Fish & Shellfish Immunology, 2018, 86: 734-755.
[36] Leaño E M, Mohan C V. Early mortality syndrome threatens Asia’s shrimp farms[J]. Global Aquaculture Advocate, 2012, 2012(7/8): 38-39.
[37] Vanderzant C, Nickelson R. Survival ofin shrimp tissue under various environmental conditions[J]. Journal of Applied Microbiology, 1972, 23(1): 34-37.
[38] Miyazaki Y, Kamiya S, Hanawa T, et al. Effect of probiotic bacterial strains of,, andenteroaggregative[J]. Journal of Infection & Chemotherapy, 2010, 16(1): 10-18.
[39] Sun Yunzhang, Yang Hongling, Ling Zechun, et al. Gut microbiota of fast and slow growing grouper[J]. African Journal of Microbiology Research, 2009, 3 (11): 713-720.
[40] Deng Deng, Mei Chengfang, Mai Kangsen, et al. Effects of a yeast-based additive on growth and immune responses of white shrimp,(Boone, 1931), and aquaculture environment[J]. Aquaculture Research, 2013, 44(9): 1348-1357.
[41] He Suxu, Zhou Zhigang, Liu Yuchun, et al. Effects of dietaryfermentation product (DVAQUA*) on growth performance, intestinal autochthonous bacterial community and non-specific immunity of hybrid tilapia (♀×♂) cultured in cages[J]. Aquaculture, 2009, 294(1): 99-107.
[42] Huang Lu, Ran Chao, He Suxu, et al. Effects of dietaryculture or live cells withspores on growth performance, gut mucosal morphology, hsp70 gene expression, and disease resistance of juvenile common carp ()[J]. Aquaculture, 2015, 438: 33-38.
Functional properties of mixed probiotics fermentation broth and its feeding attractant effects
Li Yan1, Ma Qingshan2※
(1.(),,266003,; 2.,,266003,)
With the rapid development of aquaculture farming industries, high density farming techniques are now widely adopted in China, facilitated by a raft of approaches including oxygenation enhancement, intensive feeding and the frequent addition of antibiotics for disease control. Such intensive industrialized farming methods have improved yields from aquatic farming of animals. As repeatedly noted, they may also lead to the buildup of unused feed, excreta and other biological residues, as well as the accumulation of harmful chemicals such as nitrite, and the application of chemical drugs and antibiotics has led to the proliferation of harmful and resistant bacteria and harmful algae, meanwhile, drug residues also affect the products quality and aquatic animals safety. Probiotics, such as,lactic acid bacteria and yeast have been widely used in aquaculture and yielded beneficial effects, mainly in improving water quality, growth performance and reducing the mortality rate by degradation nitrite, inhibiting pathogens, regulating intestinal flora and stimulating the immune system. It is well known that different types of probiotics can express different functions, such as denitrification, enzyme production and antibacterial activity. Mixed strain fermentation, giving multiple functions of fermentation broth, which can reduce production cost, simplify the process and broaden the application range. In this study, we explored the feasibility of multi-functional mixed strain fermentation, 3 strains of probiotics included yeast, lactic acid bacteria andwith excellent performances (NJ-02: producing exopolysaccharide, vitamin, nucleotide, etc;SC-01: producing acetic acid, lactic acid and other organic acids, inhibition of pathogens;M7-1: degradation of ammonia nitrogen and nitrite nitrogen, producing extracellular enzymes). After 24 h incubations, the number ofNJ-02,SC-01 andM7-1 viable bacteria counts reached 3.88×108, 2.41×1010, and 5.38×109CFU/mL, respectively. The results also showed that the biological denitrification and promoted algae () growth performance of the mixed fermentation broth were directly related to the number ofM7-1 viable bacteria. Further into the process, it was observed that 16 h was the best fermented time for degradation nitrite and algae cultivation. It also showed that the nitrite nitrogen degradation rate reached 89% and thechlorophyll-a concentration increased by 49.6%. Additionally, mixed strain fermentation broth showed the same enzymatic activity (protease, amylase, cellulase) and antibacterial activity () when it was compared toM7-1 andSC-01. Furthermore, the feeding attractant effect was significantly improved than that of the control group and chemical attractanttrimethylamine oxide (TMAO) (<0.05), and was equivalent to that of dimethyl-beta-propiothetin(DMPT) based on the feeding behavior of shrimp.The number oflactic acid bacteria and yeast in shrimp intestinal tract was significantly higher (<0.05) than that of the control group and the chemical attractant group. In summary, we obtained multi-functional mixed strain fermentation broth such as biological denitrification, promoting algae cultivation, antibacterial activity and biological attractant, this fermentation broth was expected to be used in aquaculture to improve water quality, enhance animal appetite and feed intake and maintain intestinal health. The study provides a microbial resource and technical method for sustainable ecological aquaculture.
fermentation; denitrification; enzymatic activity; antibacterial activity; attractant effect
2019-03-19
2019-07-28
广西科技重大专项项目“广西主导与特色水产品种生态养殖模式与技术创新(AA17204095-11)”
李 艳,博士后,主要从事水产动物肠道健康研究。Email: liyan-602@163.com
马青山,博士,主要从事海洋微生物与营养代谢相关研究。 Email: horsegreenhill@163.com
10.11975/j.issn.1002-6819.2019.16.027
Q939; S96
A
1002-6819(2019)-16-0242-07
李 艳,马青山.复合益生菌发酵液的功能特性及对对虾诱食效果[J]. 农业工程学报,2019,35(16):242-248. doi:10.11975/j.issn.1002-6819.2019.16.027 http://www.tcsae.org
Li Yan, Ma Qingshan.Functional properties of mixed probiotics fermentation broth and its feeding attractant effects[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(16): 242-248. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.16.027 http://www.tcsae.org
