增强UV-B辐射对拟南芥fas1突变体的影响
2019-10-09李婷韩榕
李婷 韩榕
摘要 随着臭氧层的变薄和臭氧空洞的出现,到达地球表面的 UV-B 辐射明显提高,对生物的生长和发育产生了一定的影响。拟南芥中fas1同源物的敲除也没有使其出现致死表型, 植物仍然能够存活, 只是在胚后器官发生时出现缺陷, 如激活其顶端分生组织处的沉默基因, 导致茎干宽扁, 相应的叶序和花序结构紊乱。因此, fas1能够稳定异染色质, 使其中的基因保持沉默。以野生型和fas1 突变体拟南芥为材料,对比了不同条件下野生型和 fas1突变体拟南芥的发芽势和发芽率、根长以及根尖分生区有丝分裂细胞的末期,结果表明在正常生长条件下WT和 fas1 突变体的发芽势和发芽率、根长以及根尖分生区细胞在有丝分裂末期的形态都没有显著差异。而在 UV-B 辐射条件下,对比不同组之间的发芽势和发芽率、根长,结果表明,WT+UV-B 组低于 WT 组,fas1+UV-B 组低于fas1组,fas1+UV-B 组低于 WT+UV-B 组,且差异均达到显著水平。此外,在UV-B 辐射条件下,观察到在 fas1+UV-B 组中,有丝分裂也表现出一定的异常现象。这些结果表明,fas1基因功能的缺失可能是导致fas1 突变体对 UV-B 胁迫敏感的诱因之一。
关键词 UV-B;fas1;拟南芥
中图分类号 Q947.9 文献标识码 A
文章编号 0517-6611(2019)17-0001-04
Abstract With the thinning of the ozone layer and the emergence of ozone holes, the UVB radiation reaching the Earths surface is significantly increased, which has a certain impact on the growth and development of organisms. The knockout of the fas1 homolog in Arabidopsis thaliana did not cause a lethal phenotype, and the plant was still alive, only when the postembryonic organ developed defects, such as activation of the silencing gene at its apical meristem, resulting in stem wide and flat, the corresponding leaf order and inflorescence structure were disordered. Therefore, fas1 was able to stabilize heterochromatin and kept the genes in silent. In this paper, the wildtype and fas1 mutants A.thaliana were used as experimental materials to compare the germination potential and germination rate, root length and the terminal phase of mitotic cells in the wildtype and fas1 mutant A.thaliana under different conditions. The results showed that there was no significant difference in germination potential,germination rate, root length and morphology of apical meristem cells at the end of mitosis under normal growth conditions. Under UVB radiation conditions, the germination potential,germination rate and root length between different groups were compared. The results showed that the WT+UVB group was lower than the WT group, the fas1+UVB group was lower than the fas1 group,the fas1+UVB group was lower than the WT+UVB group,the differences reached a significant level. In addition, under UVB radiation conditions, it was observed that mitosis also showed some anomalies in the fas1+UVB group. These results suggested that the loss of fas1 gene function may be one of the incentives for fas1 mutants to be sensitive to UVB stress.
Key words UVB;fas1;Arabidopsis thaliana
太陽光是地球能量的主要来源,而大气平流层中的臭氧层可以吸收太阳光中的紫外线。20世纪以来,由于排放到大气中的氯氟烃以及其他氮化物(如N2O等)增加,引起臭氧层的破坏,已成为人类面临的重大环境问题之一。臭氧层变薄及臭氧空洞的出现[1],导致到达地面的太阳紫外线辐射增强;且平流层中O3每减少1%,到达地面的太阳紫外线辐射增加2%[2]。太阳紫外线(ultraviolet,UV)按波长大小分为3种:UV-A(315~400 nm)、UV-B(280~315 nm)以及UV-C(100~280 nm)。由于臭氧层变薄,因而到达地面的UV-B辐射增强,会危害陆地植物。尽管UV-B是太阳光中最少的成分,其在到达地表的光中占不到0.5%,但它是太阳光光谱中能量最高的,对生物有十分重要的影响[3]。
在植物利用太阳光进行光合作用的同时,它们也经受UV-B辐射的增强,这种能量辐射对植物形态学建成、生理及物质代谢、细胞骨架和细胞周期都有重要影响。增强UV-B辐射后,小麦幼苗叶片和根中微管蛋白含量减少,根尖细胞中微管周期虽然存在,但其结构紊乱,纺锤体微管损伤严重影响染色体与纺锤体的结合,干扰染色体的迁移等;此外,在根尖细胞有丝分裂末期分裂异常,出现多核细胞,这可能与形成细胞板的成膜体微管异常相关[4]。增强UV-B辐射还导致拟南芥叶片变黄,叶片表面积减小,叶片边缘卷曲;根长的生长已受到抑制[5]。在其他研究中还发现,增强UV-B辐射可以导致不同类型的DNA损伤,如形成嘧啶二聚体(CPDs)、6-4光产物等,进而表现为染色体的异常分裂[6]。UV-B辐射会影响植物的生长发育、生理生化过程以至整个地球生态系统,并造成农作物减产[7]。目前,国内外对紫外线增强后植物的响应及其分子机理研究不断深入,研究材料主要有大豆[8]、小麦[9]、水稻、玉米[10]等重要经济(粮食)作物及其他植物。研究发现UV-B辐射增加将会对植物的生长发育产生一定的影响[11-13]。
染色质组装因子1(chromatinassembly factor 1,CAF-1) 最先是从人类细胞中分离而来的,它由p150、 p60和 p48 这3个亚基组成, 在进化上高度保守,广泛存在于从酵母到人类等各种生物体中[14-16]。 在DNA 复制和修复过程中, CAF-1 三聚复合体可使组蛋白 H3和H4 沉积到新合成的 DNA 上。目前, 在体外系统中有关 CAF-1 在染色质组装时的功能研究有较多报道, 但其在体内对生物发育过程影响的相关研究较少。酵母中的CAF-1 由 CAC1(chromatin assembly complex 1)、CAC2 和 CAC3 組成。研究表明,CAC基因并不影响酵母的存活, 但是其中任何一个基因的缺失都会增加酵母对紫外辐射的敏感性, 且会激活端粒 DNA 侧翼基因, 使其不再沉默。 在拟南芥中, CAF-1 的同源蛋白质有 FAS1(fasciata 1)、FAS2和 MSI1(multicopy suppressor of IRA1)。与酵母中的研究结果相似, 拟南芥中 CAF-1 同源物的敲除也没有使其出现致死表型, 植物仍然能够存活, 只是在胚后器官发生时出现缺陷, 如激活其顶端分生组织处的沉默基因, 导致茎干宽扁, 相应的叶序和花序结构紊乱。因此, CAF-1 能够稳定异染色质, 使其中的基因保持沉默[17]。
在酵母和拟南芥中, CAF-1 敲除都没有导致植物出现致死表型的现象, 似乎说明 CAF-1 对于真核生物的发育并非必不可少。然而, 近期对动物的研究却表明, CAF-1 对动物的发育是必需的。 果蝇中,去除果蝇 dCAF-1 的最大亚基 p180, 导致突变体发育至幼虫期后死亡, 去除母型 dCAF-1 p180 的活性导致卵子发生受阻。进一步研究发现, dCAF-1 对于果蝇幼虫的核内周期(endocycle)是必需的[17]。 在斑马鱼中, CAF-1 的中等亚基 CAF-1b 的活性降低, 导致细胞周期进程和细胞分化异常以及某些器官发育障碍, 特别是视网膜、顶盖、胸鳍和头骨等的发育出现缺陷。视网膜前体细胞停滞在细胞周期的 S 期, 之后这些细胞发生凋亡。由于降低 P53基因的活性可以挽救细胞凋亡但不能挽救细胞分化的缺陷, 因此, CAF-1 的活性对于这些器官中细胞周期的进程和分化起着非常重要的作用。爪蟾 p150活性的降低使得胚胎发育停滞在中囊胚过渡(MBT)之前, 表现为细胞周期进程异常, 说明其对 MBT 之前快速细胞周期的正常进程是必要的[17]。对哺乳动物小鼠的研究表明, 去除 CAF-1 p150 的纯合突变体胚胎发育停止于 16-细胞期, 其中组成型异染色质的组织结构严重改变。因此, CAF-1 对于细胞核中染色体建立正确的空间结构是必需的。
笔者在增强UV-B辐射条件下,以拟南芥野生型Col0和突变体fas1为材料,通过分析发芽率、根长、RT-PCR、根尖分生区有丝分裂,以期探讨fas1基因在拟南芥有丝分裂过程中的功能,为fas1在有丝分裂过程中的机制研究提供参考。
1 材料及方法
1.1 材料 野生型拟南芥(Arabidopsis thaliana,Columbia ecotype)为植物分子与环境胁迫响应山西省高校重点实验室保存。fas1(At1G65470)基因的T-DNA插入突变体fas1,编号为Salk_09467,购自拟南芥资源中心NASC。
1.2 方法
1.2.1 拟南芥的培养。
将拟南芥种子放到离心管中,加适量纯净水,4 ℃冰箱中避光春化3 d后,用1%的NaClO溶液消毒12 min,用无菌水冲洗5次,每次1 min;向离心管中加入0.1%琼脂水使种子悬浮并点种在灭过菌的1/2 MS固体培养基上(2.37 g/L MS 固体粉末,1.5%蔗糖,0.8%琼脂,pH 58~6.0)。对照组转到22 ℃/18 ℃(光照/黑暗)、16 h光照/8 h黑暗,光照强度6 000~8 000 lx 的环境中培养 7 d ;UV-B胁迫处理组,参见文献[14]的方法,具体如下:取正常培养的Col-0和eb1c植株为材料,从点种后第1天开始,转移到紫外灯泡下,每天08:00~10:00在固定计量[2 W/(m2·d)]的紫外强度下处理2 h,其余时间与对照组处理相同。
1.2.2 DNA水平鉴定拟南芥fas1突变体植株。
取拟南芥基部1 cm2大小的健康叶片3~5片,液氮研磨。加400 μL Extraction Buffer混匀,65 ℃温育10 min。加150 μL KAC(3 mol/L,pH4.8),混匀,冰浴20 min。4 ℃ 12 000 r/min 离心10 min,取上清到新离心管。加等体积异丙醇,约400 μL,混匀数次,立即室温14 000 r/min 离心5 min,弃上清留沉淀。沉淀用75%乙醇清洗,室温14 000 r/min 离心5 min,弃上清,倒扣,晾干。加30 μL ddH2O溶解所提DNA。
根据http://signal.Salk.edu/tdnaprimers.2.html网站上查到 Salk_009467的 T-DNA 插入位点信息, 设计基因特异引物fas1-LP和fas1-RP与T-DNA的LBa1.3,引物序列见表1。以基因组DNA为模板,分别以fas1-LP/fas1-RP和LBa1.3/fas1-RP为引物,以Col-0野生型和突变体拟南芥基因组DNA为模板,进行PCR扩增。采用 Easy Taq DNA 聚合酶扩增,扩增体系为20 μL:Taq DNA聚合酶0.1 μL、5×Buffer 2 μL、2.5 mmol/L dNTP 1.6 μL、10 μmol/L fas1-LP/fas1-RP和fas1-RP/LBa1.3各4 μL、模板1 μL、ddH2O 7.3 μL。PCR反应条件为 98 ℃预变性2 min;98 ℃ 10 s,58.8 ℃ 30 s,72 ℃ 1 min 10 s,35个循环后72 ℃延伸10 min,PCR产物用1%的琼脂糖凝胶电泳检测有无目的条带。
1.2.3 RNA水平鉴定拟南芥fas1突变体植株。
采用Trizol法提取拟南芥RNA,具体如下:称取0.1 g拟南芥叶片,液氮研磨,放入1.5 mL的离心管中,加入1 mL Trizol,剧烈振荡15 s,静置10 min。加入预冷的氯仿200 μL,剧烈振荡15 s,静置5 min。4 ℃ 12 000 r/min离心15 min,液体分3层,取最上面一层,加等体积预冷的异丙醇。4 ℃冰箱放置30 min,4 ℃ 12 000 r/min离心10 min,弃上清,留白色膠状沉淀。沉淀用预冷的75%乙醇清洗2次,每次2 min,4 ℃ 7 500 r/min离心5 min。加入30~40 μL的DEPC处理水溶解,并对初步提取的RNA用NanoDrop测量浓度并跑胶。取20~50 μg 进行纯化处理后加30~40 μL的DEPC处理水溶解,并用反转录试剂盒反转录为cDNA。以目的基因fas1扩增引物fas1-FP和fas1-RP为RT-PCR的引物,以拟南芥actin基因为内参基因,用PrimeSTAR高保真酶进行扩增。扩增体系为20 μL: PrimeSTAR 10 μL、fas1-FP/fas1-RP各1 μL、模 板 1 μL、ddH2O 7 μL。PCR反应条件为98 ℃预变性2 min;98 ℃ 10 s,58.8 ℃ 5 s,72 ℃ 2 mim 30 s,35个循环后72 ℃延伸10 min,PCR产物用1.5%的琼脂糖凝胶电泳检测有无目的条带。
1.2.4 拟南芥种子发芽势和发芽率的统计。
种子萌发的测定方法参照宋松泉等[18]进行。具体方法如下:将拟南芥种子点种在1/2MS培养基上,从第2天开始, 每24 h统计1次种子萌发情况。每组各统计100粒, 连续统计5 d,试验重复3次。第3天计算各组发芽势, 第6天计算各组发芽率,分别按以下公式进行计算:
发芽势(Ge)=(前3 d内供试种子的发芽数/供试种子总数)×100%
发芽率(Gr)=(前6 d内供试种子的发芽数/供试种子总数)×100%
2 结果与分析
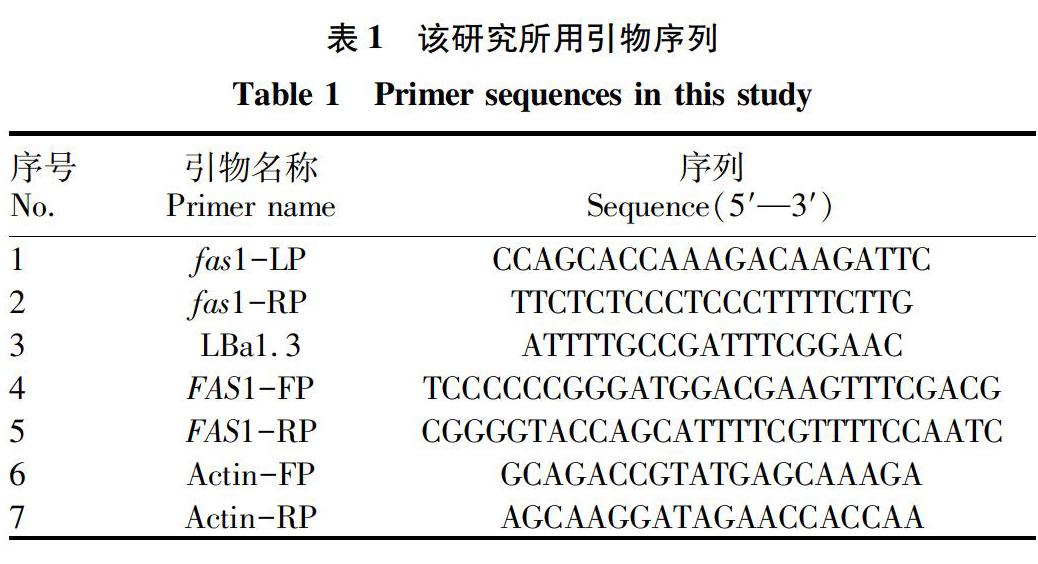
2.1 拟南芥fas1突变体植株的鉴定 由图1可知,fas1定位于拟南芥基因组的第 Ⅰ 号染色体上,由11个外显子和10个内含子组成。根据TAIR(http://www.arabidopsis.org/)提供的信息,fas1突变体的T-DNA的插入位点在第5个内含子上,并设计合适的引物。
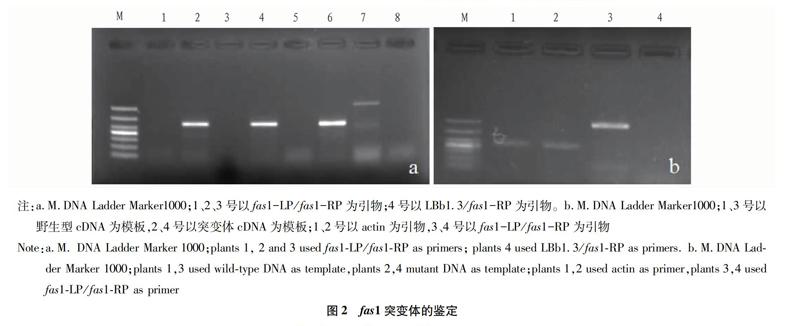
图2a为fas1突变体的DNA水平鉴定的PCR结果,1、2、
3号植株为待鉴定的突变体植株,4号植株为野生型。1、2、3
号植株分别用fas1-LP/fas1-RP引物未扩增出目的条带,如图2 a 1、3、5所示;同时用T-DNA 边界引物 LBa1.3/fas1-RP均扩增出目的片段,如图2 a 2、4、6所示,表明有T-DNA 插入。4号植株为野生型(WT)植株对照,用 fas1-LP/fas1-RP引物有扩增条带,如图2 a 7所示;而T-DNA边界引物LBa13/fas1-RP未扩增出条带,如图2 a 8所示,表明没有T-DNA插入。初步表明3株苗均为fas1突变体T-DNA插入纯合突变体。
图2b为fas1突变体的RNA水平鉴定的PCR结果,1号植株为野生型,2号植株为待鉴定的fas1突变体植株。用内参基因actin的引物扩增时,1号和2号植株结果一致,均有目的条带,如图2 b 1、2所示。而用fas1-LP/fas1-RP引物扩增时,1号植株扩增出2 448 bp的fas1条带,2号植株未扩增出目的条带,如图2 b 3、4所示,表明2号植株有 T-DNA插入,而1号野生型拟南芥没有 T-DNA 插入。进一步确定4号植株为fas1突变体纯合植株。
2.2 UV-B处理对拟南芥发芽率和发芽势的影响
UV-B辐射处理对拟南芥种子萌发的影响结果见表2。从表2可以看出,fas1组拟南芥的发芽势和发芽率均低于对照组WT,分别降低了1.33%和0.66%,但是都没有达到显著水平(P>0.05)。在UV-B辐射条件下,WT+UV-B组拟南芥的发芽势和发芽率都低于WT组,分别降低了12.62%和8.96%,而且都达到了显著水平(P<0.05);fas1+UV-B组拟南芥的发芽势和发芽率都低于fas1组,分别降低了15.32%和10.01%,且都达到了显著水平(P<0.05);fas1+UV-B组拟南芥的发芽势和发芽率都低于WT+UV-B组,分别降低了4.37%和1.80%,且都达到了显著水平(P<0.05)。由此可知,UV-B辐射对fas1突变体发芽势和发芽率的影响大于对野生型拟南芥的影响。
2.3 UV-B处理对拟南芥根长的影响
UV-B辐射处理对拟南芥根长的影响结果如图3所示,在正常生长条件下,WT和fas1突变体拟南芥的根长差异不显著(P>0.05)。在UV-B辐射条件下,WT+UV-B根长低于WT组,且差异显著(P<0.05);fas1+UV-B组拟南芥的根长低于fas1组,且达到了显著水平;而fas1+UV-B组与WT+UV-B组的根长有差异,且达到了显著水平。由此可知,UV-B辐射对拟南芥fas1突变体根长的影响大于对野生型拟南芥根长的影响。
2.4 UV-B处理对拟南芥根尖有丝分裂的影响
为了对UV-B辐射条件下fas1突变体的根尖有丝分裂进行观察,對fas1突变体植株和野生型植株根尖进行DAPI染色,使用激光共聚焦观察根尖分生区细胞的有丝分裂(图4)。结果发现在拟南芥fas1突变体根尖分生区细胞中都有疑似异常有丝分裂现象的发生。
3 讨论
在面对恶劣的生长环境时, 固着生长的陆生植物不能像动物那样通过逃离来保护自己,因此它们进化出精细、有效的机制来抵抗和适应外界各种各样的逆境胁迫刺激。部分或全部的生长抑制是植物对极端环境的一种适应[19]。很多与生长发育相关的重要功能基因往往也参与逆境胁迫响应及适应过程中的生长调整过程, fas1就是这样一个参与细胞有丝分裂过程的重要功能基因。对fas1突变体在UV-B胁迫下表型分析和观察根尖分生区异常有丝分裂表明,fas1基因在拟南芥发育过程中参与了UV-B胁迫反应。
首先通过DNA和RNA水平鉴定拟南芥fas1突变体表明,与野生型相比,fas1突变体中FAS1蛋白的表达量明显低于野生型。在UV-B胁迫条件下,fas1突变体拟南芥种子的发芽率和根长均低于野生型。之前的报道称,当辐射剂量高于1.0 kJ/m2时,拟南芥种子的发芽势、发芽率和株高、根长均受到抑制[20]。因此,fas1基因在拟南芥萌发和幼苗生长阶段有重要作用。
该研究发现,在UV-B胁迫条件下,与野生型相比,拟南芥fas1突变体根尖分生区有丝分裂表现为微核和不均等分裂。而之前有报道称,在植物fas1突变体中,根有肉眼可见的弯曲表型,且在有丝分裂后期呈现落后染色体。因此,fas1在拟南芥根尖分生区的有丝分裂过程中具有重要作用。
然而对fas1在植物染色体分离过程中的具体作用却知之甚少。与此同时,fas1在UV-B条件下的功能以及fas1如何参与调节UV-B条件下染色体的分离还需要进一步的研究。
参考文献
[1]
FARMAN J C, GARDINER B G, SHANKLIN J D. Large losses of total ozone in Antarctica reveal seasonal CIOx/NOx interaction[J].Nature,1985,315:207-210.
[2] SCOTTO J,COTTON G,URBACH F,et al. Biologically effective ultraviolet radiation:Surface measurements in the United States,1974 to 1985[J].Science,1988,239(4841):762-764.
[3] 陈慧泽, 韩榕. 植物响应UV-B辐射的研究进展[J]. 植物学报, 2015, 50(6):790-801.
[4] 郭爱华. He-Ne激光和增强UV-B辐射对小麦幼苗微管蛋白及微管骨架的影响[D].临汾:山西师范大学,2010.
[5] 韩雯, 韩榕. 不同时间的UV-B辐射对拟南芥幼苗生长的影响[J]. 植物学报,2015,50(1):40-46.
[6] 韩榕. He-Ne激光对小麦增强UV-B辐射损伤的修复效应及机理[D]. 西安:西北大学,2002.
[7] TERAMURA A H,SULLIVAN J H,LYDON J.Effect of UVB radiation on soybean yield and seed quality:A 6year field study [J]. Physiol Plant, 1990,80(1):5-11.
[8] TERAMURA A H.Effects of ultravioletB irradiances on soybean[J].Plant Physiol,1980,65:483-488.
[9] 孙林,黄海山,赵秀勇,等. UV-B辐射增强对冬小麦生长发育及产量的影响[J]. 农村生态环境,2004,20(2):24-27.
[10] NOGUO S,ALLEN D J,MORISON J I L,et al.Characterization of stomatal closure caused by ultravioletB radiation[J]. Plant physiology,1999, 121(2):489-496.
[11] 吴杏春,林文雄,郭玉春,等.植物对 UV-B 辐射增强响应的研究进展[J].中国生态农业学报, 2001,9(3):52-55.
[12] TEVINI M,TERAMURA A H.UVB effects on terrestrial plant[J]. Photochem and Photobiol,1989,50(4):479-487.
[13] TERAMURA A H.Effects of ultravioletB radiation on the growth and yield of crop plants[J]. Physiol Plant, 1983,58(3):415-427.
[14] SMITH S, STILLMAN B. Purification and characterization of CAF1, a human cell factor required for chromatin assembly during DNA replication in vitro[J]. Cell, 1989, 58(1):15-25.
[15] KAUFMAN P D, KOBAYASHI R, STILLMAN B. Ultraviolet radiation sensitivity and reduction of telomeric silencing in Saccharomyces cerevisiae cells lacking chromatin assembly factor1[J]. Genes Dev, 1997, 11(3): 345-357.
[16] FISCHER S, PRYKHOZHIJ S, RAU M J,et al.Mutation of zebrafish caf1b results in S phase arrest, defective differentiation, and p53mediated apoptosis during organogenesis[J].Cell Cycle,2007,6(23):2962-2969.
[17] 趙占克, 王玉凤.组蛋白伴侣在发育过程中的功能[J].遗传,2010,32(1):41-48.
[18] 宋松泉,程红焱,龙春林,等.种子生物学研究指南[M].北京:科学出版社,2005.
[19] VANDERAUWERA S, DE BLOCK M,VAN DE STEENE N,et al.Silencing of poly(ADPribose) polymerase in plants alters abiotic stress signal transduction[J].Proc Natl Acad Sci USA, 2007,104(38):15150-15155.
[20] 李晓阳,陈慧泽,韩榕.UV-B辐射对拟南芥种子萌发和幼苗生长的影响[J]. 植物学报,2013,48(1):52-58.
