灰茶尺蠖EgSCP2多克隆抗体制备及组织表达分析
2019-10-09张丽丽武怡琼魏佳平刘梦丽薛竞帆
张丽丽,武怡琼,魏佳平,刘梦丽,薛竞帆,靳 爽,王 玲,乔 利
(1 信阳师范学院 生命科学学院/大别山农业生物资源保护与利用研究院, 河南 信阳464000;2 信阳农林学院,河南 信阳 464000)
灰茶尺蠖(EctropisgrisescensWarren)属鳞翅目(Lepidoptera)尺蠖蛾科(Geometridae)昆虫,它以茶树嫩叶为食,可在短时间内大量繁殖,是茶园主要害虫之一。严重时可将茶树吃成光杆[1],仅剩下树枝,使茶树长势弱,易受冻害,严重影响茶树的生长以及茶叶的产量和品质[2-3]。灰茶尺蠖是全变态发育的昆虫,蜕皮激素协同保幼激素调控昆虫的发育和变态[4]。胆固醇既是细胞膜的重要成分,也是合成昆虫蜕皮激素的前体[5-6]。昆虫缺少从头合成胆固醇必需的鲨烯合酶和羊毛甾醇合酶[7-8],只能从宿主植物中吸收胆固醇来维持其生长发育[9-10],疏水性胆固醇在体内的转运依赖于固醇转运蛋白(SCP)完成[10-12]。干扰或阻断斜纹夜蛾(Spodopteralitura)中胆固醇的吸收和运输,能够抑制昆虫的生长、发育和繁殖[13]。
SCP2蛋白家族主要成员包括SCPx、SCP2、17-β-羟基固醇脱氢IV、类SCP-2等,这些蛋白的共同特征是羧基端有1个SCP2结构域[14-16]。双翅目昆虫埃及伊蚊(Aedesaegypti)中有多个SCP基因(AeSCPx、AeSCP2、AeSCP2L1、AeSCP2L2和AeSCP2L3),其编码的蛋白分别在体内完成胆固醇和脂类的吸收及转运。其中AeSCPx、AeSCP2、AeSCP2L1和AeSCP2L2主要定位于肠道,参与胆固醇和脂肪酸的吸收;而AeSCP2L3不仅在中肠中高表达,在脂肪体也表达[17-20]。鳞翅目昆虫中SCPx基因有SCPx和SCP2 2个转录本,分别编码SCPx和SCP2 2个蛋白,其中SCPx蛋白经过剪切可生成β-酮酯酰辅酶A硫解酶和SCP2蛋白[13,21-24]。RNAi结果表明,SCPx基因缺失导致昆虫生长缓慢、蜕皮延迟[13,24],而在细胞中超表达SCPx蛋白增加细胞中胆固醇的吸收[13,25]。针对SCP2蛋白为抗虫靶标进行抑制剂的筛选,埃及伊蚊生长抑制剂AeSCPI-1和AeSCPI-2不仅抑制埃及伊蚊中胆固醇的吸收[26],而且对鳞翅目烟草天蛾(Manducasexta)[23]和棉铃虫(Helicoverpaarmigera)[24]中胆固醇的吸收也有抑制作用。对斜纹夜蛾和棉铃虫以SCP2蛋白三维结构虚拟筛选及体外结合活性分析表明,分别获得的胆固醇竞争性抑制剂对斜纹夜蛾和棉铃虫幼虫的生长发育有明显的抑制作用[6,27]。
SCP亚细胞定位在不同物种间存在差异,脊椎动物和无脊椎动物中SCPx主要集中在过氧化物酶体[18,28],在斜纹夜蛾中SlSCPx主要集中在细胞质,而SlSCP2在细胞质和细胞核都有分布[13]。目前对灰茶尺蠖固醇转运蛋白EgSCPx的研究尚无报道,为此,本研究从灰茶尺蠖中肠转录组数据库中克隆得到EgSCPx和EgSCP2基因序列;由于EgSCP2和EgSCPx的C端序列完全一致,因此在全长基础上,仅表达含有底物结合区的EgSCP2蛋白,制备EgSCP2多克隆抗体,并通过Western blotting分析灰茶尺蠖中固醇转运蛋白EgSCP2和EgSCPx在不同组织中表达情况,为进一步研究胆固醇在细胞内的吸收和转运奠定基础。
1 材料与方法
1.1 供试材料
供试灰茶尺蠖幼虫采自河南省信阳市浉河区(32°07′7.75″ N,114°03′9.76″ E)。室内继代饲养方法参考文献[29]。1)卵消毒。 在卵孵化前1 d,将卵放入体积分数5%的甲醛溶液中消毒15 min,用无菌水漂洗,晾干。2)幼虫饲养。 将初孵幼虫接入塑料培养盒(20 cm×12.5 cm×7.5 cm)中,每日早晚投入新鲜茶树嫩梢饲喂,饲喂用的新鲜茶树嫩梢采自信阳市农业科学院试验基地种植的福鼎大白茶。幼虫长到3龄时,分盒饲养至预蛹期,饲养密度为每100 cm210~15 头,然后将预蛹幼虫转入干净的饲养盒中化蛹直至羽化。3)成虫产卵。 羽化后的雌雄成虫各1头放置在250 mL锥形瓶(高×直径=13.5 cm×8.0 cm) 中交配,尼龙纱布罩顶,瓶底放置浸有体积分数10%蜂蜜水的脱脂棉保持湿润及补充成虫营养,罩内放置折叠的纸条,以便收集茶尺蠖卵块。灰茶尺蠖饲养条件为:温度(27±1) ℃,相对湿度(65±5)%,光周期L∶D=14 h∶10 h。人工饲养条件下灰茶尺蠖幼虫经历5个龄期,整个生活周期需要30~35 d,自然死亡率较低。
RNA提取试剂RNAiso plus、反转录酶M-MLV、PCR常用试剂(dNTPs,10×buffer和rTaq)、DNA限制性内切酶、pMD18-T载体、SolutionⅠ、T4 DNA连接酶、10×T4 DNA连接酶 buffer、Premixed protein Marker (low),均购自TaKaRa公司(大连,中国);Western blotting所用硝酸纤维素膜,购自英国Whatman公司;SDS-PAGE和Western blotting相关试剂,购自郑州宝赛生物科技有限公司;质粒提取试剂盒和胶回收试剂盒,购自北京天根生物科技有限公司。大肠杆菌(E.coli)DH5α、BL21(DE3)、原核表达用pET32a质粒,由华南师范大学昆虫与科学技术研究所冯启理教授馈赠。
1.2 试验方法
1.2.1EgSCP2表达引物的设计及序列扩增 根据信阳师范学院昆虫发育与应用实验室前期已扩增并上传到NCBI数据库的灰茶尺蠖SCPx全长序列(GenBank登录号:MH475140),设计EgSCPx上游引物5′-CTCCGCTGCCGTCTCTTGGAGGT-3′和下游引物5′-TTACAATTTCGAGCGGATAGC-3′,用于扩增EgSCPx和EgSCP2 2个转录本;设计带有酶切位点的EgSCP2上游引物5′-GGATCCATGTACCGCAAAGGATTCAC-3′(划线处为BamHⅠ酶切位点)和下游引物5′-AAGCTTTTACAATTTCGAGCGGATAGC-3′(划线处为Hind Ⅲ酶切位点),用于扩增EgSCP2的开放阅读框(ORF)。引物由安徽通用生物技术有限公司合成。按RNAiso plus说明书提取5龄1 d灰茶尺蠖幼虫中肠总RNA,反转录获得cDNA。以此cDNA为模板进行PCR扩增,扩增程序为:94 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳分离,并通过胶回收试剂盒纯化回收目的DNA片段。将目的片段与pMD18-T载体连接,转化进入E.coliDH5α,涂平板(含0.1 g/L Amp)筛选,挑取单菌落扩大培养后提取质粒,经PCR和双酶切鉴定,送安徽通用生物技术有限公司测序。利用DNAMAN软件分析该基因序列的准确性及预测编码蛋白的分子质量。将重组载体命名为pMD18T-EgSCP2。
1.2.2 EgSCP2原核表达载体的构建与鉴定 采用限制性内切酶BamHⅠ和Hind Ⅲ对pMD18T-SCP2和pET32a空载体进行切割胶回收,经T4 DNA连接酶连接,16 ℃过夜后转化进入E.coliDH5α,挑取单菌落扩大培养后提质粒进行双酶切鉴定,然后送安徽通用生物公司进行测序,将测序正确的重组质粒命名为pET32a-EgSCP2。
1.2.3 EgSCP2重组蛋白的可溶性诱导表达及纯化 将构建好的重组质粒pET32a-EgSCP2转入大肠杆菌(E.coli)BL21(DE3)中,挑取阳性单菌落于5 mL LB液体培养基(含0.1 g/L Amp)中,37 ℃振荡培养过夜。次日按照1∶100体积比转接于5 mL LB液体培养基(含0.1 g/L Amp)中,200 r/min培养至OD600值达到0.6时,分别加入异丙基硫代半乳糖苷(IPTG)调节终浓度至0,0.6,1.0和2.0 mmol/L,诱导融合蛋白表达3 h后收集1.5 mL菌液;12 000g离心10 min后弃上清液,用600 μL PBS缓冲液 (NaCl 8 g,KCl 0.2 g,NaHPO41.44 g,KH2PO40.24 g,加水至1 L,pH 7.4)悬浮沉淀,超声波破碎至液体透明,于12 000g离心10 min,分别取上清液和沉淀各10 μL,并分别加入10 μL 2×上样缓冲液(100 mmol/L Tris-HCl,体积分数2% β-巯基乙醇,体积分数4% SDS,体积分数0.2% 溴酚蓝,体积分数20% 甘油,pH 6.8),100 ℃变性5 min,冰上放置3 min。用12% SDS-PAGE凝胶电泳分离15 μL样品,以未诱导的EgSCP2重组蛋白作为对照,所有条件保持一致。将蛋白胶用考马斯亮蓝R250染色,成像分析EgSCP2重组蛋白的可溶性及最适IPTG诱导浓度。在最适IPTG 终浓度条件下,将诱导温度分别调整至 20,28和37 ℃,根据EgSCP2重组蛋白表达量的检测结果确定最佳诱导温度。表达条件优化后按1∶100体积比接菌至5 mL LB液体培养基(含0.1 g/L Amp),37 ℃、200 r/min培养至OD600值达到0.6时,加入IPTG至终浓度为1.0 mmol/L,28 ℃、200 r/min培养,3 h后收集5 mL菌液,于12 000g离心10 min,收集细胞沉淀。超声波破碎菌体沉淀并离心,留取沉淀和少量上清液待用。
将剩余上清液加入经1×PBS平衡的Ni-NTA树脂层析柱,混合均匀,在摇床上低温孵育30 min,4 ℃、1 000g离心后弃上清液,用1×PBS洗涤Ni-NTA树脂层析柱2~3次,去除杂蛋白;再用含20~50 mmol/L 咪唑的PBS洗涤,去除表面非特异结合蛋白, 最后用含500 mmol/L咪唑的PBS在摇床上低温孵育5 min 洗脱目的蛋白,4 ℃离心后收集洗脱液。将上清液、沉淀和纯化的样品用SDS-PAGE电泳和Western blotting检测。纯化的目的蛋白分装后,置-80 ℃备用。
1.2.4 EgSCP2重组蛋白多克隆抗体的制备 用二喹啉甲酸(BCA)法测定纯化的EgSCP2重组蛋白浓度,将制备好的纯化的EgSCP2重组蛋白(抗原)与弗氏完全佐剂等体积混合,制备成乳状液。首次注射前,取未免疫新西兰大白兔(2~2.5 kg/只)耳静脉血3~5 mL,制成血清作为空白对照。首次免疫注射抗原剂量为500 μg/只,进行多点腹部皮下注射。初次免疫后2周,将抗原与弗氏不完全佐剂等体积充分混匀,进行第二次加强免疫,抗原剂量为500 μg/只。之后每隔2周加强免疫1次,方法剂量同第二次免疫,共免疫4次。末次免疫后在白兔颈动脉采血,8 000g离心10 min,所得上清制备抗血清并纯化抗体。将EgSCP2蛋白与Ni-NTA树脂层析柱作用制备成抗原亲和纯化层析柱,将PBS与所得抗血清等量混合后缓慢上样,待抗原与抗体结合后,用甘氨酸洗脱缓冲液洗脱得到纯化抗体,并在PBS缓冲液中进行4 ℃透析过夜,隔日进行效价测定。
1.2.5 EgSCP2蛋白的多克隆抗体效价测定 用间接ELISA 法[30-31]测定抗体最终效价。1)包板。 用包被缓冲液(Na2CO3和NaHCO3混合液)将纯化的EgSCP2蛋白质量浓度稀释至1 mg/L,在96孔聚苯乙烯板的每个反应孔中加50 μL,4 ℃过夜;次日,弃去孔内溶液,用1×TBST洗涤缓冲液(每孔180 μL)洗3次,每次5 min。2)封闭。 每孔加60 μL 1%牛血清白蛋白(BSA)进行封闭, 37 ℃孵育2 h,之后弃封闭液。3)加样。 将制备的EgSCP2多克隆抗体和空白血清(免疫前健康兔血清)按250×20(250)~250×210(256 000)用PBS连续倍比稀释后加入(每孔50 μL)上述已封闭的反应孔。同时设置阳性对照孔(阳性血清)和阴性对照孔(BSA),置37 ℃ 孵育1 h,之后弃封闭液,用1×TBST洗涤缓冲液(每孔180 μL)洗2次。4)加酶标抗体。 将新鲜稀释的二抗-辣根过氧化物(HRP)(按照1∶5 000体积比用1% BSA进行稀释) 以50 μL/孔加入酶标板孔中,置37 ℃孵育45 min,之后弃封闭液,用1×TBST洗涤缓冲液(每孔180 μL)洗3次。5)显色。 于各反应孔中加入临时配制的TMB底物溶液100 μL,置37 ℃反应5 min。6)终止反应。 于各反应孔中加入2 mol/L硫酸90 μL,终止反应。7)读板。 将酶标板置于预热的酶标仪中测定450 nm吸光度(OD),每个梯度读数3次,取平均值进行比较,若阳性血清与阴性对照的吸光度比值大于 2.0,则视为阳性;否则为阴性。阳性反应的最大稀释倍数即为抗体效价。
1.2.6 EgSCPx和EgSCP2蛋白在不同组织中的表达情况 由于EgSCPx和EgSCP2 2个蛋白共有的SCP2序列一致,所以本研究制备的EgSCP2蛋白多克隆抗体可以同时检测EgSCPx和EgSCP2蛋白在灰茶尺蠖不同组织中表达情况。用裂解缓冲液(Tris-HCl 50 mmol/L、EDTA 10 mmol/L、体积分数15%甘油)从灰茶尺蠖不同组织(5龄2 d中肠、表皮和脂肪体)及不同发育时期(4~5龄幼虫期(中肠)、蛹期、成虫期)提取蛋白,于4 ℃、12 000g离心15 min,取上清于-80 ℃保存备用。取待检测蛋白样品50 μg加入等体积的2×上样缓冲液,于100 ℃变性5 min,冰上放置3 min。用15% SDS-PAGE凝胶电泳分离样品,考马斯亮蓝R250染色,最后进行成像分析。
蛋白经SDS-PAGE电泳分离后进行Westerning blotting分析,电转移至硝酸纤维素膜上,用封闭液(质量分数3% BSA)于37 ℃封闭2 h。然后与所制备的EgSCP2 抗体(按照1∶10 000体积比稀释)于30 ℃下杂交反应1 h,用洗脱液洗膜3次,10 min/次。与碱性磷酸酶标记的羊抗兔IgG酶标抗体(按照1∶10 000体积比稀释)于30 ℃下反应1 h。然后用洗脱液洗膜4次,5 min/次;最后用四氮唑兰(NBT)/5-溴-4-氯-3吲哚-磷酸盐(BCIP)进行显色反应。以β-Actin蛋白作为内参蛋白,定量检测组织总蛋白上样量是否一致。
2 结果与分析
2.1 灰茶尺蠖EgSCPx和EgSCP2基因的扩增
以5龄1 d灰茶尺蠖幼虫中肠cDNA为模板,用EgSCPx特异性引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳分离后,呈现出2条与预期相吻合的目的条带,分别为1 680 bp的EgSCPx和636 bp的EgSCP2(图1-A)。由于EgSCP2与EgSCPx的羧基端序列完全一致,因此选择EgSCP2 cDNA模板,用有酶切位点的EgSCP2特异性引物进行ORF扩增,其长度为441 bp,编码146个氨基酸,预测编码蛋白的分子质量为16 ku(图1-B)。

M.DL5000 DNA Marker;1.PCR产物
2.2 灰茶尺蠖EgSCP2原核表达载体的构建
重组质粒pET32a-EgSCP2的BamHⅠ和Hind Ⅲ双酶切鉴定结果见图2。

M.DL5000 DNA Marker;1.PCR产物
图2显示,重组质粒酶切后呈现2条清晰的条带,一条条带为441 bp的EgSCP2插入片段,另一条条带为5 900 bp的pET32a载体。用DNAMAN 软件分析该重组质粒测序所得序列,结果显示,pET32a-EgSCP2原核表达载体构建成功。
2.3 灰茶尺蠖EgSCP2重组蛋白的表达、纯化与鉴定
将重组表达载体pET32a-EgSCP2转化到表达菌株E.coliBL21(DE3)中,获得可溶性目的蛋白,以转化空载体pET32a的菌体作为对照,用IPTG终浓度为0.6,1.0和2.0 mmol/L诱导,随着IPTG终浓度的增大,EgSCP2蛋白的表达量变化不大(图3)。考虑IPTG浓度过高会对细胞有毒害作用,因此选择IPTG终浓度为1.0 mmol/L时进行诱导温度的选择。由图4可知,随着诱导温度的升高,沉淀蛋白的表达量在28 ℃时有明显提高;28 ℃以后,随着温度升高,蛋白表达量无明显变化,可知最适诱导温度为28 ℃。

M.蛋白分子量Marker;1,3,5,7为IPTG浓度分别为0,0.6,1.0,2.0 mmol/L时pET32a-EgSCP2转化菌诱导后的表达产物上清液;2,4,6,8为IPTG浓度分别为0,0.6,1.0,2.0 mmol/L时pET32a-EgSCP2转化菌诱导后的表达产物沉淀;9.IPTG浓度为2.0 mmol/L时pET32a诱导后的表达产物;M.Protein Marker;1,3,5,and 7 are the supernatant induced expression product of pET32a-EgSCP2 by IPTG at concentrations of 0,0.6,1.0,and 2.0 mmol/L, respectively;2,4,6,and 8 are the precipitate induced expression product of pET32a-EgSCP2 by IPTG at the concentrations of 0,0.6,1.0,and 2.0 mmol/L,respectively;9.Induced expression product of pET32a by IPTG at the concentration of 2.0 mmol/L
图3 IPTG 浓度对灰茶尺蠖EgSCP2重组蛋白表达量的影响(37 ℃)
Fig.3 Impact of IPTG concentration on expression of EgSCP2 recombinant protein fromEctropisgrisescens(37 ℃)
M.蛋白分子量Marker;1,3,5分别为诱导温度20,28,37 ℃时pET32a-EgSCP2转化菌诱导后的表达产物上清液;2,4,6分别为诱导温度20,28,37 ℃时pET32a-EgSCP2转化菌诱导后的表达产物沉淀;7.37 ℃时pET32a诱导后的表达产物
M.Protein Marker;1,3,and 5 are the supernatant induced expression product of pET32a-EgSCP2 by induction temperatures of 20,28,and 37 ℃,respectively;2,4,and 6 are the precipitate induced expression product of pET32a-EgSCP2 by induction temperature of 20,28,and 37 ℃,respectively;7.Induced expression product of pET32a by IPTG at 37 ℃
图4 诱导温度对灰茶尺蠖EgSCP2重组蛋白表达量的影响(1.0 mmol/L IPTG)
Fig.4 Impact of induction temperature on expression of EgSCP2 recombinant protein fromEctropisgrisescens(1.0 mmol/L IPTG)
在28 ℃、IPTG终浓度为1.0 mmol/L条件下诱导4 h表达可溶性重组目的蛋白,该蛋白含6×His纯化标签,通过Ni-NTA树脂层析柱亲和纯化获得目的蛋白,经SDS-PAGE分析表明,在34 ku左右纯化出单一的表达条带(图5-A)。Western blotting结果表明,抗His-tag标签抗体能特异识别重组蛋白,其分子质量约为34 ku,与16 ku EgSCP2蛋白加上约为17.6 ku pET32a空载体标签蛋白分子质量相符(图5-B),这表明插入的cDNA编码相应的蛋白可被高效纯化,这与预期结果一致。

M.蛋白分子量Marker;1.pET32a诱导表达产物;2.pET32a-EgSCP2诱导表达产物;3.pET32a-EgSCP2诱导表达产物上清液;4.pET32a-EgSCP2诱导表达产物沉淀;5.纯化的pET32a-EgSCP2诱导表达产物上清液
2.4 灰茶尺蠖EgSCP2重组蛋白多克隆抗体效价的测定
新西兰大白兔4次免疫后,EgSCP2多克隆抗体和空白血清( 免疫前健康兔血清)按250×20(250)~250×210(256 000)连续倍比稀释后,用间接ELISA 法测定EgSCP2多克隆抗体的效价。测定结果表明,当EgSCP2多克隆抗体稀释256 000倍时,OD阳性/OD阴性>2.0,其终效价可达1∶256 000(图6)。
2.5 灰茶尺蠖EgSCPx和EgSCP2蛋白在不同组织中的表达情况
EgSCP2蛋白在灰茶尺蠖幼虫不同组织和不同时期的表达分析结果见图7。图7显示,在5龄2 d的灰茶尺蠖幼虫中,检测到EgSCPx蛋白在表皮、脂肪体和中肠中均有表达,且其在中肠的表达量远高于表皮和脂肪体;EgSCP2仅在表皮和脂肪体中表达(图7-A)。58 ku左右的EgSCPx蛋白在灰茶尺蠖4龄和5龄幼虫中肠大量表达,蛹期少量表达,成虫期几乎不表达(图7-B)。
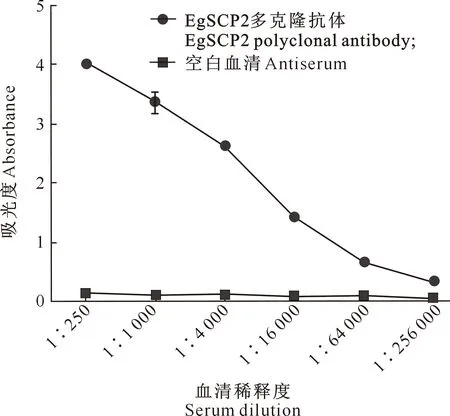
图6 灰茶尺蠖EgSCP2蛋白多克隆抗体的效价

M.蛋白Marker;1~3.分别为5龄2 d幼虫表皮、脂肪体和中肠蛋白;4~6.4龄幼虫1~3 d中肠蛋白;7~8.5龄幼虫1~2 d中肠蛋白;9.蛹期总蛋白;10.成虫期总蛋白
3 讨 论
灰茶尺蠖的分布几乎覆盖我国所有产茶省份,除了危害茶树外,对向日葵、豇豆、大豆、辣蓼、菊花等也有一定的危害[1-2,32]。目前对灰茶尺蠖的防治以化学农药为主, 不仅使灰茶尺蠖产生抗药性,也增加了环境压力。采用现代生物防治为主的方法对灰茶尺蠖进行防治,不仅可以提高茶叶质量和产量,而且可减少对环境的污染,降低茶叶中残毒含量,同时也可以降低农业生产成本。EgSCPx基因作为蜕皮激素合成前体-胆固醇的转运载体,研究其序列对于防治灰茶尺蠖,保护茶树有重要的生物学意义。鳞翅目昆虫斜纹夜蛾[13]、棉贪夜蛾[21]和家蚕[22]基因组中只有1个SCPx基因,其转录水平有SCPx和SCP2 2个转录本,分别编码58 ku 的全长SCPx和16 ku仅含胆固醇结合域的SCP2蛋白。笔者从灰茶尺蠖中肠转录组数据中得到1条EgSCPx序列,取5龄1 d灰茶尺蠖幼虫cDNA为模板,使用特异性引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳分离后,呈现出2条与预期相吻合的目的条带,长度分别为1 680和636 bp。这与前人对棉贪夜蛾[21]、家蚕[22]和斜纹夜蛾[13]SCPx的扩增结果类似,一个编码58 ku的全长SCPx蛋白,另一个编码16 ku仅含胆固醇结合域的SCP2蛋白。
构建至pET32a载体的EgSCP2含有终止子,载体标签蛋白分子质量约为17.6 ku,EgSCP2蛋白的理论分子质量为16 ku,因此重组蛋白pET32a-EgSCP2的理论分子质量约为34 ku。SDS-PAGE和Western blotting检测结果显示,EgSCP2重组蛋白的分子质量约为34 ku。
制备高效价的抗体是免疫法检测EgSCPx和EgSCP2蛋白在灰茶尺蠖中组织定位的重要前提。本研究制备的EgSCP2多克隆抗体灵敏度较高,效价达1∶256 000,该抗体可以识别昆虫组织蛋白,为进一步特异性检测EgSCPx和EgSCP2蛋白在灰茶尺蠖中的定位奠定了基础。
SCPx/2蛋白作为胆固醇的转运载体,吸收胆固醇合成蜕皮激素调控昆虫的蜕皮和变态[13]。双翅目昆虫埃及伊蚊AeSCP2L3在脂肪体中参与脂类的转运[20]。鳞翅目斜纹夜蛾SlSCPx和SlSCP2除了在中肠表达外,SlSCP2在脂肪体中也有表达[13]。鳞翅目棉铃虫HaSCPx在中肠中少量表达,在脂肪体和表皮中不表达,而HaSCP2在中肠中大量表达,在脂肪体中少量表达,而在表皮中几乎不表达[20]。本研究中,EgSCPx在表皮、脂肪体和中肠3个组织均有表达,而EgSCP2仅在表皮和脂肪体中表达。在4龄和5龄幼虫中肠中EgSCPx蛋白大量表达,在蛹期表达量少,在成虫期中几乎不表达。中肠是胆固醇吸收的主要场所,这与固醇转运蛋白参与胆固醇在中肠的吸收和运输有关,推测在灰茶尺蠖中肠中SCPx发挥着主要功能。EgSCPx和EgSCP2蛋白在灰茶尺蠖不同组织表达存在差异,暗示二者在胆固醇的吸收和转运中发挥不同的作用。
4 结 论
利用RT-PCR技术从灰茶尺蠖中成功克隆了EgSCP2的开放阅读框,其序列全长441 bp,编码146个氨基酸,分子质量约为16 ku。将灰茶尺蠖EgSCP2连接到原核表达载体pET32a上,获得了重组质粒pET32a-EgSCP2,并成功在E.coliBL21 (DE3)中表达,获得了纯化的EgSCP2重组蛋白,免疫新西兰大白兔,成功制备了EgSCP2蛋白的多克隆抗体,其抗体效价达1∶256 000。Western blotting检测结果显示,灰茶尺蠖内的EgSCPx在幼虫期表皮、脂肪体和中肠3个组织中均有表达,其中在中肠中表达量最高;EgSCP2蛋白仅在幼虫期的表皮和脂肪体中表达。
