朝鲜淫羊藿种胚组培研究
2019-10-09李春鹏王克凤孙晓丹
李春鹏,王克凤,孙晓丹,姚 强,董 然
(1吉林农业大学 园艺学院,吉林 长春130118;2长春科技学院 长白山野生资源工程中心,吉林 长春130600)
朝鲜淫羊藿(EpimediumkoreanumNakai)为小檗科淫羊藿属多年生草本植物,俗称三枝九叶草、唐本草,主要分布在吉林省东部长白山附近区域[1-3]。作为补益类中药,淫羊霍不仅能补肾阳、强筋骨、祛风湿[3],还具有延缓衰老,有效降低血压、血脂,提高人体综合免疫力,抑制肿瘤等功效[4],是5种淫羊藿正品药材中药质最佳的种类[1],也是具有较高经济开发价值的林下耐阴中药材之一。目前,朝鲜淫羊藿在制药、功能性食品等行业被广泛应用。此外,淫羊藿花形奇特,观赏价值极高,在美国及欧洲一些国家,淫羊藿属植物在园林中多应用于林下[5-6],其景观效果很好。
近些年,国内外对朝鲜淫羊藿的需求日益增长,而淫羊藿来源以野生资源为主[7],供给量远低于市场需要;市场的大量需求促使野生资源被过度开发,致使其野生种群处于濒危边缘。朝鲜淫羊藿在以地下根茎无性繁殖时,易受到细菌、真菌、植株来源、生长环境等因素制约[8-9];种子繁殖方式存在生理后熟,出苗率低,因此两种繁殖方式均难以实现规模化生产,十分必要对朝鲜淫羊藿开展组培快繁技术研究。为更好地开发朝鲜淫羊藿的观赏价值和中药材资源,本研究以其种胚为外植体,筛选适合愈伤组织诱导和增殖的培养基,探索丛生芽增殖和诱导生根条件,以期为其快速繁殖提供依据。
1 材料与方法
1.1 试验材料
2017年6月12-14日,于敦化市江源镇朝鲜淫羊藿繁育基地(北纬43°07′20″,东经128°01′14″),从10年生朝鲜淫羊藿采摘种皮微裂、籽粒饱满、无病害的种子(图1)备用。

图1 朝鲜淫羊藿种子
1.2 试验方法
1.2.1 外植体预处理 筛选出籽粒饱满、大小基本一致的种子,在4 ℃低温条件下层积120 d。配制体积分数为0.5%的“奇强”洗涤剂水,浸泡层积后的种子5 min,其间不停搅拌,去除细小沙粒及其他杂质。将浸泡过的种子置于流水下冲洗30 min,用滤纸充分吸干水分,放置在超净工作台备用。
1.2.2 消毒方式 在超净工作台中将外植体置于烧杯中,边倾倒体积分数70%酒精边振荡烧杯,使酒精与外植体表面充分接触,30 s后用无菌水反复清洗3~5次;用体积分数0.1% HgCl2分别对种子消毒4,6,8和10 min,操作方式同酒精。将消毒后的外植体放置在无菌滤纸上,待水分被吸干,用经过灭菌的解剖刀与镊子,切取种胚(图2-A、B),洗净外侧胚乳,取部分HgCl2消毒8 min的种胚,再用体积分数0.1% HgCl2消毒5 s,无菌水冲洗3~5次。将经消毒的种胚接种到空白1/2MS培养基(不含激素)上,每种消毒方式接种30个外植体,重复3次;10 d后统计污染数、死亡数、存活数,计算污染率和死亡率,20 d后计算种胚存活率。
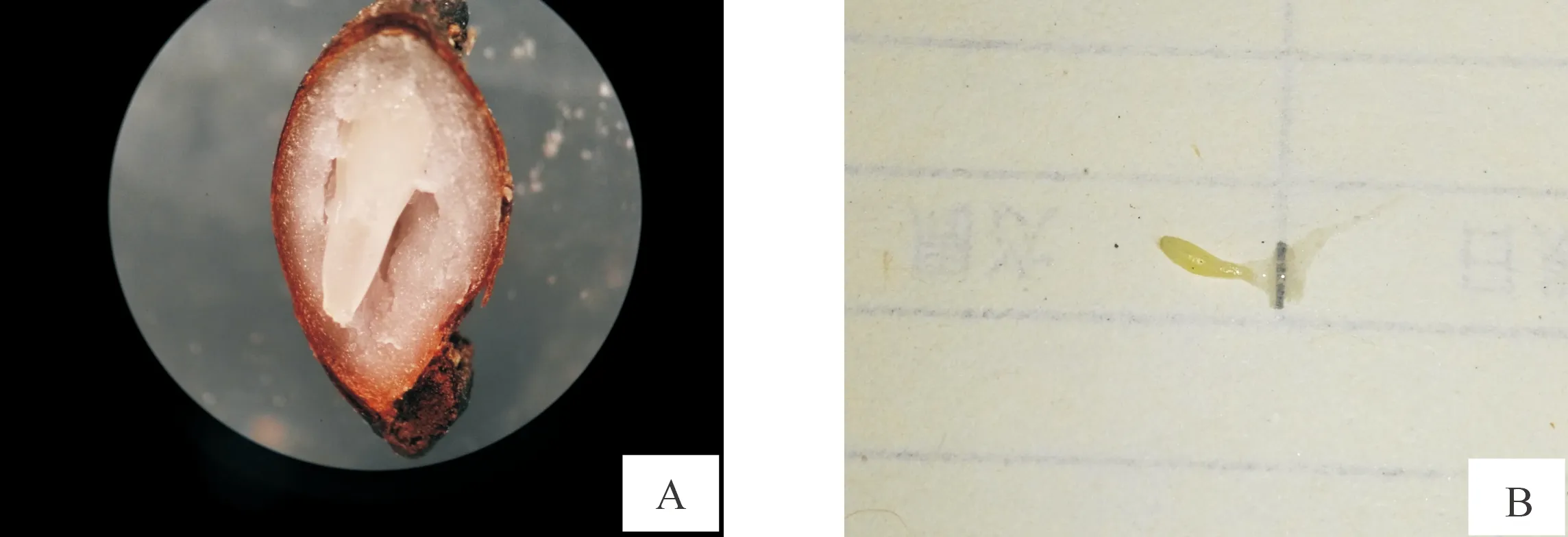
A.种胚形成;B.种胚
污染率(死亡率、存活率)=(污染(死亡、存活)的外植体数/接种外植体总数)×100%。
1.2.3 愈伤组织诱导 以6-BA、NAA、IBA和蔗糖质量浓度为因素进行四因素三水平L9(34)正交试验(表1)。将消毒后的种胚接种在培养基中,每处理30个外植体,重复3次。14 d后观察种胚的培养情况,统计种胚出现的愈伤组织数,计算诱导率。
诱导率=(诱导出愈伤组织的外植体数/接种外植体总数)×100%。

表1 朝鲜淫羊藿愈伤组织诱导培养基筛选的正交试验方案
1.2.4 愈伤组织增殖 将诱导出的愈伤组织分别接种在1/2MS、1/2MS+0.3 mg/L NAA、1/2MS+0.5 mg/L 2,4-D+0.3 mg/L NAA、1/2MS+0.5 mg/L 6-BA+0.3 mg/L NAA、1/2MS+0.5 mg/L KT+0.3 mg/L NAA等5种增殖培养基中,每处理10瓶,每瓶接种0.05 g,重复3次。20 d后观察记录、称取鲜质量,并计算增长率。
增长率=(m-m0)/m0×100%。
式中:m为愈伤组织培养20 d时的鲜质量,m0为接种时的愈伤组织的鲜质量。
1.2.5 丛生芽诱导与增殖 筛选经增殖培养的浅绿色或绿色且富有光泽的愈伤组织,将其均匀分割,接入到1/2MS+1.0 mg/L 6-BA+0.4 mg/L NAA的分化培养基中,10 d后,将分化出的丛生芽分离成含肉眼可见单一小芽的大小均匀的愈伤组织,分别接种在1/2MS+(0.5,1.0,2.0) mg/L 6-BA+(0.2,0.4)NAA mg/L的增殖培养基中,每处理20个外植体,重复3次。14 d后统计芽总数,计算增殖系数。
增殖系数=增殖后芽苗总数/起始芽苗总数。
1.2.6 生根培养 从丛生芽中选取高度1~3 cm的小芽分别接入到1/2MS+(0.1,0.5,1.0) mg/L NAA和1/2MS+(0.1,0.5,1.0) mg/L IBA的生根培养基中,进行生根诱导培养。每处理20个外植体,重复3次。60 d后计算生根率:
生根率=(诱导生根的外植体数/接种外植体总数)×100%。
1.3 培养条件
以1/2MS为基础培养基,将培养基中的大量元素减半,其余成分含量不变。各类培养基pH值5.8~6.0,蔗糖30 g/L,琼脂粉6 g/L;121 ℃、0.1 MPa灭菌20 min。培养室温度(25±2) ℃,光照时长14 h/d,光照强度1 500~2 000 lx。
1.4 数据分析
使用Excel 2016对试验数据进行分析,SPSS 20.0软件处理数据,Duncan’s多重比较法进行差异显著性分析。
2 结果与分析
2.1 消毒时间对朝鲜淫羊藿外植体消毒效果的影响
消毒不同时间后朝鲜淫羊藿种胚污染率、死亡率、存活率的统计结果见表2。

表2 消毒时间对朝鲜淫羊藿外植体消毒效果的影响
注:表中数据为“平均值±标准误”;同列数据后标不同小写字母表示在P<0.05水平差异显著,不同大写字母表示在P<0.01水平差异显著。下同。
Note:The data is “the mean±standard error”.Different lowercase letters indicate significant difference atP<0.05, and different uppercase letters indicate extremely significant difference atP<0.01,the same below.
表2显示,当种子消毒处理4~10 min时,污染率呈下降趋势,死亡率开始逐渐升高,存活率则呈现先上升后下降的趋势。说明种子对体积分数0.1% HgCl2有一定的耐受能力,随着消毒时间延长,消毒剂会对种子产生毒害作用,导致其死亡率升高。种子适宜消毒时间为8 min,此时的消毒与抑菌效果较好。在种子消毒8 min基础上,继续对种胚消毒5 s时,污染率下降,种胚存活率明显提高。因此综合考虑认为,最佳消毒处理方式为种子消毒8 min+种胚消毒5 s。
2.2 朝鲜淫羊藿愈伤组织诱导的影响因素
朝鲜淫羊藿外植体培养7 d后,种胚开始萌动,种胚一侧伸长并略微膨大,乳白色子叶逐渐出现;10 d时,子叶形态由乳白色透明状变为浅黄绿色不透明状,子叶一侧有明显升高,胚根一侧颜色加深;15 d时,在膨大的子叶、胚根边缘处有颗粒状乳白色、黄白色或黄绿色组织形成;20 d时,胚轴、胚根脱分化为白色、黄色或浅绿色致密的愈伤组织(图3)。在愈伤组织诱导过程中,需及时清除污染种胚,避免对正常种胚造成影响。
4种因素组合对朝鲜淫羊藿种胚诱导率的影响情况见表3。由表3可知,6-BA对种胚有明显的诱导作用,在其质量浓度为0.5 mg/L时诱导率较低;质量浓度为1.0 mg/L时,诱导率明显提升且高于其他处理。NAA对愈伤组织质地有一定的影响,NAA质量浓度较低时,愈伤组织表面呈干涩状,色泽暗淡、生长状态较差;提高NAA质量浓度,愈伤组织由乳白、淡黄色转变为黄色或淡绿色,质地多致密、有光泽。IBA和蔗糖在愈伤组织诱导过程中作用均不明显。

图3 朝鲜淫羊藿愈伤组织诱导阶段的形态

表3 不同因素对朝鲜淫羊藿种胚愈伤组织诱导的影响
表4结果显示,4种因素对朝鲜淫羊藿愈伤组织诱导率的影响由大到小依次为6-BA、NAA、蔗糖、IBA,最优组合为A2B2C3D2,即1/2MS+1.0 mg/L 6-BA+0.5 mg/L NAA+0.5 mg/L IBA+30 g/L蔗糖。在此条件下,愈伤组织的理论诱导率为47.78%。
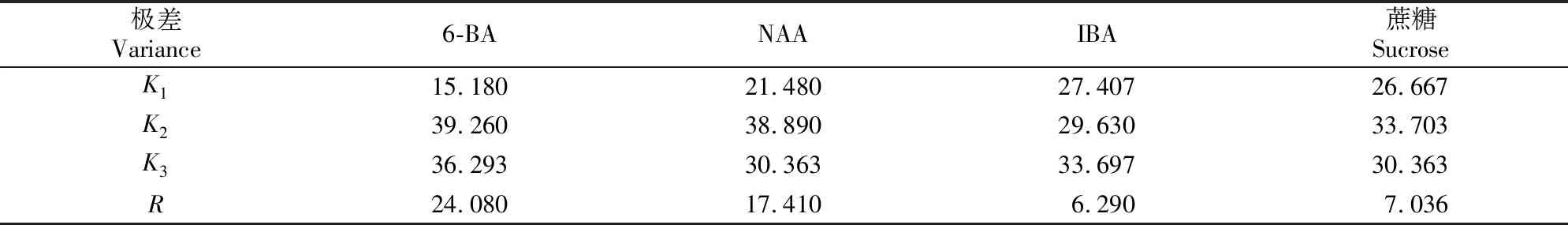
表4 朝鲜淫羊藿种胚愈伤组织诱导率的极差分析
由表5可知,种胚校正模型Sig.值为0(P<0.01),代表数据分析有意义[10]。6-BA对朝鲜淫羊藿愈伤组织诱导的影响最大,且6-BA和NAA的影响均达极显著水平(P<0.01),蔗糖达到显著水平(P<0.05),IBA作用不显著(P>0.05)。各因素影响作用由大到小依次为6-BA、NAA、蔗糖、IBA,优化结果与极差分析结果一致。
2.3 4种激素对朝鲜淫羊藿愈伤组织增殖的影响
由表6可见,在未添加任何激素的对照组中,朝鲜淫羊藿愈伤组织不仅生长缓慢,且质量不佳,多为白色、淡黄色,伴有水渍;添加0.3 mg/L NAA后愈伤组织由白色转变为浅绿色,且有光泽,呈颗粒状,愈伤组织增长率明显升高,从35.4%提升至88.0%;2,4-D、KT、6-BA 3种激素中,KT对愈伤组织的增殖效果最佳(图4-A),6-BA增殖效果次之;同质量浓度的2,4-D、KT、6-BA与NAA组合的效果明显优于单独使用NAA,且3个组合对愈伤组织增殖均有明显促进作用。在1/2MS+0.5 mg/L 2,4-D+0.3 mg/L NAA的培养条件下,愈伤组织变为黄色甚至黄褐色(图4-B),褐化现象严重,而在1/2MS+0.3 mg/L NAA培养基上却无类似现象。因此,在愈伤组织增殖过程中,不宜长时间使用2,4-D。本试验条件下,朝鲜淫羊藿的最佳增殖培养基为1/2MS+0.5 mg/L KT+0.3 mg/L NAA。
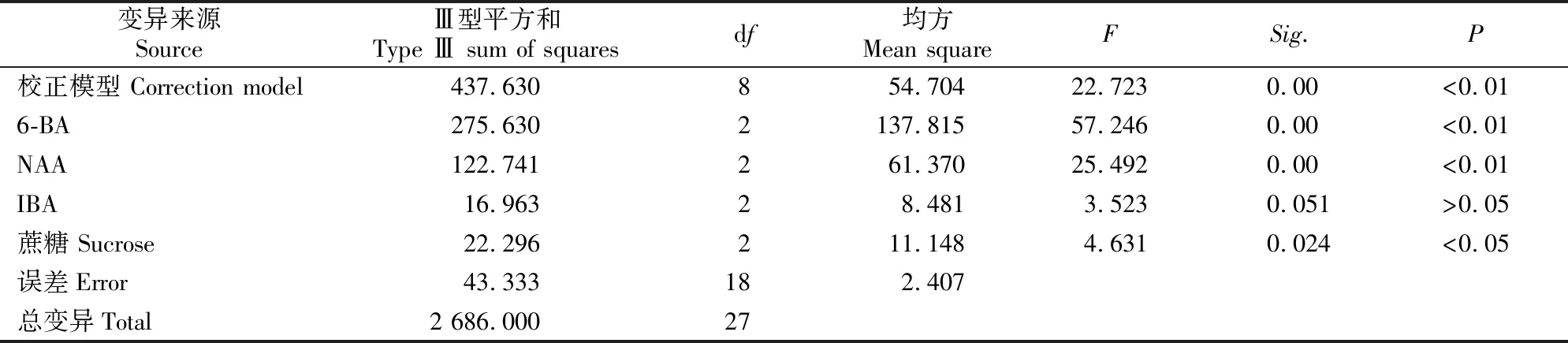
表5 朝鲜淫羊藿种胚愈伤组织诱导率的方差分析


表6 4种激素对朝鲜淫羊藿愈伤组织增殖的影响
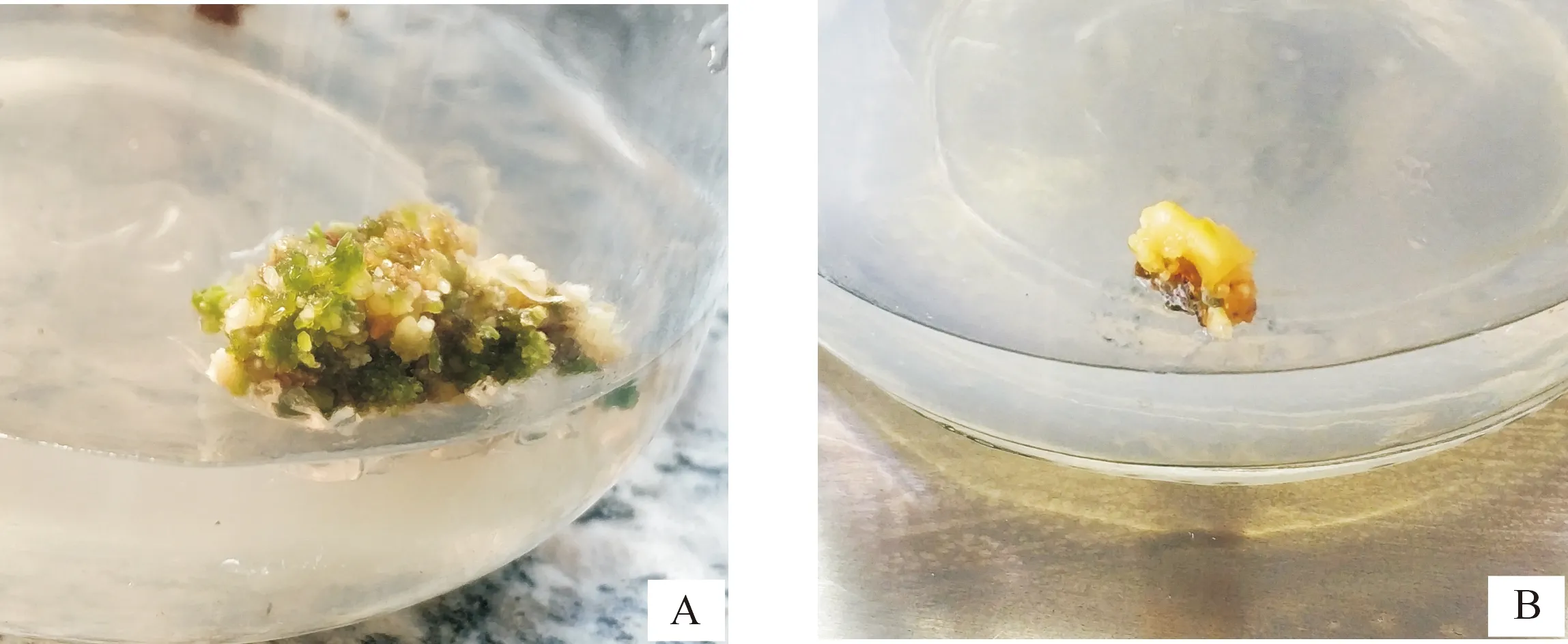
A.KT增殖愈伤组织;B.2,4-D增殖后期的愈伤组织
2.4 6-BA和NAA对朝鲜淫羊藿丛生芽增殖的影响
接入分化培养基10 d后,朝鲜淫羊藿愈伤组织表面出现散乱绿色芽点,且数量逐渐增加,芽点渐渐变为小芽丛(图5-A),局部分化出现绿色茎,且逐渐萌发;随着培养时间延长,原球茎的顶端产生叶原基突起,分化出浓绿色、层次分明的叶片。将分化出的丛生芽分割移入各丛生芽增殖处理培养基,继续培养。由表7可以看出,6-BA和NAA对朝鲜淫羊藿丛生芽增殖有重要影响。在NAA质量浓度确定的条件下,随着6-BA质量浓度增加,增殖系数呈逐渐上升趋势;当6-BA为0.5 mg/L时, 芽生长缓慢、色泽偏淡、难分化,增殖系数低;6-BA质量浓度为1.0~2.0 mg/L时,芽均增粗变壮,嫩绿色加深,新芽数量增多,部分陆续分化出新嫩茎和幼叶(图5-B),且以2.0 mg/L 6-BA的效果较好。在6-BA质量浓度不变的条件下,从增殖系数及芽增殖、生长情况来看,0.4 mg/L NAA的效果更好。因此,朝鲜淫羊藿丛生芽增殖的最适培养基为1/2MS+2.0 mg/L 6-BA+0.4 mg/L NAA。
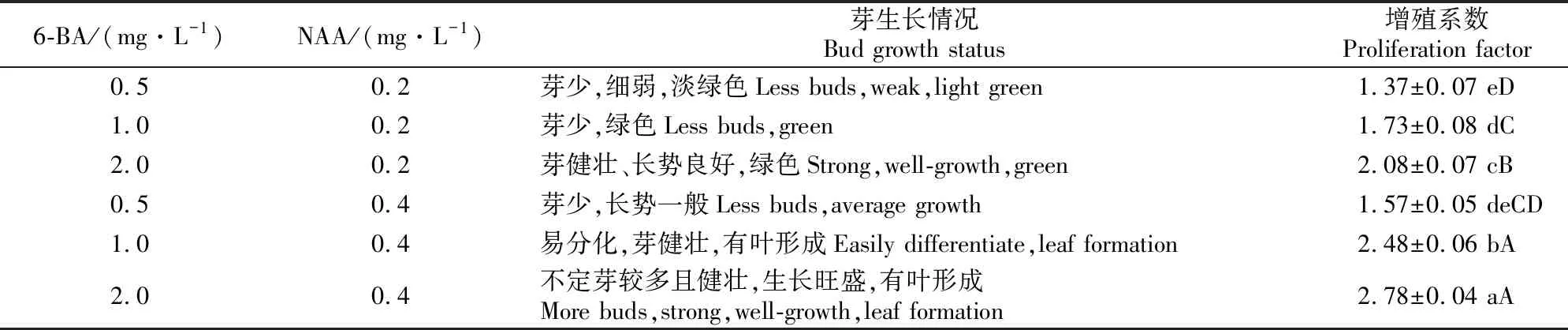
表7 6-BA和NAA对朝鲜淫羊藿丛生芽增殖的影响

A.丛生芽;B.丛生芽最佳增殖效果
2.5 NAA和IBA对朝鲜淫羊藿幼苗生根的影响
接入以NAA为主要生根激素的培养基培养约40 d时,朝鲜淫羊藿幼苗与培养基接触部分产生小块浅黄色愈伤组织,并在愈伤组织上出现新的幼茎;50 d时,幼苗与愈伤组织相接处分化出白色突起,并逐渐生长形成白色须根,逐渐沿与培养基平行方向延伸,根数2~5条。表8显示,在添加NAA的培养基中,随NAA质量浓度提高,生根率呈先上升后下降趋势,其中以0.5 mg/L NAA处理的生根率最高,为43.33%,此时每株幼苗根数较多、根长较长,整株生长旺盛(图6-A);当NAA质量浓度为1.0 mg/L 时,幼苗基部有大量白色愈伤组织形成,须根生长异常,植株底部叶片色泽变暗,整株幼苗较矮小(图6-B)。

A.0.5 mg/L NAA处理;B.1.0 mg/L NAA处理;C.0.5 mg/L IBA处理
以IBA为主要生根激素培养基时,出现可见根原基的时间与在NAA 培养基上相近;在幼苗与培养基相接的基部产生白色突起,且逐渐伸长形成白色、细长的须根(图6-C);生根过程几乎未在基部产生愈伤组织。由表8可见,IBA质量浓度为0.1 mg/L时,无根系生成,且植株长势较弱; IBA质量浓度为0.5,1.0 mg/L 时,均有根系形成,生根率分别为36.67%,28.33%。但与NAA相比,IBA处理的诱导生根率偏低。

表8 NAA和IBA对朝鲜淫羊藿丛生芽生根的影响
3 结论与讨论
朝鲜淫羊藿种子在低温潮湿环境下长时间层积,会使种子感染细菌、真菌乃至内生菌,仅对种子表面消毒,很难达到预期的消毒效果。本试验表明,对朝鲜淫羊藿的最佳消毒方式为先用体积分数0.1% HgCl2在种子表面消毒8 min,再对种胚消毒5 s,该条件下消毒率为71.11%,此方式不仅内外兼顾,还对种胚活性有一定的保护作用,这与王伟达等[11]在长白落叶松愈伤组织诱导试验中的消毒方法一致。但用体积分数0.1% HgCl2的消毒时间较长,今后可尝试使用体积分数0.2% HgCl2消毒,以期获得更高的种胚存活率。
蔗糖在朝鲜淫羊藿种胚诱导愈伤组织过程中作用显著,最适质量浓度为30 g/L,这既能提供满足种胚愈伤组织诱导中的能量需求,又能维持培养基的渗透压,促使培养基和种胚两者之间水分处于动态平衡状态。
激素种类、浓度、组合方式等在植物脱分化、再分化及相关过程中起着重要作用。本试验中,6-BA和NAA在诱导愈伤组织时作用明显,最佳配比为1.0 mg/L 6-BA+0.5 mg/L NAA,这与王晶等[7]对朝鲜淫羊藿及刘晨旭等[12]对地被菊的试验结果一致,与王伟达等[11]在红松种胚上的结论相似,但与周海琴等[13]在巫山淫羊藿种胚上的试验结果不同,可能与不同种胚之间成熟度、内源激素种类和水平、地理位置、气候环境等因素的差异有关。在5种愈伤组织增殖培养基中,KT和NAA激素组合的增长率(172.67%)和愈伤组织质地俱佳,6-BA与NAA、2,4-D与NAA组合也较单独使用NAA效果好,说明KT、6-BA、2,4-D与NAA在增殖过程中存在明显的协同作用。但2,4-D长时间使用会使愈伤组织出现褐化现象,这与亓磊等[14]在黄波罗愈伤试验中观察到的现象相近,因此需合理控制愈伤组织在含2,4-D的培养基中的培养时间。2.0 mg/L 6-BA+0.4 mg/L NAA对丛生芽增殖效果明显,这与周海琴等[15]的研究结果一致,但增殖系数(2.78)较低,可能是由于愈伤组织分割后,芽长势减弱,需要恢复一段时间才能继续分化增殖。庄春慧等[16]也发现,玉蝉花丛生芽培养过程中容易出现黄化、玻璃化等现象,及时清理问题区域,转入新培养基中,可对丛生芽起保护作用。
在植物生根培养过程中,激素NAA与IBA较为常用且生根效果明显[17]。本试验发现,0.5 mg/L NAA为朝鲜淫羊藿生根的最适条件,生根率为43.33%。可能是因为此时NAA对内源IAA的生成有促进作用,利于生根,这与庄春慧等[16]、马欣等[18]的结论相似,但与周海琴等[15]和杨镇等[19]的结论不同,可能与植物生根培养所采用的基本培养基及植物累积激素种类和浓度不同有关。幼苗生根培养周期较长,每隔20 d需更换1次新培养基,以避免幼苗出现玻璃化现象,并且增加植物长势,有助于生根。从生根结果来看,生根率均偏低,生根效果较差,因此需对光照强度、温度及基础培养基类别等进行进一步研究,以改善生根效果。
