TNF-α、CD40基因多态性与乙肝肝硬化的相关性研究
2019-10-08吴应冬周宝勤周安琪
吴应冬,周宝勤,谢 群,周安琪
(海安市人民医院感染科,江苏海安 226600 )
乙型病毒性肝炎(乙肝)作为我国最常见的传染病,在慢性乙肝的进展中,随着肝小叶结构的破坏及肝纤维化的形成,最终会导致肝硬化的发生[1-2]。既往研究发现HBV感染过程中,肿瘤坏死因子α(TNF-α)可以通过核因子-B细胞κ链(NF-κB)使细胞毒性T淋巴细胞激活,抑制甚至清除乙肝病毒;其次,TNF-α的水平与乙肝的病情程度及临床类型也密切相关[3-4]。TNF-α基因长约2 676 bp,因为在细胞中不存在,在刺激时它是由细胞合成的。因此,SNP基因启动子区具有重要意义。目前,TNF-α基因多态性多见于不同位点比如308位点、238位点等。启动子308多态性与慢性乙型肝炎、肝硬化患者、肝癌患者等密切相关[5]。亦有研究证实肝硬化与CD40-CD40L信号转导途径相关[6]。此次研究中检测TNF-α、CD40基因多态性与乙肝肝硬化的关系,现报道如下。
1 资料与方法
1.1一般资料 选取2015年12月至2017年12月本院收治的150例经过肝硬化患者作为观察组。肝硬化诊断标准参考“病毒性肝炎防治方案”[7]。另外选取同期150例体检健康者作为对照组,两组患者的年龄、性别差异无统计学意义(P>0.05)。见表1。
1.2方法
1.2.1标本采集 分别抽取观察组及对照组的全血1 mL,用EDTA抗凝。4 ℃,3 000 r/min离心5 min,分离上清,收集细胞沉淀用于基因组DNA检测。

表1 两组患者的一般资料比较
1.2.2基因型鉴定 采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)结合测序。(1)PCR扩增:包括308位点的TNF-α、sl883832位点及rs48 10485位点的CD40。聚合酶链反应总体积为20 μL,基因组DNA为2 μL,下游引物1 μL(序列见表2),Taq酶1 U,10×PCR缓冲液2 μL,25 mmol/L MgCl22 μL,25 mmol/L dNTPs 2 μL,去离子水9.8 μL。程序设定:先94 ℃ 5 min;然后94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s循环;72 ℃ 10 min。在含EB代用品的10 g/L琼脂糖凝胶上电泳,用紫外分光度法观察结果。(2)PCR扩增产物在含EB替代物的10 g/L琼脂糖凝胶上电泳,用UV灯观察,并与标记物进行酶切比较。(3)PCR产物直接作为酶切底物,反应的步骤和方法参照各内切酶的说明,在30 g/L琼脂糖凝胶上电泳2 h。

表2 引物序列
1.3统计学处理 采用SPSS19.0分析,以Hardy-Weinberg平衡检验分析研究样本的群体代表性计算每组的基因型频率和等位基因频率。P<0.05为差异有统计学意义。
2 结果
2.1TNF-α-308G/A多态性的分析 利用TNF-α-308G/A多态性扩增了含-308位点的α,扩增产物为346 bp,如果-308位点为G,则将其切成24 bp和322 bp两个片段,因为该24 bp片段太小,不能在琼脂糖上看到,因此,只有一个322 bp的片段,如果-308位点是一个,就不会出现。用NCOI内切酶切,片段长度为346 bp,纯合子GA基因型为322 bp,杂合子基因型为322 bp/346 bp,纯合子AA基因型为346 bp1,见图1。

注:M为DNA标记物
2.2CD40-rsl883832位点的酶切结果 在CD 40基因的rsl883832位点上,C或T碱基发生了变化,根据限制性内切酶NCOⅠ限制性内切酶片段,有多种基因型,见图2。
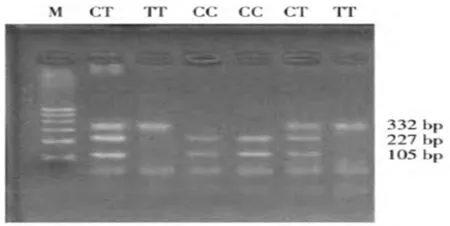
注:M为DNA标记物
2.3CD40-rs4810485位点的限制性酶切 CD 40基因的rs4810485位点有C或G的变化。根据限制性内切酶MSPL片段,有3个基因型:GG (272、163 bp)和CC(435 bp)、CG (435、272、163 bp),见图3。

注:M为DNA标记物
2.4TNF-α-308G/A、CD40-rsl883832、CD40-rs4810485位点的多态性分析 乙型肝炎后肝硬化患者和健康对照者相比较,肝硬化患者的TNF-α-308G/A的GA基因型明显高于健康者,差异有统计学(P<0.05)。肝硬化患者的CD40-rsl883832的CT、TT基因型明显高于健康者,差异有统计学(P<0.05)。TNF-α-308G/A的AA、GG基因型、CD40-rsl883832的CC基因型、CD40-rs4810485的基因型差异无统计学意义(P>0.05)。见表3。

表3 TNF-α-308G/A、CD40-rsl883832、CD40-rs4810485位点的多态性分析(n)
3 讨论
乙型肝炎后肝硬化的发病机制主要与乙肝病毒的感染和侵袭有关,也与患者的遗传易感性和免疫功能有关,在研究乙肝后肝硬化的遗传易感性过程中,TNF-α的产生受遗传因素的控制,TNF-α是第一种由炎性反应机制产生的细胞因子[8]。TNF-α主要由以下几个部分组成:单核细胞Kupffer细胞与其他细胞因子共同促进肝星状细胞的增殖和纤维增殖,抑制肝细胞的生长,阻止肝细胞的再生,参与肝硬化的形成和发展。持续高水平的α诱导可促进肝星状细胞的增殖和纤维增生,体外研究表明肿瘤坏死因子-α启动子-308a的等位基因与肝硬化的增加有关[9]。此次研究结果显示乙型肝炎后肝硬化患者和健康对照者相比较,肝硬化患者的TNF-α-308G/A的GA基因型明显高于健康者,差异有统计学意义(P<0.05),提示TNF-α-308G/A可作为肝硬化的诊断及治疗疗效评估。既往研究显示HBVDNA阳性患者的TNF-α含量明显高于阴性组,且提示TNF-α启动子区-308G/A基因型及等位基因在健康人与乙肝肝硬化以及慢重肝3种不同HBV慢性感染临床类型中分布频率之间的差异。且在重度乙肝、乙肝肝硬化、慢性重型肝炎及原发性肝癌患者的血清学检测发现TNF-α均处于高活性状态,其含量明显高于慢乙肝轻度患者,并且发现它的含量与病毒复制活跃有关。汉族人群中TNF-α基因多态性与不同慢性肝病的关系本研究在一定程度上反映了TNF-α-308G/A的GA基因型可以作为肝硬化的预测指标[10]。
乙型肝炎的发病机制非常复杂,目前认为宿主免疫功能障碍是其病理损害的主要原因,而T细胞是免疫系统的重要组成部分,它的激活不仅需要直接刺激外源抗原,还需要细胞间表面分子的相互作用来传递共刺激信号[11-12]。CD40-CD40L通路是另一种重要的途径,它不仅参与和维持正常生理状态中许多重要的生理功能,许多病理过程往往是由该通路的失调或紊乱以及低或无能力引起的[13]。单用CD 40单克隆抗体也能促进B细胞的增殖,使B细胞表面的许多黏附分子具有较高的亲和力,导致细胞聚集,从而促进T细胞的相互作用[14]。此次研究结果提示CD40-rsl883832可作为肝硬化的诊断及治疗疗效评估。肝硬化患者的CD40-rsl883832的CT、TT基因型明显高于健康者,差异有统计学意义(P<0.05)。既往研究显示CD40的阳性表达在正常脾脏与巨脾组织中存在显著差异,而且其表达随肝功能不全的加重和巨脾分级增高而逐渐降低。这表明肝硬化门静脉高压症时巨脾的免疫功能状态处于明显低下的状态,CD40有可能成为一种术前判定肝硬化及脾脏免疫功能的有价值的检测指标,对于指导肝硬化门静脉高压症术中脾脏的处理方式提供了一定的试验依据[15]。TNF-α-308G/A的AA、GG基因型、CD40-rsl883832的CC基因型、CD40-rs4810485的基因型差异无统计学意义(P>0.05)。
4 结论
综上所述,乙型肝炎后肝硬化患者的TNF-α-308G/A的GA基因型明显高于健康者,TNF-α-308 a、CD40-rsl883832基因可以选为肝硬化易感基因的遗传标记,应用前景广泛。
