血清IL-17、IL-22、IL-26与脓毒症相关肾病损伤的相关性分析
2019-10-08范红平毕凤清和迎春
范红平,毕凤清,和迎春
(大理大学第一附属医院检验科,云南大理 671000)
脓毒症是由感染引起的全身炎性反应综合征(SIRS),很容易引发感染性休克和多器官功能障碍综合征,极易引起急性肾损伤(AKI),病死率很高[1]。脓毒症AKI的发病与炎性反应有密切关系,炎症细胞的激活和炎性因子的分泌可引起炎性反应导致肾小球急性损伤,进而发生肾衰竭[2]。Th17细胞是CD4+T细胞的一个亚型,可分泌多种细胞因子,其中白细胞介素(IL)-17是最主要的细胞因子,IL-22是IL-10家族成员,两者一起发挥协同作用,参与Th17细胞的效应功能,导致相应的炎性反应[3-4]。IL-26也是Th17细胞分泌的细胞因子,但对其研究较少。为了探讨血清IL-17、IL-22、IL-26与脓毒症相关肾病损伤的相关性。现将研究结果报道如下。
1 资料与方法
1.1一般资料 选取2016年9月至2018年9月期间本院收治的146例脓毒症患者作为研究对象,所有患者均经临床症状及体征、生化指标、病理学检测及影像学检查确诊。纳入标准:均符合2001年国际脓毒症会议标准[5];年龄均≥18岁;本研究经过医院伦理委员会批准;研究对象均知情同意。排除标准:慢性肾功能损伤;恶性肿瘤;免疫系统疾病;孕妇及哺乳期妇女。根据是否合并AKI分为单纯脓毒症(n=81)和脓毒症合并AKI组(n=65)。单纯脓毒症有男性43例,女性38例,年龄37~80岁,平均(51.36±5.14)岁,BMI平均(23.15±2.46) kg·m2;脓毒症合并AKI组有男性35例,女性30例,年龄36~81岁,平均(51.84±4.93)岁,BMI平均(23.76±2.63) kg·m2。根据不同预后分为恶化组(n=45)和好转组(n=101)。两组间基本资料无统计学差异(P>0.05)。
1.2方法 所有患者于清晨抽取空腹静脉血8 mL,经3 000 r/min离心10 min,获得血清后置于-80 ℃冰箱保存待检。采用日立7600生化分析仪及其配套试剂盒检测肾功能指标血肌酐(Scr)、尿素氮(BUN)、尿酸(UA),肾小球滤过率(eGFR)采用简化的肾脏病饮食改良方程(MDRD):eGFR=186×(Scr/88.4)-1.154×(年龄)-0.203×(0.742女性)。C反应蛋白(CRP)和降钙素原(PCT)采用免疫层析法检测,试剂盒来自武汉明德生物科技股份有限公司;IL-17、IL-22、IL-26均采用酶联免疫吸附法检测,试剂盒均来自上海康朗生物科技有限公司。
1.3统计学处理 本次研究结果采用SPSS19.0统计学软件进行分析,生化指标为计量资料,两组间均数比较采用t检验方法分析;采用Pearson相关分析与logistic多元回归相关分析对影响因素进行分析。当P<0.05表示差异有统计学意义。
2 结果
2.1脓毒症相关肾病损伤的单因素分析 脓毒症合并AKI组Scr、BUN、eGFR、UA、APACHEⅡ评分、CRP、PCT、IL-17、IL-22、IL-26均显著高于对照组(P<0.05),见表2。
2.2脓毒症相关肾病损伤的logistic回归分析 以是否发生肾损伤作为因变量,以PCT、CRP、IL-17、IL-22、IL-26作为自变量,经logistic回归分析,PCT、CRP、IL-17、IL-22、IL-26是脓毒症患者相关肾病损伤的影响因素。见表2。
2.3IL-17、IL-22、IL-26与脓毒症合并AKI组肾功能指标的相关性 经过Pearson相关性分析,IL-17、IL-22、IL-26与脓毒症合并AKI患者Scr、BUN、eGFR、UA均呈正相关(P<0.05)。见表3。
2.4脓毒症合并AKI患者不同预后血清IL-17、IL-22、IL-26水平的比较 脓毒症合并AKI患者好转组血清IL-17、IL-22、IL-26水平显著低于恶化组(P<0.05),见表4。

表1 脓毒症相关肾病损伤的单因素分析
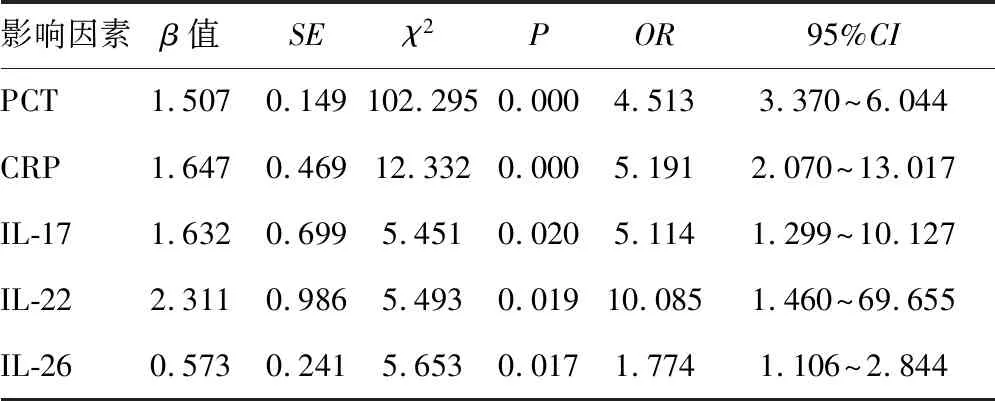
表2 脓毒症相关肾病损伤的logistic回归分析

表3 IL-17、IL-22、IL-26与脓毒症合并AKI组肾功能指标的相关性分析

表4 脓毒症合并AKI患者不同预后血清IL-17、IL-22、IL-26水平的比较
3 讨论
AKI是脓毒症最严重的并发症之一,其主要的病理变化是急性肾小管坏死,其发生机制可能与肾脏缺血-再灌注损伤、炎症瀑布效应、细胞凋亡等有关,其中失控性的放大炎性反应起关键作用[6-7]。
IL-17是淋巴细胞分泌特征性细胞因子,是一种重要的促炎递质,可诱导促炎细胞因子和趋化因子的表达,引起炎性细胞浸润和组织破坏[8]。IL-17与多种细胞因子可产生协同作用,放大炎性反应,参与机体的抗感染免疫、自身免疫性疾病等病理性炎症过程[9]。陈贵艳等研究表明[10],IL-17与脓毒症病情严重程度呈正相关,且可以有效预测脓毒症患者的病死率。Th22细胞可特异性分泌IL-22,作为一种促炎因子,IL-22可诱导大量促炎细胞因子和趋化因子的表达,促进炎性细胞向感染部位募集,放大机体炎性反应[11]。IL-22参与抗微生物防御、保护和修复组织损伤、急性期反应,在脓毒症中有重要作用[12]。刘爽等研究表明[13],脓毒症患者外周血Th22和IL-22水平明显提高,外周血Th22与PCT、APACHE II评分呈正相关。IL-26主要由活化的T细胞和NK细胞分泌,参与调节免疫、细胞增殖与凋亡、抗病毒、抗肿瘤等过程,在感染性疾病中可能既可促进病原体的清除,又可保持病原体的持续感染,具有双重作用[14-15]。
本文研究结果表明,脓毒症合并AKI组Scr、BUN、eGFR、UA、APACHEⅡ评分、CRP、PCT、IL-17、IL-22、IL-26均显著高于对照组。提示脓毒症合并AKI患者除了肾功能指标异常外,还存在较高的炎症程度。经logistic回归分析,IL-17、IL-22、IL-26是脓毒症患者相关肾病损伤的影响因素。经过Pearson相关性分析,IL-17、IL-22、IL-26与脓毒症合并AKI患者Scr、BUN、eGFR、UA均呈正相关。提示IL-17、IL-22、IL-26与脓毒症合并AKI患者的肾功能损伤密切相关,且是其预警因素。推测其可能原因是脓毒症患者血液循环中有高浓度的内毒素,进而刺激单核细胞和肾小球系膜细胞生成大量的细胞因子和炎性介质,其中就包括IL-17、IL-22、IL-26,IL-17和IL-22通过促进其他炎性因子的分泌及协同作用,放大炎性反应,形成“瀑布效应”,还可引起肾实质的炎症细胞浸润,对肾脏实质细胞产生损害;另外,IL-26可能会引起肾小管上皮细胞凋亡,直接损害肾脏功能。另外,本研究还表明,脓毒症合并AKI患者好转组血清IL-17、IL-22、IL-26水平显著低于恶化组(P<0.05)。提示经过治疗,血清IL-17、IL-22、IL-26水平明显下降,其与脓毒症合并AKI患者的预后情况也有一定相关性,为临床评估预后提供参考依据。
4 结论
IL-17、IL-22、IL-26是脓毒症相关肾病损伤的独立影响因素,可能共同参与其肾损伤病理过程,且这三项指标可作为评估预后的参考指标。
