基于钴金属有机骨架材料(ZIF-67)催化性能的牛奶中大肠杆菌O157:H7快速定量检测
2019-10-08王淑娟方水琴田亚晨董庆利许东坡
王淑娟,刘 程,方水琴,田亚晨,董庆利,王 翔,许东坡,*,刘 箐,2,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071)
大肠杆菌O157:H7(Escherichia coli O157:H7)属革兰氏阴性杆菌,是最常见的食源性致病菌之一,在世界范围内普遍存在,广泛分布于土壤、水和食物中[1]。它是出血性结肠炎和溶血性尿毒症综合征的主要致因[2]。该菌引起的发病率高,低至100 个大肠杆菌O157:H7细胞可引起易感病人肠道内的病原体生长,产生志贺毒素[3]。因此对大肠杆菌O157:H7的高灵敏度、快速和选择性检测对预防疾病爆发,保障食品安全和人体健康具有重要意义。
目前,大肠杆菌O157:H7最常用的检测方法包括传统培养法、酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)[4]和聚合酶链式反应(polymerase chain reaction,PCR)[5]。传统培养法包括预富集、选择性富集、生化筛选和血清学确认,费时费力[6]。PCR等分子方法虽然灵敏度高,能实现快速检测[7],但通常需要DNA提取等样品预处理步骤,且聚合酶易被某些样品成分抑制,有样品交叉污染的风险,限制了其在发展中国家的应用[8]。免疫学分析取决于抗原和抗体之间的特定相互作用,此类用于检测大肠杆菌O157:H7的方法有电致化学发光传感器[9]、电化学生物传感器[10]、荧光生物传感器[11]、化学传感器[12]等,这些方法处理简单、分析时间短、灵敏度高,在实际应用中具有良好的潜力。
常规ELISA中,通常采用碱性磷酸酶或辣根过氧化物酶(horseradish peroxidase,HRP)催化底物产生检测信号。该方法的灵敏度低且需预增菌等步骤,整个检测过程长达7 h。HRP作为催化剂有很多的局限性,如热稳定性差、纯化时间长、成本高、最佳pH值范围窄,且对大多数有机溶剂和金属离子的耐受性低等[13]。这些内在缺陷极大地阻碍了天然酶的实际应用。解决这一问题的方法是构建更稳定、更容易获取的仿生酶,包括贵金属及其合金、环糊精、金属有机骨架等。金属有机骨架材料是利用各种金属离子和有机连接体设计的一类先进的具有高孔隙率的晶体材料。因其具有热稳定性、离散结构有序、密度低、比表面积大(超过6 000 m2/g)、易于合成以及适用于物理和化学应用的广谱特性,在气体储存或分离[14]、药物运输[15]、催化[16]等领域引起了广泛关注。目前报道已经有20 000 个金属有机骨架材料具有催化性能[17],如MIL-68、MIL-100、Cu-MOF等。如Zhang Jianwei等[18]发现两种Fe(III)基金属有机骨架具有类似于过氧化物酶的作用,利用这一特性建立了一种简单、高灵敏度的比色法检测过氧化氢(H2O2)和抗坏血酸。Wang Shuqin等[19]合成了Cu-MOF材料经戊二醛活化后与金黄色葡萄球菌适配体结合,利用Cu-MOF的催化性能检测牛奶中的金黄色葡萄球菌,检测范围为50~10 000 CFU/mL,检测限为20 CFU/mL。
本实验以大肠杆菌O157:H7为检测对象,结合金属有机骨架材料(ZIF-67)的催化性能,替代传统的HRP对抗体进行标记,并通过磁性微球富集目标物,建立一种新型的基于双抗体夹心法的牛奶中大肠杆菌O157:H7的快速定量检测方法。该方法旨在尝试将金属有机骨架材料与食源性致病菌检测相结合,建立食源性致病菌检测方法。
1 材料与方法
1.1 材料与试剂
蒙牛利乐包牛奶 市购。
大肠杆菌O157:H7(ATCC43895)、单核细胞增生李斯特菌(ATCC43251)、鼠伤寒沙门氏菌(CMCC(B)50115)、大肠埃希氏菌(ATCC25922)、金黄色葡萄球菌(ATCC29213)均为本实验室保藏。
营养肉汤培养基、营养琼脂培养基、大肠杆菌O 1 5 7:H 7显色培养基 北京陆桥技术股份有限公司;CoCl2-6H2O、3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)、30% H2O2、氢氧化钠(NaOH)、无水乙醇、浓硫酸、50%戊二醛 国药集团化学试剂有限公司;氨基功能化磁性微球(Fe3O4-NH2,200 nm) 阿拉丁试剂公司;2-甲基咪唑阿达玛斯试剂公司;HRP、牛血清白蛋白(bovine serum albumin,BSA) Sigma-Aldrich(上海)贸易有限公司;大肠杆菌O157:H7多克隆抗体和单克隆抗体(D3)由本实验室自制,效价分别为1∶8 000和1∶64 000。
1.2 仪器与设备
ZD-600加热搅拌器 上海实验仪器厂有限公司;SpectraMaxM2酶标仪 美国Molecular Devices公司;Philips XL30扫描电镜(scanning electronic microscopy,SEM) 荷兰Netherlands公司;D4 X射线衍射(X-ray diffraction,XRD)仪 德国Bruker公司;Electron Nicolet 380傅里叶变换红外光谱 美国Thermo公司;DHG-9203A烘箱 上海一恒科学仪器有限公司;5810R高速离心机 艾本德中国有限公司;7100恒温水浴锅日本日立公司;BSC-1600IIA2生物安全柜 苏净科学器材有限公司。
1.3 方法
1.3.1 ZIF-67的合成
Bola型两亲性表面活性剂依据文献[20]合成。ZIF-67的合成方法参照Pan Yong等[21]并加以改进,具体方法如下:称取0.056 g Bola型两亲性表面活性剂溶于400 mL水中,80 ℃分散溶解,加入1.64 g 2-甲基咪唑,4.74 g CoCl2·6H2O,继续搅拌反应4 h,反应产物经离心分离后乙醇和水洗涤3 遍,70 ℃烘箱干燥12 h。
1.3.2 ZIF-67的表征
XRD分析可获得ZIF-67的晶体结构,该扫描条件为电压40 kV、电流40 mA、扫描范围10°~80°、步宽0.02°、扫描速率10°/s;以扫描电子显微镜研究ZIF-67的形貌、结构以及颗粒大小等,加速电压20 kV,样品室真空度小于2.7×10-5Pa。
1.3.3 ZIF-67类过氧化物酶性能分析
以H2O2为底物,TMB为供氢体,浓硫酸为反应终止液,检测A450nm,比较0.5 mg/mL HRP与1 mg/mL ZIF-67的催化性能。
1.3.4 温度、pH值、反应时间、TMB浓度对ZIF-67催化性能的影响
为研究ZIF-67纳米粒子的催化作用,对温度(4、25、37、40、50、60、70、80 ℃)、pH值(0.1 mol/L NaOH,蒸馏水,0.5、1、2 mol/L H2SO4)、反应时间(0、5、10、15、20、25、30、35、40、45 min)、TMB浓度(50、100、150、200、250、300、350、400、500 μmol/L)进行研究。进行单因素研究时,保证其他条件一致。称取0.05 g ZIF-67溶解于100 mL蒸馏水中,超声溶解,配制成0.5 mg/mL的ZIF-67溶液。于常温下保存待用。反应后的溶液在离心管中混匀后转移至96 孔酶标板中,每孔加200 μL,测定A450nm。每个处理2 个平行。
1.3.5 细菌的培养
将大肠杆菌O157:H7(ATCC 43895)、单核细胞增生李斯特菌、鼠伤寒沙门氏菌、大肠埃希氏菌、金黄色葡萄球菌分别接种于20 mL营养肉汤培养基中,在恒温振荡培养箱内37 ℃、180 r/min培养12 h,取1 mL菌液,8 000 r/min离心10 min,弃上清液,沉淀用1 mL无菌磷酸盐缓冲溶液(phosphate buffer saline,PBS,pH 7.4)重悬。用无菌PBS将重悬后的大肠杆菌O157:H7纯菌液进行10 倍系列稀释。
1.3.6 Fe3O4-NH2与大肠杆菌O157:H7多克隆抗体的结合
采用戊二醛活化法对材料进行活化,具体方法如下:称取0.1 g氨基功能化磁性微球用0.01 mol/L的PBS冲洗3 遍后,分散于含20 mL 0.01 mol/L PBS(pH 7.4)的50 mL离心管中,加入50%戊二醛使其最终质量浓度为1.25 g/100 mL,37 ℃摇床活化2 h后,用磁铁完全吸附后倒去上清液,沉淀用无菌水冲洗3 次,以去除残留的戊二醛;随后,加入10 mg大肠杆菌O157:H7多克隆抗体,混合物在4 ℃摇晃24 h后用磁铁完全吸附Fe3O4-NH2-抗体复合物后倒掉上清液,以去除多余未结合的抗体。然后,用1% BSA重悬Fe3O4-NH2-抗体复合物后在4 ℃封闭2 h,以避免非特异性吸附。最后,通过磁铁吸附、无菌水冲洗等步骤后,重悬于10 mL 0.01 mol/L PBS(pH 7.4)中,放置4 ℃保存。
1.3.7 ZIF-67与大肠杆菌O157:H7单克隆抗体D3结合
同样采用戊二醛活化法,称取0.06 g ZIF-67用0.01 mol/L的PBS冲洗3 遍,经8 000 r/min离心5 min后,分散于含20 mL 0.01 mol/L PBS(pH7.4)的50 mL离心管中,加入50%戊二醛使其终质量浓度为1.25 g/100 mL,37 ℃摇床活化2 h。活化后的ZIF-67经8 000 r/min离心5 min弃掉上清液,沉淀用无菌水冲洗3 次,以去除残留的戊二醛;随后,加入4 mg大肠杆菌O157:H7单克隆抗体(D3),混合物在4 ℃搅拌24 h,反应产物在4 000 r/min离心10 min以去除多余的抗体。然后,用1% BSA 4 ℃封闭2 h,以避免非特异性吸附。最后,通过离心、水冲洗后,重悬于10 mL 0.01 mol/L PBS(pH 7.4)中,放置4 ℃保存。
1.3.8 细菌培养及计数
将冻存在-80 ℃的甘油菌经2 次活化后,按1∶100的比例转接到20 mL新鲜的营养肉汤培养基中,置于37 ℃摇床培养过夜。
计数方法:在生物安全柜中,从上述菌液中吸取100 μL加到含900 μL的无菌PBS的离心管中,振荡数秒计为10-1倍稀释,按照此方式,依次进行10 倍稀释分别计为10-2、10-3、10-4、10-5、10-6混匀后分别吸取100 μL涂布于营养琼脂平板上,每个稀释度作3 次平行。倒置后于37 ℃培养48 h。按照GB 4789.2—2016《食品微生物学检验 菌落总数测定》方法进行菌落计数。
1.3.9 新型基于ZIF-67的双抗体夹心法在食品中大肠杆菌O157:H7的实际检测
在1.5 mL离心管中依次加入100 μL Fe3O4-NH2-多抗、100 μL ZIF-67-D3和50 μL大肠杆菌O157:H7(101、102、103、104、105、106、107、108CFU/mL),混匀后在37 ℃培养箱中孵育30 min。反应结束后用磁铁吸附2 min后弃去上清液,并用0.01 mol/L无菌PBS进行清洗3 次并弃掉上清液;然后分别依次在离心管中加入100 μL 0.5 mmol/L TMB和100 μL 1 mol/L H2SO4;混匀并用磁铁吸附2 min后吸取200 μL上清液至96 孔酶标板中,置于SpectraMax M2酶标仪中读取A450nm;以A450nm为纵坐标,大肠杆菌O157:H7浓度为横坐标,建立标准曲线,以0.01 mol/L PBS为空白对照得到A0,浓度梯度的大肠杆菌O157:H7得到A,最后结果以A-A0计算得到线性方程,并计算R2值。
1.3.10 方法的特异性及实际应用研究
将冻存在-80 ℃的甘油菌(大肠杆菌O157:H7(ATCC 43895)、大肠埃希氏菌、鼠伤寒沙门氏菌、单核细胞增生李斯特菌及金黄色葡萄球菌)经2 次活化后,按1∶100的比例转接到20 mL新鲜的营养肉汤培养基中,置于37 ℃摇床培养过夜。经平板计数后分别将5 种菌悬液稀释至106CFU/mL。100 μL Fe3O4-NH2-多抗、100 μL ZIF-67-D3和50 μL上述菌悬液(106CFU/mL),以无菌PBS作阴性对照,按照1.3.9节中的方法进行显色和计算。最后结果以A-A0计算作图,验证其特异性。
1.3.11 人工污染牛奶样品的检测
将大肠杆菌O157:H7人工接种到牛奶中,制备成人工污染的牛奶样品,浓度为3.3×102~3.3×105CFU/mL。按照上述方法进行吸光度的检测,以无菌牛奶做阴性对照,每个浓度分别用该方法和大肠杆菌O157:H7显色平板计数法做3 次重复。
1.4 数据处理
ZIF-67 XRD结果和傅里叶红外光谱结果导出txt文档后采用Graph Pad软件进行绘制。其余结果均通过Graph Pad软件绘制完成。
2 结果与分析
2.1 ZIF-67的合成与结果

图1 ZIF-67的SEM图谱(a)和XRD图谱(b)Fig. 1 SEM (a) and XRD (b) profile of ZIF-67
合成的ZIF-67为绿色粉末,SEM图谱(图1a)ZIF-67为规则的纳米薄片,尺寸约500 nm,XRD(图1b)结果表明ZIF-67的结晶度较好,和文献[21]中合成的ZIF-67出峰位置一致,说明ZIF-67合成成功。
2.2 ZIF-67与HRP催化性能的比较
如图2所示,H2O2存在时,ZIF-67和HRP都可以催化TMB显色,说明ZIF-67具有过氧化物酶样催化性能。而在H2O2不存在时,HRP不能催化TMB显色,而ZIF-67依然可以催化TMB显色,对此现象的解释为金属有机骨架材料能够提供具有活性金属中心的非常高的表面积,确保了在活性金属中心的情况下,氧气容易进入,从而发挥其催化作用[19,22]。
2.3 温度、pH值、反应时间、TMB浓度对ZIF-67催化性能的影响
ZIF-67催化TMB显色不需要H2O2即可完成,所以不再讨论H2O2浓度对其催化性能的影响。如图3所示,ZIF-67催化反应最佳条件为室温、200 μmol/L TMB、0.5 mol/L硫酸终止液,且该催化作用不受时间的限制。基于以上最佳反应条件,以ZIF-67浓度为横坐标,吸光度为纵坐标绘制标准曲线,结果表明ZIF-67自身线性良好,R2为0.994 7。
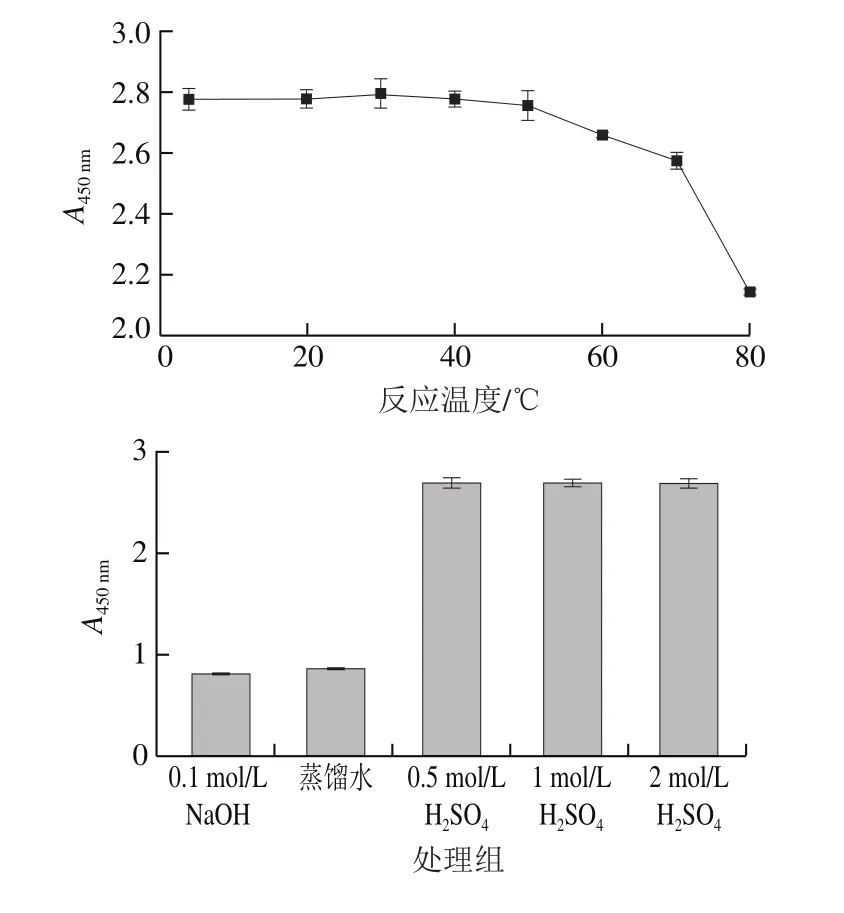

图3 反应条件对ZIF-67催化性能的影响Fig. 3 Effect of reaction conditions on catalytic performance of ZIF-67
2.4 定量检测大肠杆菌O157:H7方法的建立
由于氨基功能化磁性微球本身在无H2O2时不可催化TMB显色,所以本实验通过沉淀显色法:即通过氨基功能化磁性微球特异性富集大肠杆菌O157:H7后,检测与其结合的ZIF-67的量,从2.3节可知,ZIF-67本身线性良好,说明可以通过ZIF-67的量间接检测大肠杆菌O157:H7的量。通过上述方法,以大肠杆菌O157:H7浓度为横坐标,A-A0为纵坐标,建立大肠杆菌O157:H7浓度梯度标准曲线。大肠杆菌O157:H7的检测线性浓度范围为17~1.7×108CFU/mL(平板计数结果)。检测限通过计算3σ[23](σ为空白样品测量的标准偏差)为17 CFU/mL。R2为0.990 6,说明该方法可以用于大肠杆菌O157:H7的定量检测,且线性结果良好。
2.5 人工污染牛奶中大肠杆菌O157:H7检测及方法的特异性
对人工污染大肠杆菌O157:H7的牛奶样品,选取4 个稀释度(3.3×102~3.3×105),按照上述方法进行检测,与大肠杆菌O157:H7显色平板上的检测结果进行对比,表1表明,该方法的检测结果与平板计数结果一致,相对标准偏差为6.73%~11.4%,回收率为100%~105%。而且与常见的食源性致病菌(鼠伤寒沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、沙门氏菌、大肠埃希氏菌)进行对比(图4),该方法的特异性强。
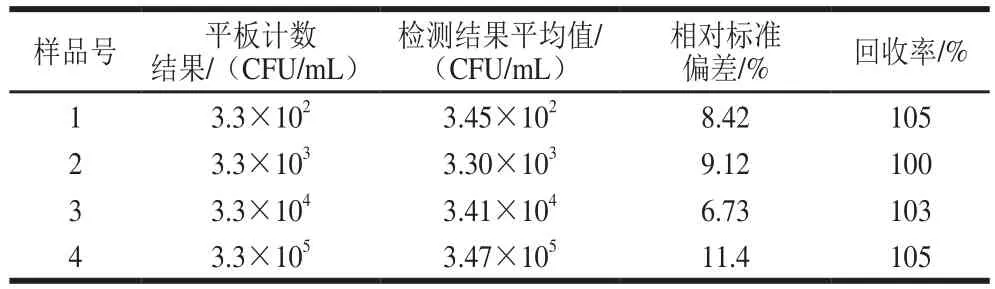
表1 人工污染牛奶样品中大肠杆菌O157:H7的检测Table 1 Detection of E. coli O157:H7 in real milk samples

图4 特异性分析Fig. 4 Analysis of specificity
2.6 与其他检测大肠杆菌O157:H7方法的比较
与其他方法相比(表2),本实验中的新型基于ZIF-67催化显色的免疫学方法检测大肠杆菌O157:H7的检测范围宽,检测限和PCR及其他高灵敏度传感器检测方法一致,且不需任何昂贵的仪器设备,操作简单、检测时间短、无需样品前增菌和预富集。

表2 与其他检测大肠杆菌O157:H7方法的比较Table 2 Comparison of this method with other methods for detection of E. coli O157:H7
3 结 论
本研究建立了一种基于金属有机骨架材料(ZIF-67)催化性能的快速检测牛奶中大肠杆菌O157:H7的方法。该方法的检测范围为17~1.7×108CFU/mL,检测限为17 CFU/mL。该方法是通过检测与大肠杆菌O157:H7结合的ZIF-67的量间接确定细菌数量的定量检测,检测过程可在1 h内完成。和其他检测方法相比,无需昂贵仪器及对样品的前处理。因此,该方法是一种特异性高、快速、灵敏度高的双抗体夹心免疫学检测方法,为大肠杆菌O157:H7的快速检测开辟了新途径,在食品检测领域具有很好的发展前景。
