魔芋葡甘露聚糖对镉所致的LO2细胞毒性损伤的影响
2019-10-08李莹馨王震宇覃文君
李莹馨,原 茜,王震宇,黄 磊,覃文君,赵 勤
(四川农业大学动物医学院猪病研究中心,四川 成都 611130)
【研究意义】镉(Cd)是一种毒性极强的环境污染物,近年来,随着工业的发展,环境中的镉污染已经严重危害到人类和动物的健康[1-2]。除肾脏之外,肝脏是镉进入机体后的重要的靶器官[3]。镉引发的肝脏毒性包括镉进入体内可致多种组织器官受损,从而产生急性毒性或者慢性毒性[4],对骨骼、肝脏、肾脏、免疫系统、心血管系统和生殖系统等产生毒性影响[5-7]。镉能在肝脏线粒体内引起氧化应激,并导致相应的氧化损伤[8-10],可导致相关的酶含量的变化。其中丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)都属于转氨酶,它们的值升高提示机体组织的损伤,尤其ALT是肝细胞损伤最敏感和特异的指标;丙二醛(MDA) 含量的变化可直接反映生物体内脂质过氧化的程度[11];谷胱甘肽过氧化物酶(GSH-Px)是机体内广泛存在的一种重要的过氧化物分解酶[12]。【前人研究进展】植物多糖具有广泛的药理作用,已成为生物学研究的热点[13]。魔芋葡甘露聚糖(Konjac Glucomannan,简称KGM)是魔芋的主要有效成分,是由葡萄糖和甘露糖以β-1,4糖甘键结合而形成的一种高分子化合物[14-15]。对KGM的研究已经证明,它能够有效地降低胆固醇、血糖和减肥,具有调节机体免疫功能、抑制肿瘤、抗衰老、抗病毒、降血脂、降血糖、抗氧化等多种生物活性[16-19]而被广泛应用于食品、医学、环保、生物学等领域。目前对KGM的利用报道主要集中在作为增稠剂、保水剂、胶凝剂、成膜剂、改善食品品质、改性等方面[18, 20]。但是KGM能否有效保护镉所致的LO2细胞的毒性损伤,尚未见报道。【本研究切入点】本研究以人正常肝细胞(LO2细胞)为实验对象,分别观察不同浓度的镉与LO2细胞单独作用及其与KGM联合作用后对细胞活力的影响。【拟解决的关键问题】以探讨KGM对镉引发的肝损伤的影响,为综合利用KGM和控制镉污染提供科学依据。
1 材料与方法
1.1 药品试剂
氯化镉(CdCl2·2.5 H2O)购自天津光复科技有限公司,氯化镉临用前用无血清DMEM高糖培养基配制成所需浓度并用0.22 μm的滤膜过滤除菌后待用;魔芋葡甘露聚糖(KGM)(纯度≥98 %)购自合肥博美生物科技有限责任公司;噻唑蓝(MTT)和二甲基亚砜(DMSO)均购自北京Solarbio公司;DMEM高糖培养基购自美国Gibco公司;胎牛血清(FBS)购自澳大利亚AusGeneX公司;丙氨酸转氨酶(ALT)测定试剂盒、天冬氨酸转氨酶(AST)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒(比色法)、丙二醛(MDA)测定试剂盒(微板法)均购自南京建成生物工程研究所。
1.2 仪器设备
倒置荧光显微镜(Nikon公司生产,TS100型号);全自动酶标仪(Thermo Fisher Scientific公司生产,型号3001);CO2恒温培养箱(Thermo Fisher Scientific公司生产,型号3111);超净工作台(苏州安泰空气技术有限公司生产,型号SW-CJ-1FD);超纯水机(四川优普超纯科技有限公司生产,型号UPH-I-20T);高速离心机(安徽中科中佳科学仪器有限公司生产,型号HC-2062);高压蒸汽灭菌锅(合肥华泰医疗设备有限公司生产,型号YX-280D)等。
1.3 细胞株
LO2细胞株由四川农业大学动物医学院袁志翔老师惠赠(ATCC来源)。
1.4 实验方法
1.4.1 LO2细胞培养及铺板 细胞接种于含10 % FBS的DMEM高糖培养液中,于37 ℃、5 %CO2及饱和湿度的培养箱中培养。每2 d换1次培养液,每天观察细胞生长情况,待细胞贴壁生长至90 %融合后,进行传代或冻存。传代时以0.5 %胰酶消化,1∶3比例传代培养,收集对数生长期LO2细胞,调整细胞密度至5000个/150μl·孔,加入96孔细胞板后培养至贴壁融合度达90 %时,弃去原培养液换为无血清DMEM高糖培养液继续培养24 h,以排除血清对实验结果的干扰后用于正式试验[21]。
1.4.2 确定KGM溶液对LO2细胞的最适作用浓度和无菌处理方式 因KGM是一种分子量大,水合能力强和不带电荷的高粘度的分子,溶于水后黏度极高[22],故需要进行KGM溶液对细胞作用的最适宜浓度和无菌处理方式的研究。
根据预实验的结果,用不含血清的DMEM高糖培养基作为溶剂来配制0.2、0.5和1 mg/mL的KGM溶液,分别采用0.22 μm滤膜过滤灭菌及121 ℃、30 min高压蒸汽灭菌方法灭菌后,再将经以上处理过的KGM溶液分别加入LO2细胞中进行培养12 h,MTT法测定其对细胞活力的影响,确定KGM溶液对细胞作用的最适宜浓度和无菌处理方式。
1.4.3 实验分组 分为正常细胞对照组(无血清DMEM培养基+细胞)、不同浓度的CdCl2(0.5、1、5、10、20、30、40、50 μmol/L)单独作用细胞组、不同浓度的CdCl2先作用3 h后再用KGM作用的细胞组、KGM先作用3 h后再用不同浓度的CdCl2作用的细胞组,空白调零组(无血清DMEM培养基)。以上各组细胞在分别培养12、24、36、48 h后进行后续测定。每组设重复12孔,试验重复3次。
1.4.4 MTT法测定细胞活力 细胞在培养时间终点前4 h,所有试验孔每孔都加入20 μl浓度为5 mg/mL的MTT溶液后继续无菌培养4 h,吸弃掉孔中液体,每孔再加入150 μl的DMSO后震荡10 min,在570 nm处测定OD值[23],细胞存活率的计算按以下公式进行:
细胞存活率(%)=
1.4.5 细胞培养上清液中ALT、AST、GSH-Px、MDA的检测 实验分组与加药处理同2.3,细胞按1×105个/孔的密度接种于24孔细胞板中,处理12 h后收集细胞培养的上清液,严格按照试剂盒说明书进行操作,检测细胞培养上清液中ALT、AST、GSH-Px、MDA的含量。
1.5 数据统计与分析
采用SPSS 22.0软件进行统计分析。试验数据以平均值±标准差(Mean±SD)表示,并进行方差分析,P<0.05为差异有统计学意义。

与空白对照组比较(* P < 0.05) Comparison with control group (* P < 0.05)图1 KGM溶液的无菌处理方式对LO2细胞活力的影响Fig.1 Effect of the different aseptic treatment ways for KGM solution on LO2 cell viability
2 结果与分析
2.1 KGM的最适作用浓度和无菌处理方式的选择
从图1中可以看出,采用121 ℃、30 min高压灭菌方法处理的0.2 和0.5 mg/mL KGM组与经滤膜过滤处理的0.2 mg/mL的KGM组均对LO2细胞生长具有一定的促进作用,其他组别均存在不同程度的抑制作用。倒置显微镜下观察同样可见,灭菌方法处理的0.2 mg/mL的KGM组的镜下形态和状态与对照组(无血清培养液处理组)差别不大。所以后续实验均选用对细胞生长促进作用最明显的用高压灭菌方法处理的0.2 mg/mL的KGM进行试验。

与空白对照组比较 (* P < 0.05)Comparison with control group (* P < 0.05)图2 不同浓度的CdCl2处理 LO2细胞后在不同时间段对细胞存活率的影响 Fig.2 Effect of different concentrations of CdCl2 on the viability of LO2 cells at different time
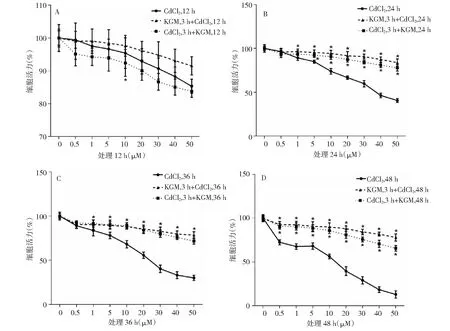
与镉单独作用组比较(* P < 0.05)Comparison with single Cd treatment group(P < 0.05)图3 KGM和不同浓度的CdCl2组合处理LO2细胞不同时间段后对细胞活力的影响 Fig.3 Effects of KGM combined with CdCl2 on the viability of LO2 cells in different time

表1 培养12 h 后ALT、AST、GSH-Px、MDA的检测
注:与空白对照组比较,*P< 0.05;与镉单独处理组比较,△P< 0.05。
Note: Compare with control group, *P< 0.05; Compare with single Cd treatment group, △P< 0.05.
2.2 镉单独作用对LO2细胞活力的影响
从图2可以看出,随着时间和浓度的增加,MTT法测出的LO2细胞活力均逐渐下降,结果表明,氯化镉对LO2细胞的增殖存在明显的剂量-效应关系。
2.3 KGM对镉所致的LO2细胞毒性的保护效果
从图3可以看出,在12、24、36和48 h时的细胞活力中,除了12 h这一组的单独染镉组细胞活力比先用镉处理3 h再用KGM处理12 h的细胞活力高之外,其余各个时间段,随着时间的增加,单独染镉组的细胞活力最低,先用镉处理3 h再用KGM处理的组细胞活力次低,而先用KGM处理3 h再用镉处理的组细胞活力最高。说明KGM对镉染毒的细胞具有保护效果,而且从保护效果来看,先用KGM处理3 h再用镉处理的组要比先用镉处理3 h再用KGM处理的组效果更好。
2.4 培养12 h后ALT、AST、GSH-Px、MDA的检测
由表1可以看出,与对照组相比:镉单独处理组、先用镉处理3 h再用KGM处理的组、先用KGM处理3 h 再用镉处理的组,其ALT、AST、MDA的检测结果都呈显著性差异;而仅有镉单独处理组的GSH-Px检测结果表现出显著性差异,其余各组无显著性差异。
与镉单独处理组相比:在ALT的检测结果上,空白对照组、KGM组、先用KGM处理3h再用镉处理的组均表现出显著性差异,而先用镉处理3 h 再用KGM处理的组则无显著性差异;在AST的检测结果上,每一个实验组都表现出显著性差异,但镉单独处理组的AST值最高,其次是先用镉处理3 h 再用KGM处理的组,而先用KGM处理3 h再用镉处理的组的AST值则明显降低;在GSH-Px的检测结果上,仅空白对照组差异显著,其余各组无显著性差异;在MDA的检测结果上,仅空白对照组和KGM组差异显著,其余各组则无显著性差异。
以上结果说明KGM对镉导致的细胞毒性具有保护效果,而保护效果的强弱与KGM对细胞的染毒作用方式相关,即先用KGM进行细胞保护后,对镉的毒性保护效果更好。
2.5 光镜下细胞形态观察
将正常细胞对照组、CdCl2(30 μmol/L)单独作用细胞组、CdCl2(30 μmol/L)先作用3 h 后再用KGM(0.2 mg/mL)作用的细胞组、KGM(0.2 mg/mL)先作用3 h 后再用CdCl2(30 μmol/L)作用的细胞组分别培养12 h 后,在显微镜下观察细胞形态并拍照,如图4~8所示。与对照组和KGM作用组相比, CdCl2(30 μmol/L)单独作用组的漂浮死细胞最多,贴壁生长的细胞数量极少;而CdCl2(30 μmol/L)先作用3 h后再用KGM(0.2 mg/mL)作用的细胞组其漂浮的死细胞也较多;KGM(0.2 mg/mL)先作用3 h后再用CdCl2(30 μmol/L)作用的细胞组虽有漂浮死细胞,但数量明显要少于CdCl2(30 μmol/L)单独作用组和CdCl2(30 μmol/L)先作用3 h 后再用KGM(0.2 mg/mL)作用的细胞组。说明从细胞形态上来看,KGM对镉导致的细胞毒性有保护效果。
3 讨论与结论
LO2细胞系是在人正常肝细胞原代培养的基础上,经特殊处理而获得的能连续传代的肝细胞,其生长和死亡的规律和人正常肝细胞较为接近,利用其进行试验,从而绕过从实验动物结果向人体外推的环节,较好地解决物种差异问题,而且还可以从细胞水平研究外源化学物质肝损伤的机制[24-25]。故本试验用LO2细胞系来研究镉引发的细胞损伤及探讨KGM的保护效果,所用细胞模型是可行的。

图4 空白对照组×100NFig.5 Blank control group x 10N

图5 KGM组×100NFig.5 KGM group x 10N

图6 单独镉染毒组×100NFig.6 Cd exposure group x 10N
有研究已经证明,镉进入体内后可导致多种组织器官受损从而产生急性或者慢性毒性[3],并能引起AST和ALT活性增高, GSH-PX活性升高和MDA量增加[26-27],导致LO2细胞存活率的下降[28]。在小鼠上的实验已经证实KGM可以通过降低MDA含量来提高机体的抗氧化活性[20, 29]。经氧化处理的KGM还可以增强LO2细胞的GSH-Px和CAT的活性,并提高细胞的抗氧化能力[30]。
本试验的研究表明,随着时间和CdCl2染毒浓度的增加,LO2细胞活力逐渐下降,符合剂量-效应关系,这为后续KGM保护效果的实验开展提供了细胞损伤的建模依据。而进行了KGM处理的细胞组,其细胞活力也都比镉单独处理组有明显的提高。而且从细胞形态学的观察情况来看,各试验组细胞的死亡好损伤情况与MTT法测定的结果也吻合。并且先用KGM对LO2细胞进行保护处理后再用镉染毒培养的LO2的细胞活力比直接用镉染毒后再用KGM处理的细胞活力高,且在ALT、AST、MDA这几个指标的测定中也表现出显著性。说明KGM作为一种功能性多糖可以通过改变细胞内ALT、AST、MDA水平的变化,从而对镉导致的LO2 细胞毒性起到一定的保护作用。

图7 先镉后KGM组×100NFig.7 Cd treated 3hours then treated with KGM group x 10N

图8 先KGM后镉组×100NFig.8 KGM treated then treated 3hours with Cd group x 10N
