丛枝菌根化滇重楼幼苗根际土壤微环境的研究
2019-10-08郭冬琴潘兴娇
张 华,郭冬琴,周 浓,潘兴娇,张 杰,罗 静
(1. 重庆三峡学院生物与食品工程学院,三峡库区道地药材绿色种植与深加工重庆市工程实验室,重庆 404120;2. 重庆第二师范学院生物与化学工程学院,重庆 400067)
【研究意义】滇重楼(ParispolyphyllaSmith var.yunnanensis(Franch.) Hand.-Mazz.)属于百合科植物,其是中药重楼的主要来源植物,以干燥的根茎入药,具有镇痛、抗肿瘤、止血等重要生物活性。但是滇重楼自然状态下其繁殖率极低,现有的野生滇重楼资源难以满足药材市场的供求。因此,如何高效栽培滇重楼已成为人们关注的焦点。丛枝菌根(Arbuscularmycorrhiza,AM)真菌是一类能与许多高等植物根系形成互惠共生体的土壤微生物[1-3]。AM菌根的形成可帮助宿主植物吸收N、P等矿物营养,促进植物生长,提高其抗逆性[4-7],因而被誉为“生物肥料”应用于农业化生产及药用植物栽培;同时AM菌根的形成也会影响植物根际土壤的微生态环境。【前人研究进展】其中土壤微生物以及土壤酶活性是土壤微生态系统重要组成部分,是评价土壤肥力、土壤健康状况的重要指标[8-10],但是很容易受到施肥制度、植被类型、根系分泌物等因子的影响[10-13]。【本研究切入点】许多研究表明,接种AM真菌有利于提高根际土壤微生物的数量和土壤酶活性。【拟解决的关键问题】本课题组前期也得到了同样的实验证据[13],本研究在此基础上,着重考察AM真菌对室温盆栽滇重楼幼苗根际土壤微环境的影响,比较AM真菌施用下幼苗与幼苗根际土壤质量的变化,为滇重楼人工栽培中更好的应用AM菌剂提供理论指导。

表1 接种不同AM真菌的处理组
1 材料与方法
1.1 供试材料
供试药用植物滇重楼的新鲜种子采自云南省大理州农业科学推广研究院种植基地,并经重庆三峡学院生物与食品工程学院周浓教授鉴定,其为百合科植物滇重楼[ParispolyphyllaSmith var.yunnanensis(Franch.)Hand.-Mazz.]成熟种子。用河沙去掉外滇重楼种子果皮,蒸馏水洗净,之后用10 %次氯酸钠溶液浸泡15 min,最后蒸馏水洗净,备用。紫云英种用蒸馏水洗净,之后用10 %次氯酸钠溶液浸泡15 min,最后蒸馏水洗净,备用。
供试AM真菌购自美国国际丛枝菌根真菌种质资源保藏中心(INVAM),相应AM真菌均为纯净菌剂(表1)。培养基使用牛肉膏蛋白胨琼脂培养基进行细菌分离计数、马丁培养基进行真菌分离计数、改良高氏Ⅰ号培养基进行放线菌分离计数[14]。
1.2 试验设计
试验土壤采用重庆三峡学院菜园土与河沙的混合物(体积比为3∶1),过筛并高压灭菌。栽培袋经10 %次氯酸钠溶液消毒并用蒸馏水洗净。选择饱满、大小均匀、无病虫害的滇重楼新鲜种子,将AM菌土(接种剂量每盆5 mL,约60个孢子/1 mL)均匀层施于滇重楼种子的表土下。同时播种紫云英进行混合培养,待滇重楼幼苗出土后,除去紫云英植株。共设计接种28种AM真菌组和CK(对照)组。每种处理10个重复(盆),每盆播种滇重楼种子50粒,出苗后间苗20株。接种后置于室温(自然光照)下培养。生长期间按滇重楼植株的常规管理进行管理。
1.3 根际土壤的采集和处理
于2014年11月12日在各组滇重楼幼苗倒苗后,采取四分法[15]取根系及黏附其上的土壤(根际土),收集于无菌塑料袋,一部分放保存于4 ℃条件下,用于后续土壤微生物分离和计数;剩余一部分风干后过筛(1 mm),用于后续土壤酶活性的测定。根系冰水浴洗净,剪为1.0~1.5 cm长的根段,用于后续菌根侵染率的测定。
1.4 测定指标与方法
1.4.1 滇重楼菌根侵染率的测定 将滇重楼根系浸泡于FAA固定液中,随机选取滇重楼根系30条,采用Philips 等[16]的方法进行染色、制片及镜检等处理,和之后采用Trouvelot等[17]的方法统计菌根侵染率。
1.4.2 土壤微生物的分离及计数 采用稀释平板计数法测定。土壤微生物数量以菌落数/克干土的形式表示。
1.4.3 土壤微生物多样性指数测定 采用Shannon指数[18]进行测定:H=-ΣPilnPi。式中,Pi为i类群个体数占总个体数的比例。
1.4.4 土壤酶活性测定 参照关松荫[19]的方法稍加改进进行土壤酶活性测定,即用离心替代过滤。蛋白酶采用改良茚三酮比色法测定,脲酶采用苯酚钠-次氯酸钠比色法测定,磷酸酶采用磷酸苯二钠比色法测定,过氧化氢酶采用紫外分光光度计法测定,蔗糖酶采用3,5-二硝基水杨酸比色法测定。
1.4.5 土壤微生物生物量碳测定 土壤微生物生物量碳采用氯仿熏蒸K2SO4提取-TOC仪测定法[20]。
1.5 数据处理
数据采用SPSS 19.0 及Microsoft Excel 软件对试验数据分析,并进行LSD检验和DUNCAN多重比较分析。
2 结果与分析
2.1 滇重楼幼苗菌根侵染状况
菌根侵染率反映AM真菌在宿主植物根内的发育状况[21]。从图1可知,28种AM真菌均能与滇重楼幼苗形成菌根共生体,并且与对照相比,各处理组侵染率均显著提高,侵染率在75.00 %~100.00 %,但各处理组间差异不显著。
2.2 不同处理对滇重楼幼苗根际土壤微生物数量的影响
如表2所示,接种不同AM真菌对滇重楼幼苗根际土壤微生物数量影响存在差异,其中细菌的数量在土壤微生物组成中占绝对优势,真菌次之,放线菌居第3。
Ec、Gr和Rfu接种处理后滇重楼幼苗根际土壤微生物总数量显著高于CK组。细菌分布与微生物总量分布一致,不同的AM真菌处理组细菌的数量在0.600×106~8.367×106CFU·g-1之间,其中Ec、Gr和Rfu接种处理组显著高于对照,分别增加了4.40、4.16和3.91倍。其余各组与CK组相比无显著差异。
不同AM真菌处理组真菌的数量在2.000×103~16.000×103CFU·g-1之间,与CK组相比,Ako、Atr、Rcl、Rco、Pb、Cc、Dh和Sdi组显著性增加了根际土壤真菌数量,分别增加了8.00、6.67、6.50、6.50、6.33、6.33、5.67和5.33倍。其余各组与CK组相比无显著差异。
接种不同AM真菌处理组放线菌的数量在1.667×103~14.000×103CFU·g-1之间,Rfu处理组的放线菌数量显著高于CK组,增加了4.20倍。其余处理组与CK组相比无显著差异。
Ec、Rfu和Svi处理组细菌/真菌显著高于CK组,分别增加了4.40、1.30、1.27倍;Ec、Gr、Sdi、Gm和Svi处理组的细菌/放线菌显著高于CK组,分别增加了3.15、2.77、1.96、1.72、1.24倍;Rfu、Ec、De、Svi和Gd处理组的真菌/放线菌与CK组无显著性差异,其余处理组均显著高于CK组,其中Cc处理组真菌/放线菌值最大,增加了12.67倍。以上结果说明,施加AM真菌可增加宿主植物根际土壤中可培养微生物(细菌、真菌、放线菌)的数量,且不同菌剂对不同微生物数量的影响存在一定差异,可能是由于菌根真菌浸染滇重楼幼苗所形成的丛枝菌根共生体可以分泌促进根际土壤微生物的生长与繁殖物质。

图1 不同处理滇重楼幼苗丛枝菌根真菌侵染的影响Fig.1 The mycorrhizal infection rate of Paris polyphylla var. yunnanensis seedlings inoculated by the different AM fungi treatment groups

表2 不同处理对滇重楼幼苗根际土壤微生物数量的影响
注:表中同列数据不同小写字母表示(P<0.05)水平差异具有统计学意义,下同。
Note: The small letters meant the different columns had statistical significance (P<0.05), and the same as below.
2.3 不同处理对滇重楼幼苗根际土壤微生物多样性分析
通常一个群落里物种类型数越多,各类型间分布比例越均匀,说明该群落生物多样性指数越高[22]。从图2可以看出,接种Pb和Ale菌剂可显著提高滇重楼幼苗根际土壤微生物多样性指数,其余菌剂接种后虽与空白相比无显著性差异,但其中绝大多数都能够提高土壤的微生物多样性指数,该结果与课题前期研究欧洪等人[13]的试验结果相符。说明AM菌剂是有助于促进滇重楼幼苗根际生态系统稳定性的。
2.4 不同处理对滇重楼幼苗根际土壤微生物生物量碳的影响
土壤微生物生物量碳直接或间接地反映土壤肥力的变化以及土壤的同化和矿化能力,其可反映土壤中微生物在的实际含量和作用潜力[23]。由图3实验结果可见,接种AM菌剂有利于提高滇重楼幼苗根际土壤微生物生物量碳,在整个生长周期内,Gg、Rco、Rcl、Asp、Ec、Pb和Ale处理组显著高于CK组。
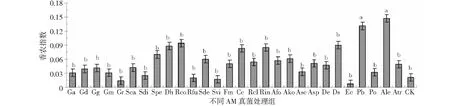
图2 接种不同AM真菌处理对滇重楼幼苗根际土壤微生物多样性指数的影响Fig.2 The soil microbial diversity index of Paris polyphylla var. yunnanensis seedlings inoculated by the different AM fungi treatment groups

图3 接种不同AM真菌处理对滇重楼幼苗根际土壤微生物生物量碳的影响Fig.3 The rhizosphere soil microbial biomass carbon of Paris polyphylla var. yunnanensis seedlings inoculated by the different AM fungi treatment groups
2.5 不同处理对滇重楼幼苗根际土壤酶活性的影响
土壤酶是土壤生态系统中活跃的生物活性物质,在土壤生态系统的物质循环和能量转化中起着重要作用,土壤酶参与土壤中一切生物化学过程[24-26]。表3的数据表明,接种不同AM真菌对滇重楼幼苗根际土壤脲酶、磷酸酶、蛋白酶、蔗糖酶和过氧化氢酶活性影响存在显著性差异,其中土壤脲酶和蛋白酶直接参与土壤含N有机化合物的转化,其活性强度常表征土壤氮素供应强度[9],与CK组相比,Dh和Sde处理组蛋白酶活性显著高于CK组,Asc和Gr处理组脲酶显著高于CK组;磷酸酶其活性反映土壤可供有效P潜在能力[26],从表中数据综合来看,大部分处理组均可以显著提高土壤磷酸酶活性;过氧化氢酶可催化分解土壤中累积的过氧化氢,从而减轻过氧化氢对植物毒害作用[26],蔗糖酶促进糖类的水解,加速土壤碳素循环,是土壤中碳循环转化的关键酶[9]。与CK组相比,5种酶活性的相对增长率由大到小的顺序为磷酸酶>蔗糖酶>过氧化氢酶>蛋白酶、脲酶,可见接种AM真菌可显著增强滇重楼幼苗根际土壤中磷酸酶和蔗糖酶的活性,这与课题前期研究欧洪[13]等人的试验结果相符。
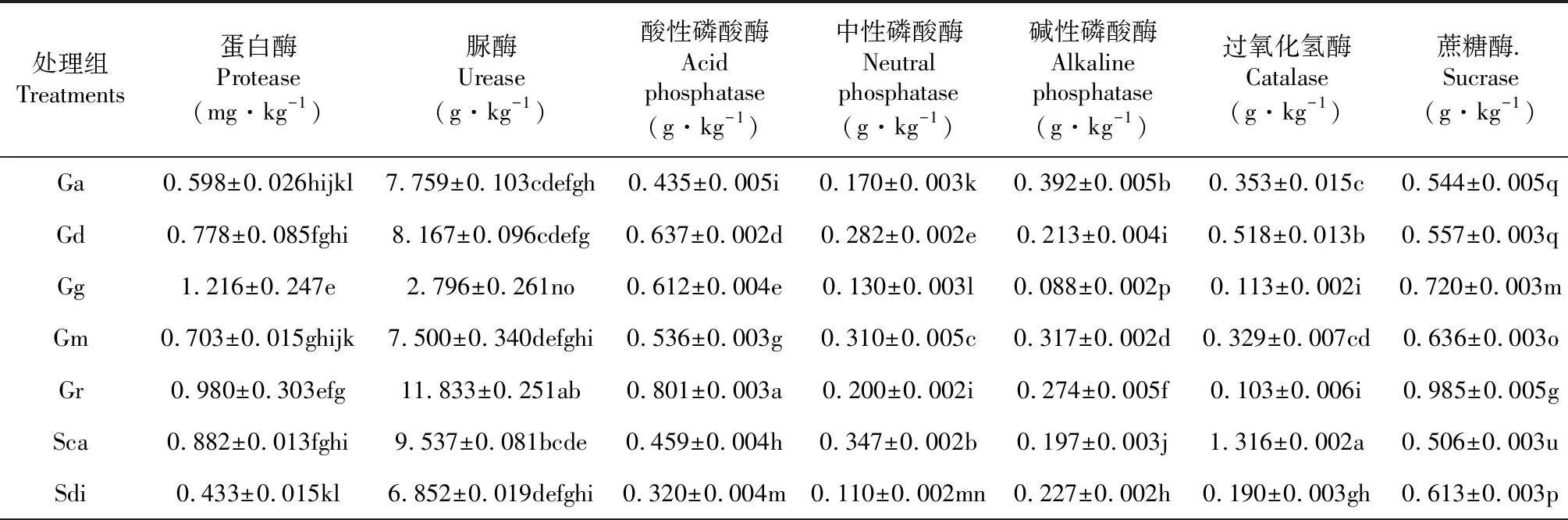
表3 接种不同AM真菌处理对滇重楼幼苗根际土壤酶活性的影响
续表3 Continued table 3

处理组Treatments蛋白酶Protease(mg·kg-1)脲酶Urease(g·kg-1)酸性磷酸酶Acid phosphatase(g·kg-1)中性磷酸酶Neutral phosphatase(g·kg-1)碱性磷酸酶Alkaline phosphatase(g·kg-1)过氧化氢酶Catalase(g·kg-1)蔗糖酶.Sucrase(g·kg-1)Spe0.478±0.020kl3.556±0.116mno0.435±0.008i0.182±0.004j0.131±0.005n0.161±0.002h0.939±0.003hDh2.463±0.013a7.139±0.023ghijkl0.575±0.004f0.215±0.005h0.378±0.008c0.308±0.006de0.682±0.003nRco0.867±0.026fgh9.722±0.032bcde0.179±0.004q0.061±0.002v0.102±0.002o0.100±0.006i1.165±0.004dRfu0.343±0.033l6.722±0.197efghi0.232±0.004p0.244±0.004fg0.119±0.002n0.202±0.015g0.689±0.009nSde1.946±0.034b3.722±0.353lmno0.541±0.003g0.250±0.003f0.198±0.005j0.275±0.011ef0.544±0.007qSvi0.396±0.023l2.278±0.147no0.430±0.005i0.134±0.003l0.524±0.005a0.307±0.006de0.842±0.005iFm0.470±0.020kl6.296±0.321fghijk0.237±0.003p0.094±0.003p0.302±0.002e0.112±0.003i1.015±0.003fCc0.358±0.015l2.963±0.019no0.756±0.008b0.210±0.002h0.523±0.007a0.272±0.008ef1.303±0.009cRcl0.905±0.033fg4.426±0.182hijklm0.283±0.006o0.102±0.002nop0.183±0.003k0.188±0.008gh0.751±0.003lRin0.815±0.020fghi6.241±0.019ghijkl0.575±0.003f0.253±0.003f0.316±0.002d0.514±0.002b0.735±0.007lmAfo0.096±0.008m6.389±0.390fghijk0.186±0.004q0.085±0.002q0.100±0.005o0.293±0.002def0.692±0.016nAko0.366±0.008l1.352±0.291o0.301±0.009n0.106±0.002no0.152±0.002m0.090±0.008i0.807±0.020jkAsc0.403±0.015l13.019±0.409a0.355±0.011l0.099±0.002op0.079±0.003p0.189±0.004gh1.331±0.005bAsp1.437±0.042d10.537±0.406bc0.372±0.002k0.119±0.002m0.218±0.002hi0.309±0.006de0.616±0.004pDe1.002±0.013ef4.074±0.067klmno0.346±0.003l0.291±0.003d0.241±0.007g0.298±0.019def0.542±0.003qDs0.575±0.026ijkl6.556±0.580efghi0.588±0.003f0.238±0.005g0.305±0.003de0.289±0.008ef0.692±0.005nEc0.358±0.008l7.482±0.792defghi0.295±0.009no0.561±0.006a0.128±0.002n0.299±0.005def0.817±0.007jPb0.695±0.033ghijk6.500±0.500efghij0.421±0.006i0.052±0.002w0.076±0.004p0.287±0.009ef1.087±0.005ePo0.455±0.072kl7.296±0.037defghi0.457±0.005h0.116±0.002m0.268±0.003f0.327±0.004cd0.481±0.003qAle0.500±0.015jkl7.907±0.019cdefg0.685±0.005c0.179±0.003j0.169±0.002l0.304±0.004de0.740±0.005lmAtr0.763±0.020fghij10.333±0.085bcd0.396±0.004j0.137±0.002l0.155±0.002m0.287±0.002ef1.731±0.004aCK1.661±0.033c8.417±0.023cdefg0.230±0.005p0.075±0.002u0.124±0.002n0.266±0.006f0.791±0.004k
3 讨 论
土壤微生物数量和酶活性是影响土壤微生态环境的重要因素[11]。其中土壤微生物是土壤生物活性最敏感的指标之一,它们的种类、数量及其变化反映了土壤肥力以及各种养分的存在状态,直接影响着土壤的供肥状况[26]。近年来一些学者的研究表明接种AM菌剂能使除大田作物而外的药用植物根际土壤中微生物数量增加及土壤酶活性升高,从而促进土壤养分的转化及吸收[2,8,11,13]来表现出利于植物生长的生态效应,是一种值得推广的生物菌肥。本实验从微生态的角度,通过对滇重楼幼苗接种28种AM菌剂,采集样品测定滇重楼幼苗菌根浸染率、土壤微生物数量、生物量碳及土壤酶活性。研究结果表明接种AM 真菌能促进土壤中可培养微生物的数量增加及多样性、生物量碳增加,土壤根际酶活性,尤其是可显著增强滇重楼幼苗根际土壤中磷酸酶、蔗糖酶的活性,该结果与欧洪[13]等人的试验结果相近似。
本研究中,三大菌群的数量以细菌数量在土壤微生物组成中占绝对优势,真菌次之,放线菌居第3。说明接种AM真菌对滇重楼幼苗根际土壤中细菌的数量影响最大,细菌成为优势菌群,提高了人工栽培土壤的肥力,这一变化规律虽没有欧洪[13]等人试验的整体趋势明显,但大体趋势上是一致的。本实验结果还表明与对照组相比,添加AM菌剂能显著提高滇重楼幼苗根际土壤酶活性(磷酸酶、蔗糖酶、过氧化氢酶、蛋白酶、脲酶),尤其可显著增强磷酸酶、蔗糖酶的活性,这与欧洪[13]等人的研究结果一致。
可见,接种不同的AM真菌对滇重楼幼苗根际土壤微环境影响存在差异,该研究也为今后滇重楼人工栽培中更好的筛选和应用AM菌剂提供理论指导。
