水杨酸受体NPR1负调控枝顶孢霉Acremonium sp. D212与宿主植物共生
2019-10-08平翔蕊何云露赵宜婷武丽霞张利娜何霞红杜云龙
韩 丽,周 璇,平翔蕊,何云露,赵宜婷,武丽霞,张利娜,姜 茜,钱 杰,彭 晟,何霞红,杜云龙*
(1.云南农业大学植物保护学院,云南 昆明 650201; 2.云南生物资源保护与利用国家重点实验室,云南农业大学,云南 昆明 650201;3.云南农业大学农业生物多样性与病害控制教育部重点实验室,云南 昆明 650201)
【研究意义】内生真菌对植物生长发育起到重要作用。开展内生真菌与植物共生的研究,对于揭示内生真菌与植物相互作用的机制、促进农业生产具有重要的理论意义及应用价值。【前人研究进展】内生真菌通过和宿主植物共生的方式生活于正常的植物组织中,不引起植物明显的感染症状。目前,从云南三七上已分离到多株内生真菌,一些内生真菌表现出对三七根腐病病原真菌的生长有抑制作用[1-2]。植物激素独脚金内酯[3]和生长素[4]等激素在真菌与植物共生中起到重要的作用。枝顶孢属真菌是一类具有重要经济价值的真菌,目前,已从许多药用植物如黄芩[5]和虫草[6]中分离得到,大多数情况下,它们都表现为优势菌群。枝顶孢霉在患根腐病人参的根际土壤中已成为常见真菌[7-8]。枝顶孢霉具有许多重要的功能,其次生代谢产物具有抗微生物活性[9]。枝顶孢霉的激发子AsES在触发拟南芥防御反应时与水杨酸、茉莉酸及乙烯途径有关[10]。水杨酸作为一类重要的植物激素,它可通过抑制生长素的运输而调节水稻根系的发育[11]。【本研究切入点】植物激素水杨酸在调控枝顶孢霉与植物共生中的作用机制还很不清楚。 【拟解决的关键问题】揭示水杨酸受体与枝顶孢霉相互作用调控植物发育的机制。
1 材料与方法
1.1 植物材料与菌株
水稻水杨酸受体突变体OsNPR1-RNAi及野生型TP309由中科院植物生理生态研究所何祖华研究员提供,枝顶孢霉菌株(Acremoniumsp. D212,简称D212)为实验室分离保存。
1.2 实验方法
1.2.1 D212接种三七 在超净工作台内,用接种针挑取D212菌丝,接种到距离三七组培苗根部2~3 mm处,28 ℃共同培养14 d。
1.2.2 三七转录组分析 D212接种三七组培苗14 d后,提取总RNA,用HiSeq对样品进行高通量测序,进行序列组装,获得Unigene库,分析Unigene的表达量和功能富集。由北京百迈客公司进行转录组测序及分析。
1.2.3 实时荧光定量PCR分析三七基因表达量 使用EasyPurePlant RNA Kit(ER301, Transgen)试剂盒提取三七总RNA,One-Step gDNA Removel for qPCR(AT341,Transgen)试剂盒逆转录合成cDNA。实时荧光定量PCR (Real-time PCR)反应体系包括5 μl含有Power UpTMSYBRTMGreen 染料的反应混合物(Thermo Fisher Scientific, China),0.42 ng cDNA,0.4 μl基因特异引物,灭菌 ddH2O补足10 μl体系。PCR反应程序为:95 ℃预变性30 s;40个循环的95 ℃变性45 s,52 ℃退火30 s,72 ℃延伸1 min。18SrRNA(GenBank: D85171)和actin7(AK060893)作为内参基因, 2-ΔΔCt计算表达量。基因特异性引物(表1)用于扩增18SrRNA和OsActin7、PnNPR1、PnPR2、PnPR10、PnDAD2d、PnD14c、PnD27基因,并用SPSS 19.0 软件(IBM, Inc., Armonk, NY, USA)分析表达差异,P<0.05 表示差异显著,P<0.01 表示差异极显著。
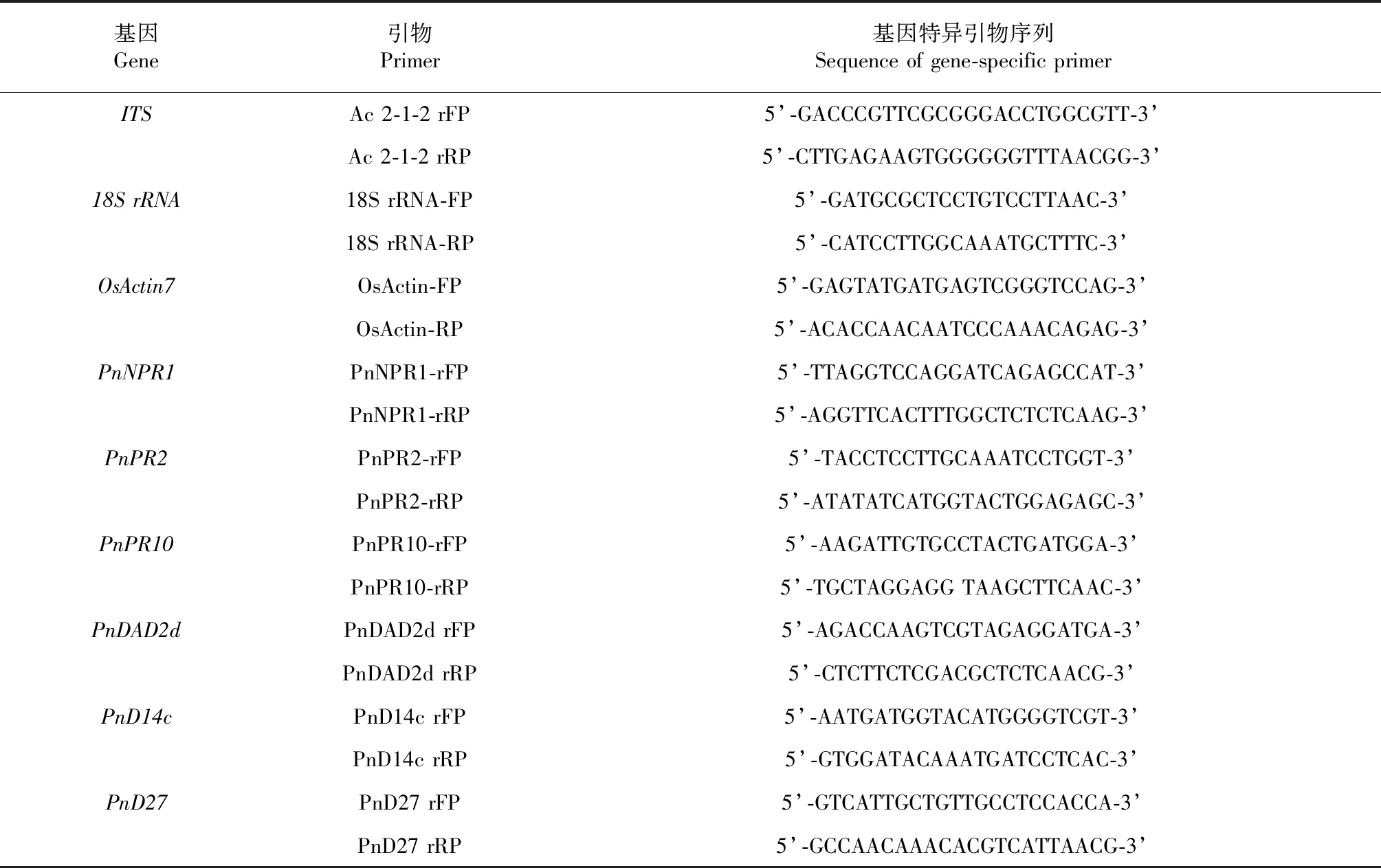
表1 基因特异引物序列
1.2.4 D212在水稻根中的定殖 水稻种子灭菌后,在MS培养基中培养5 d,挑取D212菌丝接种在水稻根周围,28 ℃共培养7 d后,用与抗体Alexa FluorTM488结合的小麦胚芽凝集素(Wheat Germ Agglutinin,Alexa FluorTM488 Conjugate,简称WGA,W11261, Invitrogen,USA)进行免疫反应[12],用Leica SP 5激光共聚焦显微镜观察真菌在根中的定殖。CTAB法提取水稻根的DNA,real-time PCR检测D212在水稻根中的定殖量,用Ac 2-1-2 rFP与Ac 2-1-2 rRP引物(表1)扩增D212核糖体DNA的部分Internal transcribed spacer(ITS)片段。
1.2.5 水稻根尖免疫组化 D212接种于水稻根并共同培养7 d后,取0.5 cm 的水稻胚根根尖进行免疫组化实验[13]。其中,一抗为抗兔的OsPIN1多克隆抗体(Anti-rabbit OsPIN1 polyclonal antibody)及抗兔的OsPIN2多克隆抗体(Anti-rabbit OsPIN2 polyclonal antibody),1∶200倍稀释,二抗为与抗体Alexa fluor 488偶联的驴抗兔IgG (H+L)抗体(Donkey Anti-rabbit IgG (H+L)-Alexafluor 488 coupled antibody, 713-545-003, Jackson ImmunoResearch),1∶500倍稀释。使用ImageJ 1.41软件测量OsPIN1及OsPIN2蛋白的荧光强度。
2 结果与分析
2.1 枝顶孢霉D212与三七共生情况
枝顶孢霉D212是从三七中分离出来的内生真菌。为了研究D212在植物发育中的作用,将D212接种三七组培苗,共培养14 d后,与未接菌的三七相比(图1A),接种D212的三七能正常的生长(图1B),D212没有对三七产生明显的病害作用。
2.2 三七中差异表达基因的富集分析
为了进一步分析D212与三七共生时的基因表达量,D212接种三七14 d后,对三七组培苗开展转录组分析。对差异表达基因进行GO(Gene Ontology)富集分析发现,D212与三七共生时,共有61 005条基因得到归类注释,涉及生物学过程(Biological processes, BP)、细胞组分(Cellular components, CC)及分子功能(Molecular functions, MF)3大类共54个小类(图2)。在BP分类中,单有机体过程类别(Single-organism process)所占比例最多,其次为发育过程类别(Developmental process)及生殖过程(Reproductive process)。在CC分类中,细胞器类别(Organelle)所占比例最多,其次为膜类别(Membrane)及细胞连接类别(Cell junction)。在MF分类中,核酸结合转录因子活性类别(Nucleic acid binding transcription factor activity)所占比例最多,其次为分子转导活性类别(Molecular transducer activity)(表2)。
2.3 枝顶孢霉D212降低了三七中独脚金内酯相关基因的表达
在D212与三七共生中,转录组分析显示与发育过程相关基因的表达受到显著影响。植物激素参与调节植物发育,独脚金内酯在植物与真菌的共生中起到重要作用[3]。在D212与三七组培苗共培养14 d后,通过real-time PCR检测三七组培苗中独脚金内酯相关基因的表达量,发现三七中与独脚金内酯合成(PnD27)及信号途径相关的基因(PnDAD2d,PnD14c)的表达量都显著降低(图3)。这暗示独脚金内酯在D212与三七共生中未起到显著作用。

A: 未接种D212;B: 接种D212A: Uninoculated with Acremonium sp. D212; B: Inoculated with Acremonium sp. D212图1 三七苗表型Fig.1 Phenotype of P. notoginseng seedling

图2 三七转录组GO 分类注释Fig.2 GO classification annotation in transcriptome data of P. notoginseng
2.4 三七中防御相关基因的表达
因为D212没有引起三七明显的病症(图1)。进一步研究三七中相关防御基因的表达水平。D212与三七共生后,转录组数据显示,编码病程相关蛋白的基因大量表达,其次为水杨酸相关蛋白、脱落酸及乙烯相关蛋白(图4)。对表达病程相关蛋白中的10个unigene分析发现,这10个unigene的表达水平没有明显上调(图5),对PnPR2及PnPR10进行real-time PCR检测发现,PnPR10基因的表达明显下调,PnPR2基因的表达没发生明显变化(图6)。但是,编码水杨酸受体PnNPR1的表达水平明显升高(图6)。这显示D212在与三七共生时可激活水杨酸信号通路相关基因的表达,但并未引起宿主的防御反应。
2.5 枝顶孢霉D212与水稻共生情况
为了进一步揭示D212与宿主植物的共生机制,将D212接种于水杨酸受体突变体OsNPR1-RNAi及其野生型TP309的水稻根。用WGA对D212进行免疫染色观察,发现D212可以定殖于水稻根表皮(图7B、图7D)。Real-time PCR扩增水稻根中D212的部分ITS序列,发现在突变体OsNPR1-RNAi水稻中,D212的定殖量显著高于野生型TP309(图8)。当D212与水稻组培苗共培养7 d后,与野生型TP309相比,D212的处理使突变体OsNPRI-RNAi的根显著变长(图9~10)。上述结果显示,水杨酸受体NPR1负调控枝顶孢霉D212与宿主植物的共生。

表2 GO功能注释分析差异表达基因

** 表示P<0.01。PN:未接种D212的三七;PNF: 接种D212的三七,下同**meant P<0.01. PN: P. notoginseng uninoculated with Acremonium sp. D212; PNF: P. notoginseng inoculated with Acremonium sp. D212. The same as below图3 三七中独脚金内酯相关基因表达量Fig.3 The expression levels of strigolactone-related genes in P. notoginseng
2.6 枝顶孢霉D212降低水稻根中生长素输出蛋白的膜定位
为了检测D212调控水稻根系发育是否与生长素的极性运输受到影响有关,进一步检测了突变体OsNPR1-RNAi及野生型TP309根尖中生长素输出蛋白OsPIN1与OsPIN2的细胞定位。结果显示,在野生型TP309中,生长素输出蛋白OsPIN1及OsPIN2的细胞定位没有发生改变,但在OsNPR1-RNAi突变体中细胞定位显著减弱(图11~12)。这显示D212通过改变生长素输出蛋白OsPIN1及OsPIN2的细胞定位而调节生长素的极性运输,从而调控水稻的根系发育。

图5 三七中PnPR2与PnPR10基因热图Fig.5 Heat map of PnPR2 and PnPR10 genes in P. notoginseng
3 讨 论
植物激素参与调控内生真菌与植物的共生。研究发现枝顶孢霉D212与三七共生时,没有引起三七的防御反应。但D212可以在水稻的水杨酸信号突变体OsNPR1-RNAi中大量定殖并促进水稻根系生长。显示了水杨酸在枝顶孢霉D212与宿主植物共生中的重要作用。
在已知的植物激素中,独脚金内酯在丛枝菌根共生中可作为根际土壤信号[14],植物的独脚金内酯受体对于丛枝菌根的发育是必需的[3]。但是,在D212与三七共生时,三七中独脚金内酯的信号及合成相关基因的表达水平都降低,显示三七并没有分泌更多的独脚金内酯来促进三七与D212的共生,或独脚金内酯并不是三七与D212共生中的关键激素。

图4 三七中病程防御相关基因的比例Fig.4 Percentage of pathogenesis-related genes in P. notoginseng
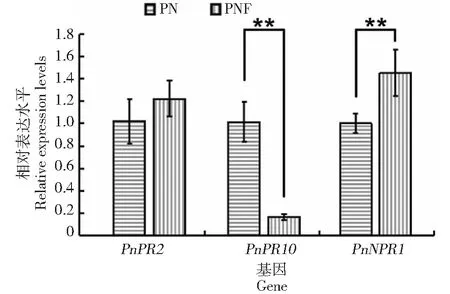
图6 三七中PnPR2、PnPR10及PnNPR1基因的表达量Fig.6 The relative expression levels of PnPR2, PnPR10 and PnNPR1 in P. notoginseng
内生真菌在植物中的定殖产生了屏障效应,从而使内生真菌在植物防御机制中起到重要作用[15]。已有研究发现,内生真菌印度梨形孢在明显减轻真菌大丽轮枝菌引起的拟南芥病害时,并没有激活宿主防御基因的表达[12]。目前,已从枝顶孢霉中发现与植物防御反应有关的基因[16]。植物激素在内生真菌与植物共生时发挥重要作用[17]。D212与三七的共生激活了水杨酸信号途径中NPR1基因的表达,但是,我们并没有看到病程防御基因上调表达(图5~6),而D212也没有引起三七明显的病害反应(图1B)。在D212与水稻共生时,当水杨酸受体NPR1基因发生突变促进了D212与水稻的共生,显示水杨酸信号途径引起的防御反应受到抑制有利于D212与植物的共生,显示其共生途径与植物的抗病防御反应是2条不同的途径。D212与水杨酸信号突变体OsNPR1-RNAi水稻共生,水稻中生长素输出蛋白OsPIN1及OsPIN2的细胞定位显著减弱(图11~12)。生长素输出蛋白调节了生长素的极性分布[18-19]。显示D212与植物共生改变生长素运输促进了植物的发育。

* 表示P<0.05* meant P<0.05图8 D212在水稻根中的ITS基因表达Fig.8 The expression level of ITS gene of Acremonium sp. D212 in rice root

A: 水稻TP309;B: 水稻TP309接种D212;C:水稻OsNPR1-RNAi;D:水稻OsNPR1-RNAi接种D212;箭头所示为D212菌丝;标尺: 10 μmA: Rice TP309;B: Rice TP309 inoculated with Acremonium sp. D212;C: Rice OsNPR1-RNAi; D: Rice OsNPR1-RNAi inoculated with Acremonium sp. D212;The arrow shows hyphae of Acremonium sp. D212; bar: 10 μm图7 枝顶孢霉D212在水稻根中的定殖Fig.7 The colonization of Acremonium sp. D212 in rice root

A:水稻TP309;B:水稻TP309接种D212;C:水稻OsNPR1-RNAi;D:水稻OsNPR1-RNAi接种D212;标尺: 1 cmA:Rice TP309;B: Rice TP309 inoculated with Acremonium sp. D212;C: Rice OsNPR1-RNAi;D: Rice OsNPR1-RNAi inoculated with Acremonium sp. D212;bar: 1 cm图9 水稻根表型Fig.9 Rice root phenotype

CK:未接种D212的水稻;D212:接种D212的水稻;下同CK: Rice uninoculated with Acremonium sp. D212; D212: Rice inoculated with Acremonium sp. D212; The same was below图10 水稻根长Fig.10 The root length of rice
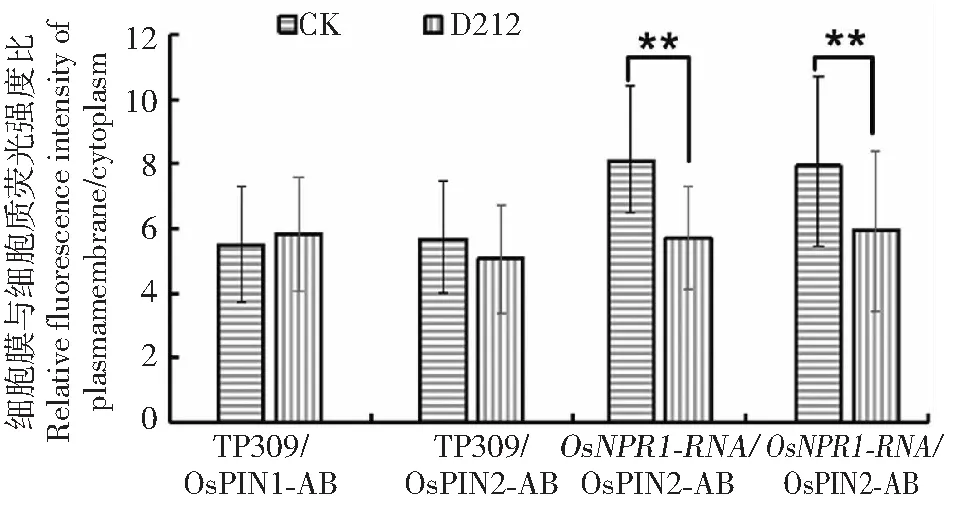
图11 水稻根表皮细胞中OsPIN1与OsPIN2的荧光强度Fig.11 The fluorescence intensity of OsPIN1 and OsPIN2 in rice root epidermal cells

A:水稻TP309中OsPIN1的细胞定位;B:水稻TP309接种D212后OsPIN1的细胞定位;C:水稻OsNPR1-RNAi中OsPIN1的细胞定位;D:水稻OsNPR1-RNAi接种D212后OsPIN1的细胞定位; E:水稻TP309中OsPIN2的细胞定位;F:水稻TP309接种D212后OsPIN2的细胞定位;G:水稻OsNPR1-RNAi中OsPIN2的细胞定位;H:水稻OsNPR1-RNAi接种D212后OsPIN2的细胞定位;OsPIN1-AB:抗OsPIN1蛋白抗体;OsPIN2-AB:抗OsPIN2蛋白抗体;标尺:10 μm图12 水稻根表皮细胞中OsPIN1与OsPIN2的细胞定位 Fig.12 The cellular localization of OsPIN1 and OsPIN2 in rice root epidermal cells
4 结 论
研究结果显示,枝顶孢霉D212与宿主植物的共生需要抑制水杨酸受体NPR1介导的防御反应,并通过改变生长素的运输调节根系的生长。
