基于PAC修饰的氧化石墨烯负载纳米Pt构建新型三维过氧化氢电化学传感器
2019-09-27王应霞彭全材俞立东宋金明
王应霞,于 颖,李 军,彭全材,俞立东,宋金明
(1.中科院海洋研究所 所级公共技术服务中心,山东 青岛 266071;2.青岛大学 材料科学与工程学院,山东 青岛 266071)
活性氧作为一种生物体的自由基,是重要的细胞信号分子,其控制DNA遗传、蛋白质合成、细胞生长等[1-4]。但细胞产生的过量活性氧会产生较大的副作用,如导致心脏病、阿尔茨海默病、帕金森病、自身免疫病和癌症等[5-6];而低浓度的活性氧可产生生长因子、细胞激素和信号转换的二级信息[4]。因此,测定细胞中的活性氧可以反映活性氧的生物效应。H2O2是活性氧的代表物之一,其性质较稳定,能从细胞中渗透出来。因而,测定细胞中的H2O2及其在活细胞中的动力学释放过程对于研究细胞环境非常必要。目前常用于测定H2O2的分析方法有荧光法[7-8]、化学发光法[9-10]、电化学法[11-14]等。其中,电化学方法因直接、快速、在线、选择性好和灵敏度高而常被用作首选方法。在过去几十年中,逐渐发展了一种无酶电化学传感器[15-17]。
氧化石墨烯(GO)是指碳原子密集堆积的单层二维晶格,由于其具有较高的电导、较大的比表面积、较好的生物相容性和大量的官能团而被用于电化学生物传感器中[18-20]。功能化的GO集合了修饰剂和GO的共同特点,引起了较大的关注[21-22]。在功能化的GO中,GO和修饰剂的协同作用可加强催化活性及复合物的稳定性[23]。

1 实验部分
1.1 试剂与仪器
氧化石墨烯(GO,南京先丰纳米科技有限公司);聚二烯丙基二甲基氯化铵(PAC,20%水溶液,200 000~350 000单位)购于Acros公司;H2PtCl6·6H2O、抗坏血酸(AA)、尿酸(UA)、葡萄糖(GLU)购于国药集团化学试剂有限公司;乳腺癌细胞MDA-MB-231、子宫癌细胞KLE及人正常成骨细胞Osteoblast(OB)购于中国医学科学院。其他试剂均为分析纯,使用前未进一步纯化。生理PBS缓冲液由一定比例的KH2PO4(1.76 mmol/L)、Na2HPO4(10.14 mmol/L)、NaCl(136.75 mmol/L)和KCl(2.28 mmol/L)配制而成。所用的溶液均用18 MΩ·cm的超纯水配制。
JSM-7500F扫描电镜(FE-SEM,日本电子株式会社),JEM-2100透射电镜(TEM,日本电子株式会社);DXR拉曼光谱仪(美国赛默飞世尔科技有限公司)。X-射线光电子能谱(XPS)测试在布鲁克Kratos Axis Ultra DLD 型能谱仪上进行,以Al Kα1(1 486.6 eV)作为X射线辐射源,真空度优于10-7Pa,以表面污染碳C1s结合能为内标校正其他元素的结合能。
电化学测定在CHI750电化学工作站(上海辰华仪器有限公司)进行,三电极系统包括:修饰的玻碳电极作工作电极,Ag/AgCl作参比电极,Pt片作对电极。所有电化学实验均在0.02 mol/L的PBS(pH 7.4)溶液中进行,实验过程中缓慢搅拌溶液。为了避免O2的干扰,电解质溶液采用高纯氮(99.999%)吹扫20 min,电化学实验均在N2气氛下进行。
1.2 传感器的构建
1.2.1 PAC-GO的制备称取干燥的GO 40 mg 分散于50 mL 水中,超声 1 h,加入0.1 g PAC,再超声1.5 h,将产物离心分离,用水洗涤3次,除去多余的PAC,在真空干燥箱中60 ℃干燥24 h。取2 mg干燥后的 PAC功能化的GO,超声溶解在2 mL水中,超声2 h后制备成2 mg/mL的储备液,置于冰箱中保存。
1.2.2 修饰电极的制备取5 μL制备的PAC-GO分散液(2 mg/mL)滴涂在GCE表面,室温下干燥3 h。采用恒电势沉积的方法制备修饰电极,即将PAC-GO/GCE修饰电极插入含有2 mmol/L H2PtCl6的HCl(20 mmol/L)溶液中,在恒定的外加电势(-0.3 V)下沉积60 s,取出电极用水冲洗,室温下自然晾干后即得Pt/PAC-GO/GCE电极。实验中所有溶液在使用前均至少通入30 min N2,以除去溶液中的O2,减少对H2O2测定的干扰。
1.2.3 实验方法循环伏安(CV)法:将修饰电极表面冲洗干净后置于电解质溶液中,记录相应电位范围内的CV图。动力学安培法:修饰电极作为工作电极,控制工作电位为-0.3 V,向持续搅拌的溶液中每间隔一段时间加入一定量的H2O2,记录I-t曲线。
1.3 细胞培养
细胞培养实验所用的细胞为乳腺癌细胞MDA-MB-231,来源于青岛大学医学院,用DMEM培养基培养,其中包含10%热灭活的鱼血清、100 μg/mL青霉素和100 μg/mL链霉素,37 ℃模拟环境,5%的CO2气氛下,每2~3 d观察分离1次。
1.4 细胞中H2O2的测定
将培养基于1 000 rpm下离心5 min,分离得到细胞经生理PBS液(0.02 mol/L,pH 7.4)洗涤3次后,采用不同浓度抗坏血酸加至细胞悬浮液中激发细胞产生H2O2。记录电位-0.3 V,缓冲液为10 mL生理PBS缓冲液,实验在水浴37 ℃下进行。
2 结果与讨论
2.1 PAC-GO复合材料的制备与表征
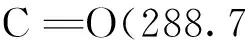

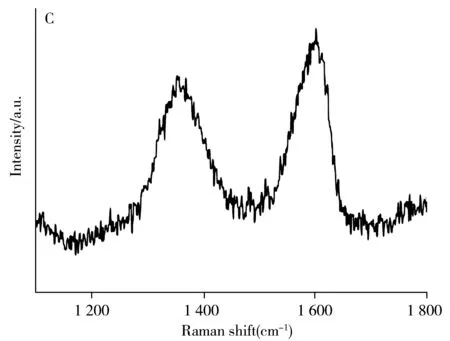

图2 PAC-GO在GCE表面滴涂量的影响Fig.2 Effect of PAC-GO amount deposited on the GCEerror bars:standard error of the mean(n=3 electrodes)
2.2 Pt/PAC-GO/GCE生物传感器制备条件的优化
通过改变GCE表面不同体积的PAC-GO和Pt的电沉积时间,研究了Pt/PAC-GO/GCE生物传感器对H2O2的电流响应。结果显示,PAC-GO的体积对H2O2生物传感器的灵敏度具有很大影响,当2 mg/mL PAC-GO的加入量为5 μL时达到最大值,继续加入PAC-GO,电流下降(图2),可能是因为过多的PAC-GO会导致复合膜层致密,从而阻碍电子的传递。另一个原因是当PAC-GO的量过多时,会使少量PAC-GO从电极表面脱落,电极的稳定性变差,从而导致电流值降低。同时对电极上纳米Pt的沉积时间进行优化,结果显示,当电沉积时间为60 s时,H2O2的电流响应最高,继续延长电沉积时间,则电流响应降低。这可能是因为纳米Pt的电沉积较短时,电极覆盖较少,因此催化效果差。但纳米Pt的电沉积时间较长时,容易团聚,导致催化效率降低。因此,5 μL的PAC-GO和60 s电沉积纳米Pt时间选作本实验的最佳制备条件。
2.3 Pt/PAC-GO/GCE生物传感器的表征
用扫描电镜对Pt/PAC-GO/GCE生物传感器形貌进行表征(图3A)。由图可见,一些亮点分布于材料表面上。通过能谱EDS(图3B)可发现,大量纳米Pt分布于PAC-GO上形成Pt/PAC-GO混合纳米复合材料,证明纳米Pt成功制备,其平均尺寸为100 nm。
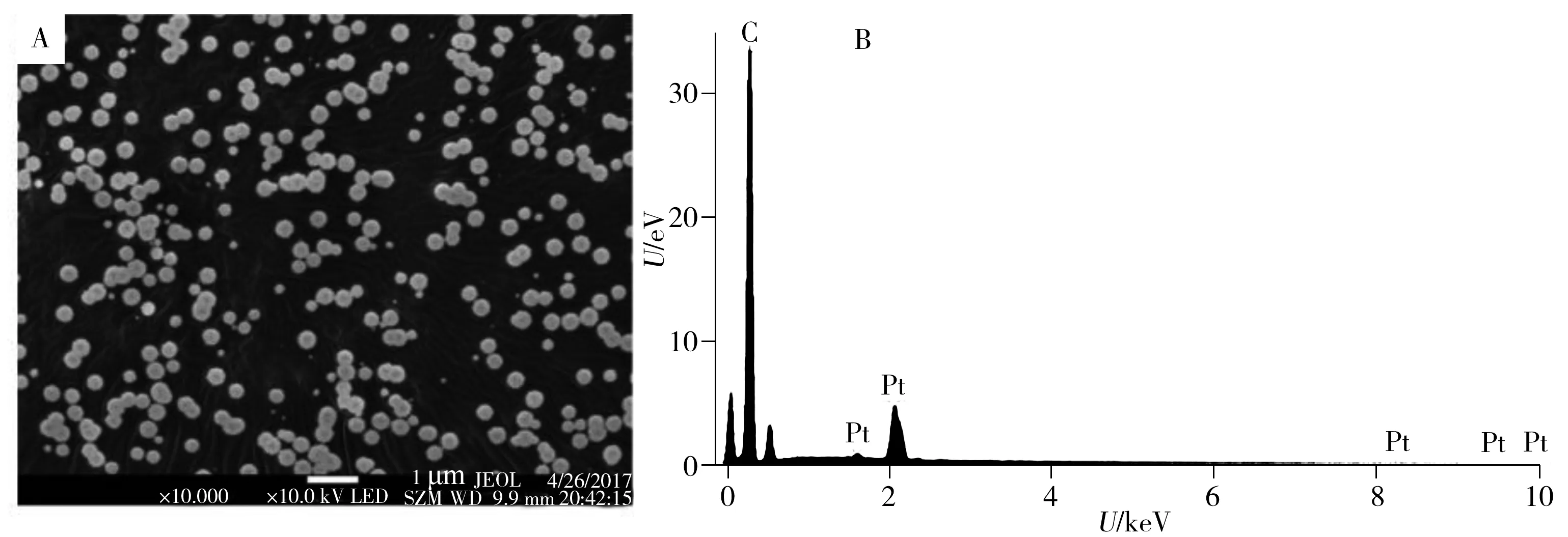
图3 Pt/PAC-GO在GCE表面的扫描电镜图(A)及Pt/PAC-GO的EDS图(B)Fig.3 SEM image(A) of Pt/PAC-GO on GCE and EDS image(B) of Pt/PAC-GO nanocomposites
2.4 Pt/PAC-GO/GCE纳米复合物界面的催化还原H2O2
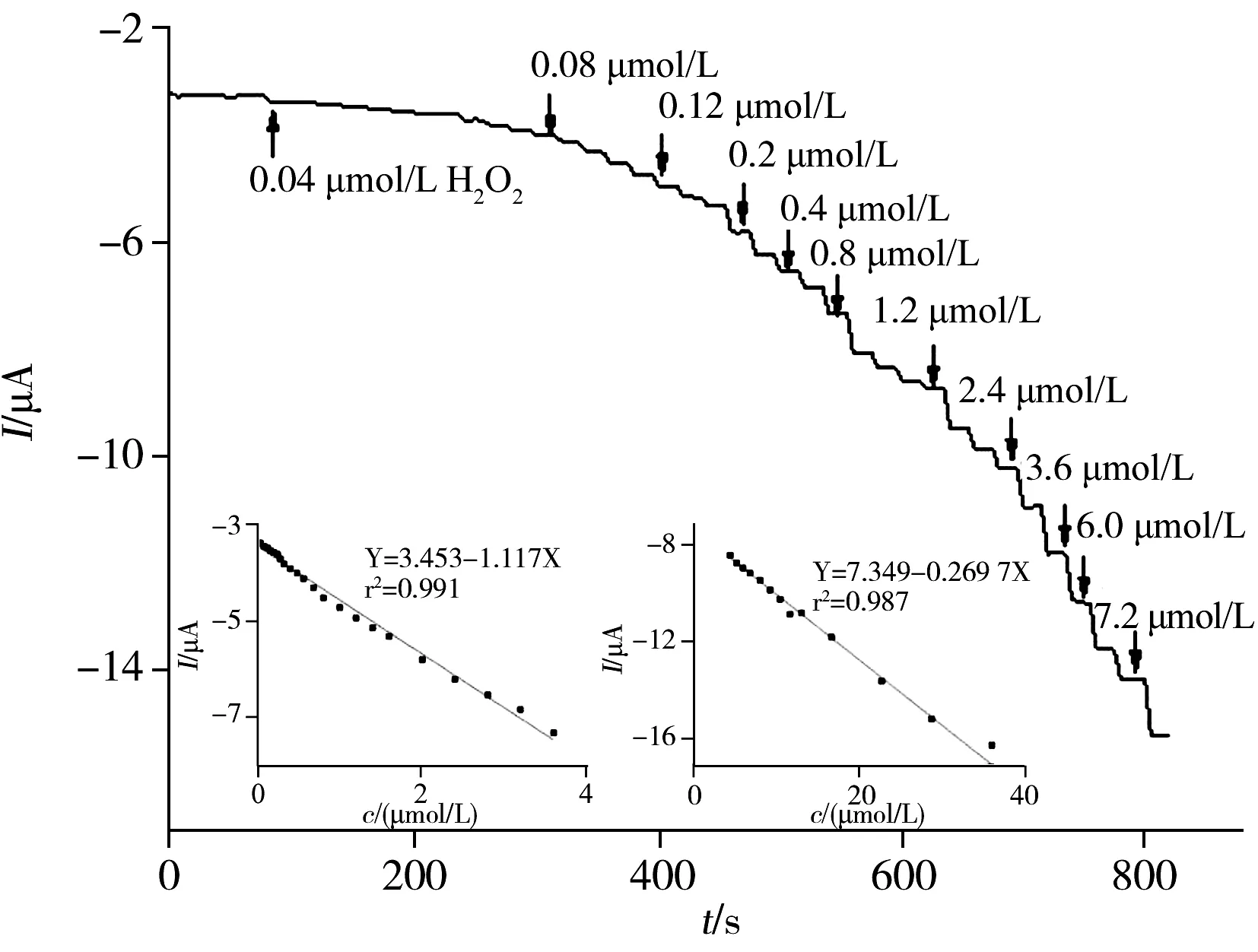
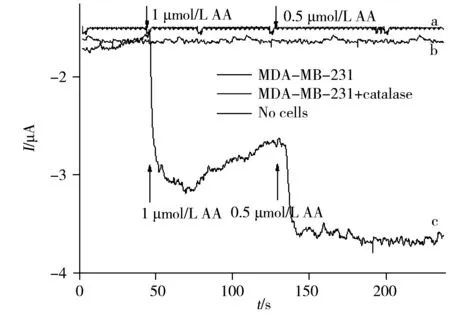
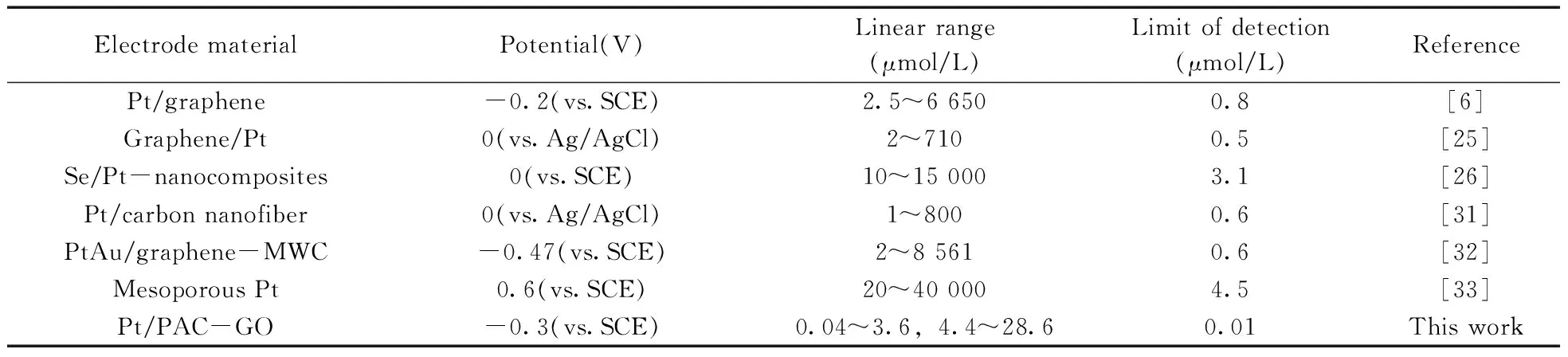
为了研究Pt/PAC-GO/GCE电催化H2O2性能,通过扫描不同电极在5.0×10-3mol/L K3[Fe(CN)6](含0.1 mol/L KCl)溶液中的循环伏安图(图4),根据Randled-Sevcik方程计算修饰电极的表面积[21]:Ip=2.69×105AD1/2n3/2γ1/2C,式中,A为电化学活性比表面积(cm2),D为溶液中[Fe(CN)6]3-的扩散系数(7.6±0.02×10-6cm2/s)[30],n为参与氧化还原过程的电子转移数(对于[Fe(CN)6]3-,n=1),γ为扫描速率(V/s),C为氧化还原探针的浓度(mol/cm3)。得到各电极的表面积大小顺序为:裸GCE(0.070 6 cm2)< Pt/GCE(0.077 7 cm2) 进一步考察了不同电极在5×10-3mol/L K3[Fe(CN)6](含0.1 mol/L KCl)溶液中的库仑曲线,并根据方程:Q=(2nFAD01/2∏-1/2C0)t1/2计算不同电极的表观面积[19]。式中,Q为电量,n为电子转移数,F为法拉第常数,A为电化学活性比表面积,t为时间,D0和C0分别为(Ⅲ)价铁氰化物的扩散系数和总浓度。其中A可以从Q对t1/2曲线的斜率得到(图4插图)。根据斜率大小顺序可得到不同电极的面积大小顺序为:Pt/PAC-GO/GCE>PAC-GO/GCE>Pt/GCE>GCE。Pt/PAC-GO/GCE具有最大的比表面积A,显示了最优的电催化活性。 电化学阻抗(EIS)是表征层层组装传感器的很好方法。图5为不同修饰玻碳电极和裸电极的交流阻抗图。裸电极的交流阻抗图几乎为一条直线,表明电极表面无阻碍K3[Fe(CN)6]探针分子电子转移的物质,探针分子得失电子的过程受扩散控制。将纳米Pt电沉积到玻碳电极,得到一条直线,表明探针分子主要受扩散控制。将PAC-GO和纳米Pt层层组装至电极表面,高频区出现半圆,且半圆逐渐变大,这是由于电极表面组装的PAC-GO膜和纳米Pt阻碍了探针K3[Fe(CN)6]向电极表面的扩散,电化学过程主要受电子转移控制,具有较大的阻抗,表现出更优的催化性能。 图4 不同电极在5.0×10-3 mol/L K3[Fe(CN)6]溶液中的循环伏安曲线Fig.4 CV curves of different electrodes in 5.0×10-3 mol/LK3[Fe(CN)6](1∶1) solutioninsert:chronocoulometric plots of different electrodes 图5 不同电极的交流阻抗图Fig.5 EIS curves of different electrodes 图6 不同电极在H2O2存在下的CV曲线Fig.6 CV curves of different electrodes in the presence of H2O2H2O2 concentrations in 0.02 mmol/L PBS solution(pH 7.4) are 1,5,10 mmol/L,respectively 图6为裸电极、Pt/GCE、PAC-GO/GCE以及Pt/PAC-GO/GCE在0.02 mol/L PBS溶液中存在H2O2时的循环伏安曲线。如图所示,裸电极无电流响应,Pt/GCE和PAC-GO/GCE的电流较低。而Pt/PAC-GO/GCE在-0.3 V附近出现1个还原峰,且随着H2O2浓度的增加,该峰向负方向移动,电流强度快速提高。表明H2O2在Pt/PAC-GO纳米结构上易被还原,Pt/PAC-GO/GCE的电催化活性可能源于其特殊的结构,即高的比表面积及纳米Pt与PAC-GO之间的协同作用,这对测定H2O2的选择性和灵敏度具有重大意义。 在-0.3V下,采用安培法考察了Pt/PAC-GO/GCE修饰电极在PBS缓冲溶液中连续加入不同浓度H2O2得到的安培响应曲线(图7)。结果显示,H2O2的线性范围包含两部分:0.04~3.6 μmol/L(r2=0.991)和4.4~28.6 μmol/L(r2=0.987)。H2O2传感器的检出限(信噪比S/N=3)为0.01 μmol/L。 通过每隔50 s依次加入100 μL 0.1 mmol/L H2O2、1.0 mmol/L UA、0.5 mmol/L AA、1.0 mmol/L GLU,研究生理溶液中可能干扰物对H2O2测定的影响,结果表明,在上述物质的存在下,H2O2的电流响应不受影响,表明方法具有较高选择性。 生物传感器的重复性和稳定性对于H2O2的测定非常重要。采用同一Pt/PAC-GO/GCE电极对1.0×10-6mol/L H2O2溶液平行测定6次,测得相对标准偏差(RSD)小于4.5%,说明该修饰电极具有较好的重复性。同时制备4根修饰电极,对1.0×10-6mol/L H2O2进行检测,其RSD为5.2%,表明此修饰电极具有较好的重现性。将制备好的Pt/PAC-GO/GCE电极保存于室温,2周后H2O2的灵敏度下降至原来的81%,表明电极仍保持稳定。上述实验结果进一步证明Pt/PAC-GO/GCE生物传感器测定H2O2的可靠性。 为了研究Pt/PAC-GO/GCE生物传感器的实用性,采用该传感器对活细胞中H2O2的含量进行检测。采用Pt/PAC-GO/GCE传感器对PBS缓冲液以及细胞中加入过氧化氢酶的PBS缓冲液进行安培响应曲线扫描,均未观察到安培响应(图8曲线a、b);在同样条件下,加入不同浓度AA(不同时间加入不同浓度)对MDA-MB-231乳腺癌细胞进行刺激,并用Pt/PAC-GO/GCE传感器检测其安培响应曲线(图8曲线c),可观察到安培响应出现2次突跃变化,表明该电流响应是由MDA-MB-231细胞在不同浓度AA刺激后特定H2O2分解得到的结果,且H2O2的释放率与AA浓度有关。加入0.5 μmol/L AA后的电流为-3.6 μA,根据标准曲线得到的H2O2浓度为0.13 μmol/L。而细胞溶液为2 mL,则由细胞释放的H2O2含量为0.26 nmol。 图7 Pt/PAC-GO/GCE在PBS缓冲溶液中连续加入H2O2后的安培响应曲线Fig.7 Amperometric response of Pt/PAC-GO/GCE after successive addition of H2O2 in PBSdetection potential:-0.3 V,inset:calibration curves with H2O2 concentrations 图8 加入不同浓度 AA后,MDA-MB-231细胞释放H2O2的时间曲线Fig.8 Time curves of H2O2 release from MDA-MB-231 cells upon addition of AAa.the experiment with cells and catalases(加入过氧化氢酶的实验细胞);b.the experiment without cells(无细胞的实验对照组);c.the experiment of MDA-MB-231 cells(MDA-MB-231 细胞组) 将本方法与已报道的其他H2O2无酶生物传感器检测方法进行比较,结果见表1。从表1可以看出,与未修饰GO的电极相比,本方法具有线性范围宽、检出限低等优点。 表1 不同H2O2生物传感器性能的对比Table 1 Comparison of performance of various H2O2 sensors 本文通过层层组装法制备了Pt/PAC-GO/GCE生物传感器。结果表明,该生物传感器对H2O2有优异的催化性能,检出限为0.01 μmol/L,线性范围为0.04~3.6 μmol/L和4.4~28.6 μmol/L。该传感器具有制作简单、线性范围宽、灵敏度高等优点,且在测定活细胞中释放的H2O2方面表现了较优的性能,能准确、快速检测细胞中释放的H2O2含量。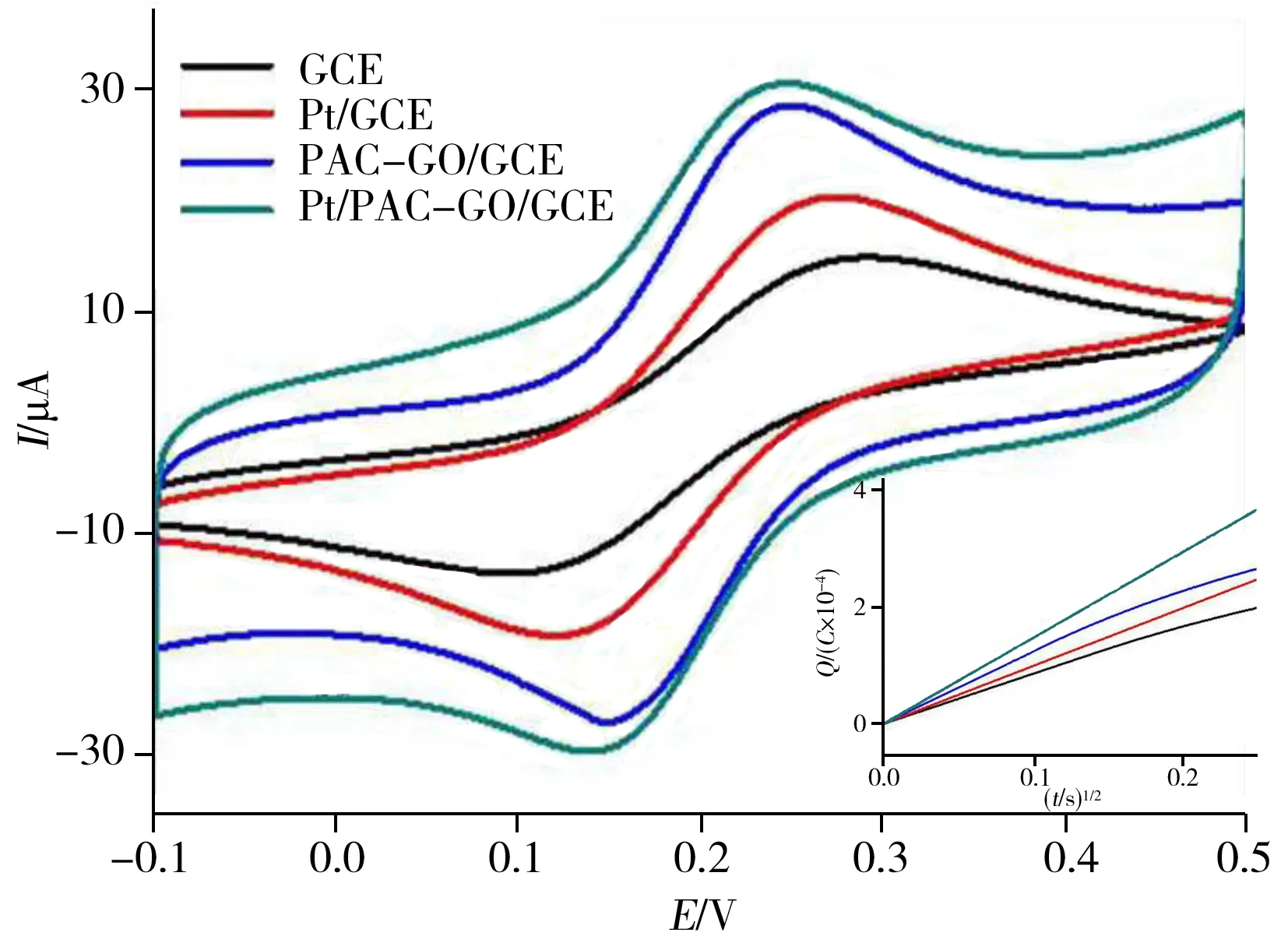


2.5 H2O2的线性范围及检出限
2.6 干扰实验
2.7 重现性与稳定性实验
2.8 活细胞中释放H2O2的测定
2.9 与其他方法的比较
3 结 论