性发育异常39例临床、病理与影像学特点
2019-09-27王斯嘉方兰兰王晓娟孙莹璞
王斯嘉,方兰兰,王晓娟,张 焱,孙莹璞
1)郑州大学第一附属医院生殖与遗传专科医院郑州450052 2)郑州大学第一附属医院病理科郑州450052 3)郑州大学第一附属医院核磁共振科郑州450052
性发育异常(disorder of sex development,DSD)是一组以染色体核型、性腺表型、性腺解剖结构不一致为特征的先天性疾病[1]。DSD的发病率约为1/4 500[2]。根据 2006年欧洲儿科内分泌协会(ESPE)和 Lawson Wilkins儿科内分泌协会(LWPES)提出的新 DSD分类方法[3],按照染色体核型分为46,XY DSD、46,XX DSD和染色体异常DSD三类,每一类根据病因不同又可分为若干小类[4]。本文对39例不同类型DSD的临床表现、影像学和病理结果进行了综合分析,旨在提高对该病的认识,现报道如下。
1 对象与方法
1.1 研究对象 收集2008年9月至2018年12月在郑州大学第一附属医院确诊为DSD的39例患者,年龄4~34岁,均行实验室检查、盆部超声、盆腔MRI及腹部CT检查;其中23例行腹腔镜下探查术,术中切除的性腺组织均送病理学检查确诊;其余16例结合其染色体核型分析、实验室检查和影像学表现明确诊断。
1.2 检查仪器及方法 ①盆部超声:采用Mindray DC-8(凸阵探头,频率 1.5 ~5.5 MHz,经腹探查)、GE Volusion730(腔内探头,频率 7.0 MHz,经直肠或阴道探查)、GE logiq S8(凸阵探头,频率1~5 MHz,经腹探查)超声诊断仪。患者适当充盈膀胱 ,取仰卧位,探查下腹部、腹股沟区、会阴部,寻找有无睾丸、卵巢、子宫、阴道。②盆腔MRI:采用3.0 T超导MR扫描仪(德国Siemens公司Skyra、Trio Tim;美国GE公司Discorvey MR750)及体部相控阵线圈。常规平扫采用TSE序列行横轴位T1WI及压脂T2WI、冠状位压脂T2WI、矢状位T2WI序列扫描。层厚5 mm,层间距1 mm。③腹部CT:检查设备为Discovery CT 750 HD扫描仪。行常规腹部CT平扫及增强扫描,120 kV,500 mA,轴位 5 mm 层厚,层间距 5 mm,512×512矩阵。原始数据行薄层(1 mm)重建后进行冠状面及矢状面图像重建。
2 结果
2.1 临床表现和实验室检查 39例DSD患者中,社会性别男性11例,社会性别女性28例。男性外阴表型9例,女性外阴表型25例,性别模糊不清5例。原发性闭经12例,继发性闭经3例。阴道开口11例,尿道下裂7例,尿生殖窦共同开口2例,小阴茎11例,阴蒂肥大12例。身材矮小7例。高血压和低血钾3例。性激素水平异常30例,促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)刺激实验阳性7例。
根据 ESPE/LWPE的 DSD分类方法,46,XY DSD 16例(其中卵睾型DSD 2例,卵巢型DSD 4例,17α-羟化酶缺乏症3例,雄激素不敏感综合征3例,Leydig细胞发育不全症1例);46,XX DSD 14例(其中卵睾型DSD 3例,21-羟化酶缺乏症4例,医源性DSD1例);染色体异常DSD 9例(其中Turner综合征6例)。
2.2 染色体核型分析及SYR基因检测 9例染色体异常DSD染色体核型分别为:45,X(2例);46,X,del(X)(q23);46,XY/45,X(25:5);46,Xi(X)(q10)[41]/45,X[9];46,XY[14]/45,X[6];45/46/46,X,i(xq),46/qh+;45,X/46,X,i(Xq),(1∶21);46,X,Yqh-。
4例46,XY DSD患者行SYR基因检测,其中1例17α-羟化酶缺乏症及1例不完全型雄激素不敏感综合征患者SYR基因阳性;5例染色体异常DSD患者行SYR基因检测,其中3例阳性。
2.3 手术情况 39例中有23例行腹腔镜下探查术。①16例46,XY DSD患者中,腹腔镜下性腺切除术14例(盆腔6例,腹股沟7例,大阴唇1例),盆腔内左侧睾丸性腺母细胞瘤切除术及右侧卵巢活检术1例,阴囊内性腺活检术1例;共取得性腺29个(卵巢9个,睾丸19个,卵睾1个);同时行阴蒂成形术4例,阴道成形术5例。②14例46,XX DSD患者中行腹腔镜下探查术及活检术6例,其中卵巢剥除术1例,卵睾切除术3例。③9例性染色体异常DSD患者中腹腔镜下盆腔内卵睾切除术1例。
2.4 影像学表现及病理或手术所见
2.4.1 性腺 16例46,XY DSD患者中,术中探查可见性腺29个。①MRI可见性腺19个,超声可见性腺16个,超声结合MRI显示率达72%(21/29);21个可见性腺中卵巢3个,均位于盆腔;隐睾17个,5个位于盆腔,10个位于腹股沟区,2个位于大阴唇;卵睾1个,位于阴囊。位于盆腔的卵巢影像学表现为体积较小的类圆形单囊状或多囊状长T2信号或卵巢样回声(图1A),病理上均为不成熟卵巢样组织(图1B)。位于盆腔的隐睾,影像为体积较小的类圆形均质长T2信号影或低回声(图2A),病理上为发育不成熟的睾丸组织,其中1个发生了性腺母细胞瘤(图2B)。位于腹股沟的隐睾,影像学表现为体积正常或偏小的类圆形均质长T2信号(图3A)或实性低回声(图3B),病理上为成熟的睾丸组织或发育不良的睾丸组织。位于大阴唇的隐睾,影像学表现为体积正常的类圆形均质长T2信号或低回声,病理学为睾丸组织;卵睾影像学表现为“肾形”均质长T2信号,病理学上可见少量卵巢组织和发育不良的睾丸组织。②手术可见而影像学未显示性腺8个,其中条索样原始卵巢6个(镜下见输卵管样及卵巢样结构),均位于盆腔;发育不良的睾丸2个(镜下见发育不成熟的睾丸组织),位于腹股沟近腹壁处。③手术及影像学均未见性腺3个。
14例46,XX DSD中,术中探查可见性腺28个。影像学可见性腺24(85%)个,3个为卵睾,其中2个位于盆腔右侧(图4A),1个在左侧阴囊内;20个盆腔内性腺;1个右侧阴囊内睾丸;4个影像学未见性腺组织。卵睾影像上表现为类圆形影,中心呈均质略长T2信号,边缘呈多个小囊状影,病理上见少量卵巢组织和发育不良的睾丸组织(图4B、C),其中1例伴有前列腺。14个盆腔内性腺大小正常,影像学为体积正常的多个大小不等的囊状影,其中6个病理上可见卵巢组织,1个卵巢组织内可见发育的卵泡;6个盆腔内性腺影像学上体积较小,其中2个病理上为发育不良的卵巢组织。
9例染色体异常DSD,术中探查可见性腺18个。影像学可见6(33%)个盆腔内或腹股沟区性腺,呈体积较小的类圆形长T2信号或内回声不均质,其中1例病理上见卵巢样组织。
2.4.2 子宫与阴道 16例46,XY DSD患者中,幼稚子宫4例,始基子宫5例,未见子宫7例;正常阴道4例,上段阴道狭窄/闭锁6例,未见阴道6例;阴蒂肥大4例,小阴茎2例。14例46,XX DSD患者中,幼稚子宫11例(图5A),正常子宫3例;正常阴道5例,下段阴道闭锁并尿生殖窦共同开口2例,下段阴道闭锁/狭窄5例,无阴道2例。9例染色体异常DSD患者中,始基子宫3例,幼稚子宫4例,无子宫2例;正常阴道3例,阴道狭窄3例,无阴道3例;其中1例无子宫无阴道患者合并小阴茎。
2.4.3 肾上腺 3例17α-羟化酶缺乏症和4例21-羟化酶缺乏症患者CT均可见双侧肾上腺增生(图5B)。
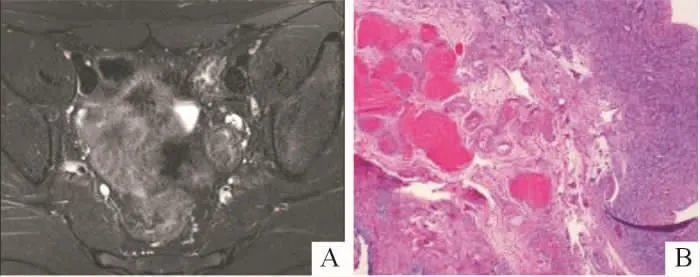
图1 某患者的卵巢影像学表现和病理(HE,中倍)结果
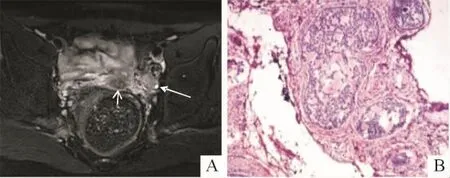
图2 某患者的隐睾(盆腔)影像学表现和病理(HE,中倍)结果
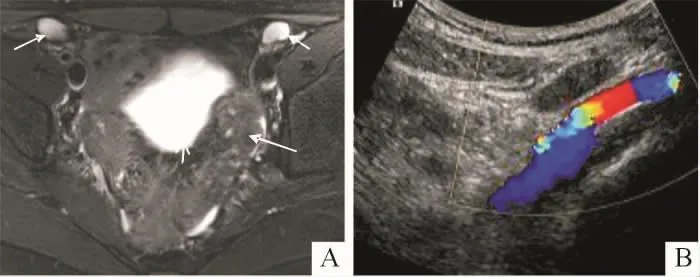
图3 某患者的隐睾(腹股沟)影像学表现
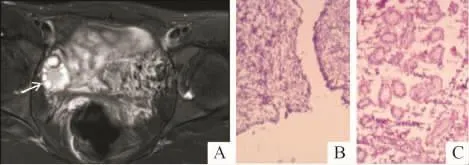
图4 某患者的卵睾影像学表现和病理(HE,中倍)结果
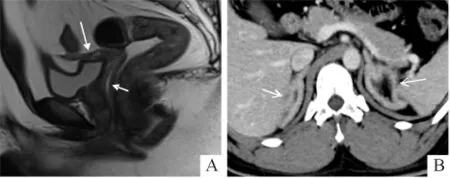
图5 某患者的幼稚子宫(A)、双侧肾上腺增生(B)影像学表现
3 讨论
人类正常性别分化的三个生理过程是性别分化发育形成的基础,包括染色体的确定、性腺及附属性器官分化以及外生殖器分化。正常情况下,性染色体决定胎儿初始性别,随着胎儿的生长发育其初始性腺分泌的激素决定了生殖管道的分化,出生后成长至青春期,性激素的大量分泌会导致第二性征发育以及生殖器官的进一步发育成熟。因此,染色体异常或基因突变、胎儿性分化期体内激素环境异常以及特定靶器官组织激素受体功能异常等均可导致DSD。
DSD患者一般自出生起即存在生殖腺、内生殖道及外生殖道的异常,发生于外生殖道的异常可及早进行诊断,但内生殖道的异常查体不易发现,患者常因青春期第二性征发育异常、异常月经,或成年后不孕不育等原因就诊。实验室检查是临床诊断的重要依据。
性腺是人体重要而特殊的组织,DSD患者往往存在不同程度的性腺发育不全,从性腺不发育、未分化性腺组织、经典条索状性腺的出现,直至完全发育的睾丸或卵巢[5],其影像学表现也各不相同。国内有文献[6]报道了超声在DSD诊断中的应用,而MRI具有多平面成像和软组织分辨力高的特点,与超声联合诊断,可以互为补充[7]。本组中2个腹股沟区性腺和2个盆腔内性腺仅MRI显示,盆腔内另1个性腺仅超声显示,二者结合可提高显示率。对于不同类型DSD,影像学的显示存在差异。46,XX DSD患者的性腺影像学显示较好,达85%。染色体异常DSD患者的性腺多存在性腺发育严重不良或不发育,影像学显示较低,其中Turner综合征患者性腺常为发育不全的条索样性腺,国外文献[8]报道超声对于59%~89%的Turner综合征患者性腺无法显示。本研究6例Turner综合征影像学仅显示2例,与文献报道相符合,进一步表明Turner综合征患者普遍存在卵巢发育不良。本组资料中46,XY DSD患者性腺的影像学显示可达72%(21/29),46,XY DSD卵巢型、卵睾型患者以及17α-羟化酶缺乏症患者的性腺往往发育不良,影像学显示不满意,尤其是卵巢型,均为条索样原始性腺。因此,本研究认为,影像学对DSD患者性腺的检出受性腺类别、发育程度、位置等因素的影响。
卵睾型DSD,既往称真两性畸形,患者体内同时存在睾丸和卵巢两种性腺,是一种特殊类型DSD,发病率约为 1/20 000,占 DSD患 者 的10%[9-10]。根据 Hmimans 法[11]性腺可分为三种类型:①单侧性,一侧为卵睾,另一侧为卵巢或睾丸。②双侧性,两侧均为卵睾。③片侧性,一侧为卵巢,另一侧为睾丸。2007年一项回顾性分析[12]显示,卵睾型DSD患者以46,XX核型最为常见,约占82%;本研究中,46,XY卵睾型患者2例,46,XX卵睾型患者3例。46,XY卵睾型患者性腺多发育欠佳,1例为单侧性,右侧阴囊内卵睾,左侧未见性腺;另1例为片侧性,盆腔左侧睾丸合并性腺母细胞瘤,右侧为发育不良的条索状卵巢组织。46,XX卵睾型DSD患者卵睾及卵巢或睾丸大小、体积均可,3例均为单侧性,其中2例为右侧盆腔内卵睾,左侧卵巢组织,另1例为左侧阴囊内卵睾,右侧阴囊内睾丸。Krob等[13]研究表明,卵睾型DSD患者的单纯卵巢组织多位于机体右侧,而睾丸或含有睾丸的卵睾则多存在于机体左侧.本研究中3个卵睾和1个睾丸位于右侧,1个卵睾及1个睾丸合并性腺母细胞瘤位于左侧,1个卵巢位于右侧,2个卵巢位于左侧,与文献报道不符。此外,影像学较易发现卵睾结构,本组中3例表现为椭圆形,睾丸组织位于中心区域,卵巢组织的多个小囊状影则分布于周边区域,与文献报道的卵巢组织及睾丸组织分别位于两极亦有差别。
影像学诊断严重发育不良的条索样原始性腺常较为困难,手术探查及术后病理结果是确定DSD患者性腺类型的准确方法。46,XY DSD患者多数性腺不仅发育不良且易异位,性腺恶变率较高。据文献[14]报道,腹腔及腹股沟区的隐睾易发生恶变,较正常睾丸组织高出30~50倍,因此多数都选择行腹腔探查术的同时切除性腺。本研究中16例46,XY DSD患者腹腔镜下性腺切除14例。相较于46,XY DSD患者,46,XX DSD患者的性腺肿瘤发病率明显降低,且其性腺多为发育尚可的卵巢组织,因此手术过程中常选择予以保留,本组仅3例卵睾型DSD选择行卵睾切除术。
既往文献[15]报道认为,超声对于DSD患者的性腺、内生殖道显示准确,具有重要的临床价值,是诊断 DSD的关键;国内文献[16]报道超声检查对DSD患者的阴道检出率为33.33%。作者侧重于MRI对于DSD患者的内生殖道显示的研究,发现MRI能够准确显示出各型DSD患者的子宫、阴道及前列腺的有无及畸形的细节。
对于DSD患者,早期的正确诊断及合理的性别选择至关重要,对于性腺发育尚可并排除恶变可能的患者,应尽力保留其生育能力。本研究中,1例13岁46,XX医源性DSD患者,由于母体在早孕期接受了具有雄性激素作用类药物致使女性胎儿外生殖器表现有男性化;MRI显示上段阴道正常,下段阴道狭窄伴尿道阴道共同开口,盆腔内可见发育正常的卵巢及子宫,术后病理可见发育正常的卵泡;行阴道成形术及外阴整形术,患者成年后有机会过正常性生活并自然受孕。
综上所述,临床表现、病理结果和影像学三者结合分析,可以为DSD的诊断提供充分的依据,对选择合适的临床治疗方案及提高患者术后的社会生存质量具有重要意义。
