铁皮石斛多糖对H9c2大鼠心肌细胞缺血再灌注损伤的保护作用
2019-09-27徐姗,胡楠
徐 姗,胡 楠
1)南京医科大学附属常州第二人民医院药学部江苏常州213000 2)常州市第一人民医院药剂科江苏常州213000
心肌缺血再灌注损伤是指冠状动脉阻塞后在一定时间又重新恢复血流时,缺血心肌虽恢复正常灌注,但组织损伤加重的病理过程。心肌缺血再灌注损伤往往造成心肌超微结构破坏、心功能障碍等,甚至可发生严重的心律失常而导致猝死[1]。目前普遍认为心肌缺血再灌注损伤的主要机制是氧化应激和炎症反应[2]。其中,活性氧(reactive oxygen species,ROS)生成过多以及清除不足是发生氧化应激反应的主要因素[3]。NF-κB是一种转录调控因子,通过调控多种细胞因子、趋化因子、生长因子等的表达引起炎症反应。而Toll样受体4(toll-like receptor-4,TLR-4)作用于 NF-κB的上游调控因子,能够激活NF-κB引起一系列炎症反应,导致心肌细胞损伤及凋亡。铁皮石斛多糖具有良好的抗氧化、抗炎、调节免疫等作用[4]。本实验通过构建心肌细胞缺氧/复氧损伤模型模拟在体心肌缺血再灌注损伤,并以不同质量浓度的铁皮石斛多糖干预细胞,观察细胞存活率、凋亡率、NF-κB p65及TLR-4蛋白表达的变化,旨在进一步探究铁皮石斛多糖对心肌缺血再灌注损伤保护作用的机制。
1 材料与方法
1.1 细胞及试剂 H9c2大鼠心肌细胞(中国科学院上海生命科学学院研究所细胞资源中心);DMEM培养基、胎牛血清(美国HyClone公司);胰蛋白酶(杭州四季青生物工程有限公司);铁皮石斛多糖标准品(珍贵濒危药材湖南省工程研究中心,纯度≥98%),用含体积分数10%胎牛血清的DMEM培养基溶解铁皮石斛多糖,制成不同质量浓度的铁皮石斛多糖溶液;MTT试剂(美国Sigma公司);MDA、ROS、LDH检测试剂盒(南京建成生物工程研究所);AnnexinⅤ-FITC/PI凋亡检测试剂盒(大连宝生物工程有限公司);RIPA蛋白裂解液、BCA蛋白浓度检测试剂盒(上海碧云天生物技术有限公司);超敏ECL化学发光试剂盒(苏州新赛美生物科技有限公司);NF-κB p65、TLR-4抗体(美国 Abcam 公司);β-actin抗体、辣根过氧化物酶标记的二抗(北京中杉金桥生物技术有限公司)。
1.2 H9c2细胞培养 将H9c2细胞置于体积分数5%CO2、37℃培养箱中,用含体积分数10%胎牛血清的DMEM培养基培养,根据细胞生长状态,每隔1 d更换1次新鲜的培养基,待细胞生长至80% ~90%融合时,用2.5 g/L的胰蛋白酶进行传代。每3~4 d传代1次,取对数生长期的H9c2细胞进行后续实验。
1.3 H9c2细胞分组和处理 将处于对数生长期的H9c2细胞分为5组:正常对照(Con)组、缺氧/复氧(H/R)组、缺氧/复氧+铁皮石斛多糖低质量浓度(H/R+LDP)组、缺氧/复氧+铁皮石斛多糖中质量浓度(H/R+MDP)组、缺氧/复氧+铁皮石斛多糖高质量浓度(H/R+HDP)组。Con组H9c2细胞用正常培养基(含体积分数10%胎牛血清的DMEM培养基)在体积分数5%CO2、37℃培养箱中培养。H/R组H9c2细胞置无血清、无糖、N2预处理缺氧的DMEM培养基中,在37℃、含体积分数95%N2、5%CO2培养箱中缺氧培养3 h,换成正常培养基,置体积分数5%CO2、37℃培养箱中复氧培养3 h。H/R+LDP组、H/R+MDP组、H/R+HDP组分别用0.1、0.2、0.4 μg/L 铁皮石斛多糖预处理 H9c2 细胞30 min,然后行H/R处理(同H/R组)。
1.4 M TT法检测H9c2细胞存活率 将H9c2细胞接种于96孔板中,每孔5×103个细胞,然后置37℃、体积分数5%CO2培养箱中继续培养24 h。按照1.3方法分组和处理后,分别加入100μL MTT,置37℃培养箱中培养4 h,去上清,再加入100μL二甲基亚砜,于振荡仪上反应10 min,待结晶紫完全溶解后,在酶标仪上检测490 nm处光密度(OD)值,以不含细胞的培养基作为空白组。细胞存活率=(实验组OD值/空白组OD值)×100%。实验重复3次。
1.5 H9c2细胞中MDA含量、ROS水平和上清液中LDH含量检测 H9c2细胞按照1.3方法分组和处理后,分别收集细胞和细胞培养上清液,参照MDA、LDH、ROS检测试剂盒说明书测定细胞中MDA含量和ROS水平以及培养上清液中LDH含量。实验重复3次。
1.6 H9c2细胞凋亡率的检测 H9c2细胞按照1.3方法分组和处理后,收集各组细胞,PBS洗涤2次,离心去上清,Binding Buffer重悬细胞,依次加入Annexin Ⅴ-FITC 5 μL、PI5 μL,轻轻混匀,室温下避光孵育15 min,上流式细胞仪检测细胞凋亡率。实验重复3次。
1.7 W estern blot检测 H9c2 细胞中 NF-κB p65和TLR-4蛋白表达水平 H9c2细胞按照1.3方法分组和处理后,收集各组细胞,分别加入RIPA裂解液提取细胞中总蛋白。通过BCA法检测蛋白浓度。取40μg蛋白行聚丙烯酰胺凝胶电泳,分离蛋白后以半干法将蛋白转移至PVDF膜上,将膜置50 g/L脱脂奶粉封闭液中封闭2 h。依次加入一抗(NF-κB p65、TLR-4一抗均按1∶500稀释)4℃过夜孵育。TBST洗膜后加入1∶3 000稀释的二抗,室温孵育1 h。TBST洗膜后加入超敏ECL化学发光液,静置5 min。采用凝胶成像系统成像拍照,Image J软件分析条带灰度值,以β-actin为内参,以目的蛋白与βactin条带灰度值的比值表示目的蛋白相对表达量。实验重复3次。
1.8 统计学处理 采用SPSS 21.0进行数据分析。5组间细胞存活率、MDA含量、ROS水平、培养上清液中LDH含量、凋亡率、NF-κB p65和 TLR-4蛋白相对表达量的比较均采用单因素方差分析,两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1 各组细胞存活率比较 与Con组比较,H/R组细胞存活率降低;与H/R组比较,H/R+MDP组、H/R+HDP组细胞存活率升高。见表1。
2.2 各组细胞中MDA含量、ROS水平及上清液中LDH含量比较 与Con组比较,H/R组细胞中MDA含量、ROS水平及上清液中LDH含量升高;与H/R组比较,不同质量浓度的铁皮石斛多糖预处理组细胞中MDA含量、ROS水平及培养上清液中LDH含量均降低。见表1。
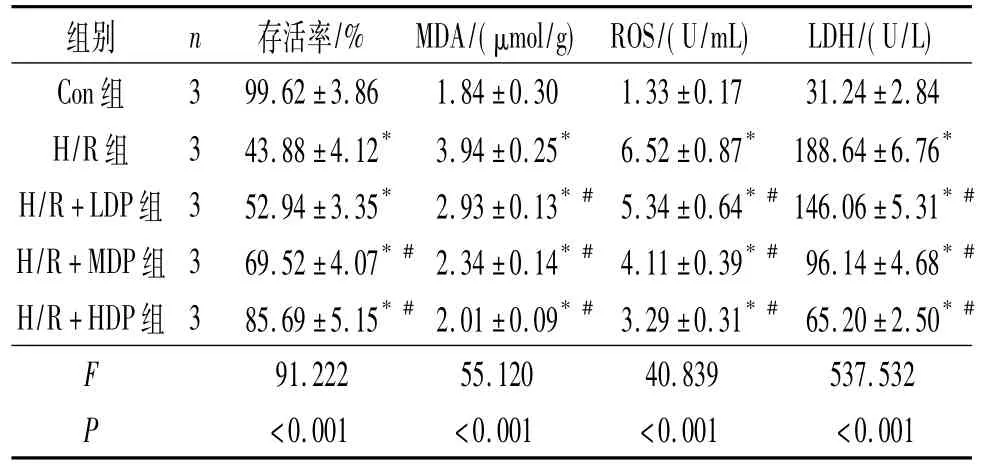
表1 各组细胞存活率、细胞中MDA含量和ROS水平及上清液中LDH含量比较
2.3 各组细胞凋亡率比较 与Con组比较,H/R组细胞凋亡率升高;与H/R组比较,不同质量浓度的铁皮石斛多糖预处理组细胞凋亡率降低。见表2。
2.4 各组细胞 NF-κB p65、TLR-4蛋白表达的比较 结果见图1和表2。与Con组比较,H/R组细胞中NF-κB p65和TLR-4蛋白表达水平升高;与H/R组比较,H/R+MDP组和H/R+HDP组细胞中NF-κB p65蛋白表达水平降低;与H/R组比较,不同质量浓度的铁皮石斛多糖预处理组H9c2细胞中TLR-4蛋白表达水平降低。
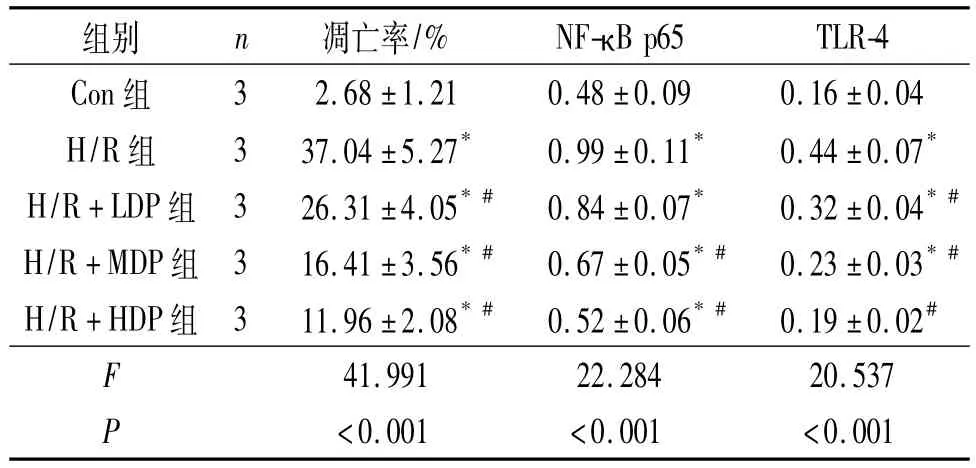
表2 各组细胞凋亡率及NF-κB p65和TLR-4蛋白相对表达量比较
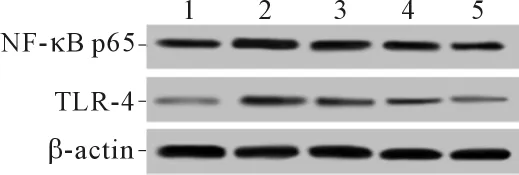
图1 各组细胞中NF-κB p65和TLR-4蛋白的表达
3 讨论
缺血性心脏病具有较高的发病率和病死率,目前已成为世界公共卫生健康问题。其治疗手段是心肌缺血后再恢复血流灌注,然而,再灌注往往达不到预期效果,甚至加重心肌细胞坏死及组织损伤[5]。因此如何防治心肌缺血再灌注损伤成为临床上治疗缺血性心脏病不可忽视的问题。研究[6-7]表明中药在预防心肌缺血再灌注损伤中发挥重要作用。铁皮石斛多糖是传统珍贵中药铁皮石斛中的有效活性成分,具有广泛的抗氧化、抗衰老、抗炎等生理活性。
本实验结果显示,与Con组比较,H/R组H9c2细胞在缺氧/复氧损伤后,细胞存活率降低,细胞中MDA含量及ROS水平均显著升高,细胞外LDH漏出量增多,且细胞凋亡增多,提示成功构建了心肌细胞缺氧/复氧模型。以往研究[8]显示,铁皮石斛多糖可呈剂量依赖性降低高糖诱导的Müller细胞凋亡,提高细胞活力。结合以往实验研究[9]及预实验结果,本实验选取0.1、0.2、0.4 μg/L 的铁皮石斛多糖预处理H9c2细胞,结果显示,与H/R组比较,铁皮石斛多糖预处理组细胞存活率升高,细胞中MDA含量及ROS水平均明显降低,培养上清液中LDH含量降低,细胞凋亡率降低。表明铁皮石斛多糖能够对缺氧/复氧的H9c2细胞起到较好的保护作用,其作用机制与减少细胞内脂质过氧化物的产生及清除ROS有关,这与以往研究[10]结果一致。大量研究[11-14]表明,心肌缺血再灌注损伤过程中可产生大量的炎症介质及趋化因子,包括 NF-κB和 TLR-4。本研究发现,经缺氧/复氧处理后,H9c2细胞中NF-κB p65和TLR-4的表达水平显著升高;而不同质量浓度的铁皮石斛多糖预处理后,细胞中NF-κB p65和TLR-4的表达水平明显降低。提示铁皮石斛多糖通过降低NF-κB p65和TLR-4的表达抑制H9c2细胞损伤和凋亡。
综上,铁皮石斛多糖对H9c2细胞缺氧/复氧损伤具有保护作用,其作用机制可能与清除细胞内ROS、降低细胞内脂质过氧化物、抑制TLR-4/NF-κB信号通路有关。本研究结果进一步证实了铁皮石斛多糖对心肌缺血再灌注损伤的保护作用,为铁皮石斛多糖在缺血性心脏病的临床应用提供了实验依据。
