RNU12 siRNA转染对EC9706细胞生物学特性的影响
2019-09-27贺大璞梁任技谢首智吴生荣
莫 靓,韦 兵,贺大璞,聂 军,梁任技,阳 志,谢首智,吴生荣
南华大学附属第一医院胸外科湖南衡阳421001
食管癌是全球范围内高发的消化道恶性肿瘤,严重危害人类健康和生命[1]。食管癌早期缺乏特异性症状且缺少可靠的诊断标志物,大部分食管癌患者确诊时已处于中晚期,失去了最佳手术时机,导致其5 a生存率不足10%[2]。食管癌细胞的恶性增殖以及侵袭和转移是导致患者预后不良的主要原因[3],因此有效抑制食管癌细胞增殖、侵袭和迁移等恶性生物学行为,寻找潜在的诊断标志和治疗靶点,对食管癌的治疗具有非常重要的意义。长链非编码RNA(long non-coding RNA,LncRNA)是一种不编码蛋白质、长度>200 nt的RNA,参与调控基因的转录、翻译及染色质修饰。目前研究[4-5]表明,LncRNA的紊乱表达与多种肿瘤的发生和发展密切相关。Liu等[6]的初步研究发现,LncRNA RNU12在食管癌组织中异常高表达。陈施翰等[7]的研究发现,LncRNA RNU12通过在转录水平上促进热休克蛋白72的表达,抑制重组人TNF相关凋亡诱导配体TRAIL蛋白的表达,从而诱导肝癌MHCC97-H细胞凋亡。但目前关于RNU12在食管癌中的作用知之甚少。因此,本研究旨在探讨RNU12在人食管癌EC9706细胞中的表达水平以及干扰RNU12的表达对EC9706细胞生物学特性的影响,以期为食管癌的诊治提供潜在的分子靶点。
1 材料与方法
1.1 材料 人食管鳞癌EC9706细胞株和人正常食管上皮细胞株HEEC购自中国科学院上海生命科学研究院细胞库,RPMI 1640培养基、胎牛血清购自美国Gibco公司,胰蛋白酶、二甲基亚砜购自美国HyClone公司,Trizol抽提 RNA试剂、反转录试剂盒、SYBR Green PCR Master Mix试剂盒购自日本TaKaRa公司,Lipofectamine2000脂质体转染试剂、MTT试剂购自美国Invitrogen公司,RNU12 siRNA序列以及随机序列(RNU 1 2 siRNA序列:GGG AGAGTTAAAGAGACTAAT;随机序列:TTCTCC GAACGTGTCACGT)均购自上海吉玛制药有限公司,Annexin V-FITC/PI细胞凋亡检测试剂盒、Transwell小室、Matrigel基质胶购自美国BD公司。
1.2 EC9706细胞和 HEEC细胞中 LncRNA RNU12表达水平的检测 采用qRT-PCR法。常规培养EC9706细胞和HEEC细胞,分别收集处于对数生长期的两种细胞,采用Trizol抽提细胞中总RNA,测定浓度和纯度后采用反转录试剂盒反转录为cDNA。以稀释后的cDNA为模板,采用 SYBR Green PCR Master Mix试剂盒进行 PCR扩增。RNU12上游引物 5’-TGCGGCCTTACCCAGTTCTC-3’;下游引物5’-CATGCTGGAGGCTGGGGTTAT ATC-3’,β-actin上游引物5’-GTTTTGTTTTGGC GCTTTTGAC-3’,下游引物 5’-CGCGACCATCCTC CTCTTAG-3’(均由上海生工生物工程有限公司设计合成),反应条件:95℃预变性3 min;95℃变性30 s,58℃退火30 s,72℃延伸30 s,共40个循环。反应结束采用2-ΔΔCt法计算RNU12的相对表达水平。实验重复3次。
1.3 细胞培养与转染 取对数生长期的EC9706细胞接种于6孔板,置37℃培养箱中过夜培养,待细胞生长密度约为50%时进行转染,操作步骤参照Lipofectamine2000说明书,转染RNU12 siRNA的细胞为RNU12 siRNA组,转染随机序列的细胞为阴性对照组,未进行转染处理的EC9706细胞为空白对照组。转染后各组细胞置37℃常规培养箱中继续培养,转染4~6 h换液。
1.4 3组细胞中RNU12表达水平的检测 分别收集转染48 h的3组细胞,同1.2方法检测RNU12的表达水平。
1.5 3组细胞增殖能力检测 将EC9706细胞接种于96孔板,按1.3分组,每组设3个复孔。转染24、48、72 h后,每孔分别加入5 g/L的MTT溶液20μL,37℃孵育4 h,取出培养板,吸去上清液,每孔加入150μL二甲基亚砜,混匀后,置摇床避光反应10min,待沉淀完全溶解后,使用酶标仪测定490 nm波长处的光密度值,代表细胞的增殖能力。实验重复3次。
1.6 3组细胞凋亡率检测 取对数生长期的EC9706细胞接种到6孔板,按1.3分组,转染48 h后收集细胞至1.5 mL EP管中,用预冷的PBS洗涤2次,离心收集细胞,用100μL结合缓冲液重悬,依次添加Annexin V-FITC和PI染液各5μL,缓慢混匀后,室温避光反应15 min,添加结合缓冲液至总体积为500μL,使用流式细胞仪测定凋亡,计算凋亡率。实验重复3次。
1.7 3组细胞侵袭和迁移能力检测 分别收集转染24 h的3组EC9706细胞,用不含血清的RPMI 1640培养基重悬细胞,调整细胞密度为1×105个/孔,取200μL细胞悬液接种到以Matrigel基质胶包被的Transwell小室的上室,下室中加入500μL含体积分数10%胎牛血清的RPMI 1640培养基,置37℃培养箱中继续培养24 h。取出Transwell小室,除去旧培养基,以预冷的PBS洗涤小室2次,以40 g/L多聚甲醛固定30 min,吸取固定液晾干,以1 g/L结晶紫染色20min,以预冷的PBS洗涤3次,用棉签轻轻拭去上室细胞,置显微镜下选取5~8个视野观察并计数穿膜细胞数,用以反映细胞侵袭能力。采用同样的方法检测细胞迁移能力,区别在于Transwell小室不以Matrigel基质胶包被,其余步骤同侵袭实验。实验均重复3次。
1.8 统计学处理 采用SPSS 21.0处理数据。应用两独立样本t检验比较EC9706细胞和HEEC细胞中RNU12表达水平的差异,应用单因素方差分析比较3组EC9706细胞中RNU12表达水平、光密度值、凋亡率以及侵袭和迁移能力(穿膜细胞数)的差异,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1 EC9706细胞和HEEC细胞中RNU12表达水平的比较 EC9706细胞中RNU12的表达水平(13.28 ±1.42)高于 HEEC 细胞(1.01 ±0.11)(t=14.922,P=0.001)。
2.2 RNU12 siRNA转染效果观察 转染48 h后,空白对照组、阴性对照组和 RNU12 siRNA组EC9706细胞中RNU12的表达水平分别为(1.00±0.10)、(0.98 ± 0.09)和(0.19 ± 0.02),3 组间相比,差异有统计学意义(F=103.832,P <0.001);与空白对照组和阴性对照组比较,RNU12 siRNA组细胞中RNU12表达水平降低(P<0.05)。
2.3 3组EC9706细胞增殖能力比较 结果见表1。由表1可知,转染48、72 h,与空白对照组和阴性对照组比较,RNU12 siRNA组细胞增殖能力受到抑制。
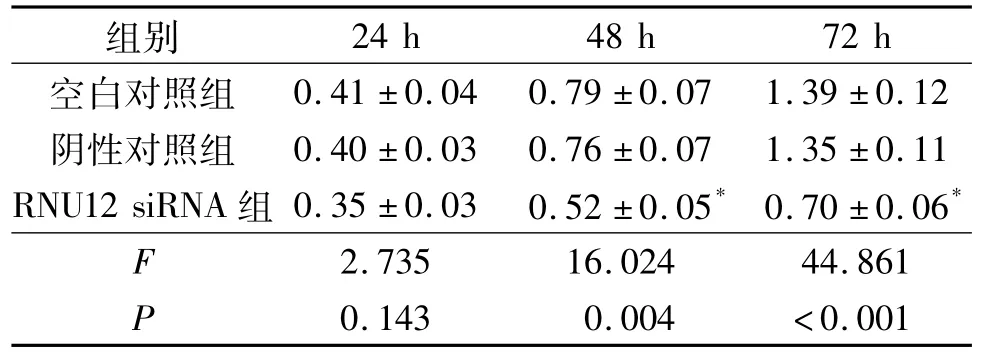
表1 3组EC9706细胞增殖能力比较(n=3)
2.4 3组EC9706细胞凋亡率及侵袭、迁移能力的比较 结果见表2。由表2可知,与空白对照组和阴性对照组比较,RNU12 siRNA组细胞凋亡率(转染48 h)升高,侵袭和迁移能力(转染24 h)下降。
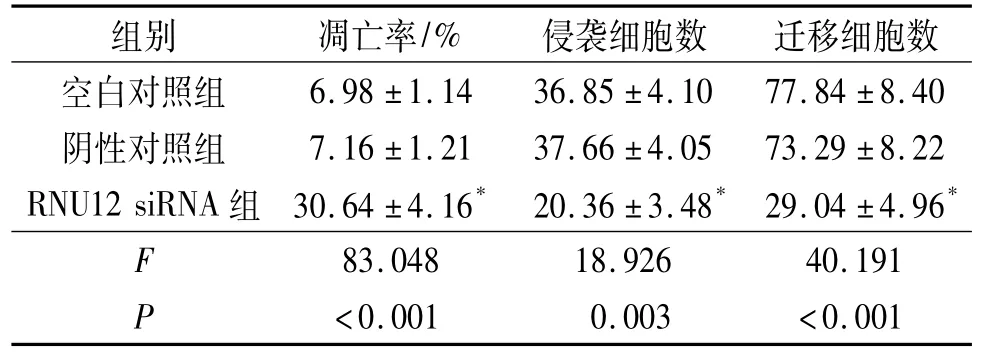
表2 3组EC9706细胞凋亡率及侵袭、迁移能力的比较(n=3)
3 讨论
LncRNA异常表达与人类多种疾病包括肿瘤的发生和发展密切相关[8-10]。多项研究[11-12]已证实,LncRNA有望成为肿瘤早期诊断和预后判定的标志分子以及肿瘤治疗的分子靶点。最近,在食管癌中发现多种异常表达的LncRNA,这些LncRNA在食管癌的发病和进展中扮演至关重要的角色。Zheng等[13]研究显示,LncRNA PVT1的高表达能够促进食管癌上皮-间充质转化和侵袭。Jiao等[14]实验发现LncRNA UCA1通过靶向调控Sox4的表达促进食管癌细胞增殖。LncRNA SNHG7可通过调节p15和p16的表达促进食管癌细胞增殖并抑制其凋亡[15]。敲低LncRNA CASC9可抑制食管癌细胞体外迁移和侵袭能力[16]。以上研究表明LncRNA能够通过影响食管癌细胞增殖、凋亡、侵袭和迁移等生物学特性在食管癌的发生和发展中起调控作用。有研究[17]显示,RNU12在膀胱癌中异常高表达。另外有研究[7]表明抑制RNU12的表达可诱导肝癌MHCC97-H细胞凋亡。
本研究发现,RNU12在食管癌EC9706细胞中的表达高于食管上皮HEEC细胞。为探究RNU12的表达改变在食管癌中的作用,本实验通过脂质体转染法将RNU12 siRNA转染至食管癌EC9706细胞中,观察对食管癌细胞生物学特性的影响。结果表明,转染RNU12 siRNA后,EC9706细胞中 RNU12表达水平降低,说明 RNU12 siRNA能够干扰EC9706细胞中RNU12的表达。同时,干扰RNU12表达后,EC9706细胞增殖能力受抑,细胞凋亡率上调,细胞侵袭和迁移能力均受到阻碍。以上实验结果表明RNU12在食管癌中作为促癌基因发挥作用,提示RNU12有望成为食管癌治疗的潜在靶点。
综上,RNU12作为促癌LncRNA参与食管癌细胞的增殖、凋亡、侵袭和迁移等生物学行为,可能成为食管癌早期诊断和预后判定的标志分子及治疗靶点之一。
