B族链球菌核酸检测试剂的性能评价
2019-09-26徐英春窦亚玲叶阿里孔令君杨启文
张 睿 徐英春 吴 洁 窦亚玲 伊 洁 叶阿里 孔令君 杨启文*
B族链球菌(group B streptococci,GBS),学名无乳链球菌(streptococcus agalactiae)是一种条件致病革兰阳性菌,正常健康人感染GBS并不致病,但近代临床观察发现其在引起孕妇感染、胎儿早产、发育不良、胎膜早破及晚期流产等[1]方面的影响越来越明显.新生儿GBS感染的临床表现有肺炎、脓毒血症、脑膜炎及菌血症等[2-3].近年来,荧光定量聚合酶链反应(polymerase chain reaction,PCR)技术因其具有很好的特异性和敏感性而在临床广泛使用,应用该技术检测GBS能够缩短临床诊断时间,为进一步的治疗和预防提供方法和手段,极大提高检测效率,是孕妇产前筛查GBS感染的理想方法.本研究旨在验证荧光定量PCR技术对GBS检测的准确性和适用性,以及临床应用的可行性.
1 材料与方法
1.1 实验样本
MALDI-TOF鉴定后的临床GBS菌株10株(108CFU/ml),阴道-直肠分泌物拭子56例;干扰菌株包括A族链球菌(编号:16W06622)、肺炎链球菌(编号:16E06041)、草绿色链球菌(编号:16W06258)、粪肠球菌(编号:18BW06368)以及大肠埃希菌(编号:18FW02400)各一株(108CFU/ml),-20 ℃保存.
1.2 仪器与试剂
采用ABI 7900型荧光PCR仪(美国赛默飞公司),使用ABI 7900 SDS Software 2.4软件进行数据分析.GBS核酸检测试剂盒(上海之江/江苏硕世生物科技股份有限公司);PCR-荧光探针法的A和B试剂盒.
1.3 操作步骤
严格按照A和B试剂盒说明书,对同一样本进行核酸提取、PCR反应试剂配制和加样;分别计算A和B试剂盒检测的阴性、阳性个数.
(1)A试剂的提取方法:样本试管中加入1 ml无菌生理盐水,充分震荡摇匀,吸取液体转至1.5 ml离心管中,13000 r/min离心5 min.沉淀加无菌生理盐水1 ml混匀,13000 r/min离心5 min,重复洗涤一次.沉淀直接加入100 μl核酸提取液充分混匀,同时加入内标1 L,99 ℃干浴或水浴10 min,13000 r/min离心10 min,取上清4 μl作为PCR反应模板.
(2)B试剂的提取方法:取1 ml无菌生理盐水悬浮样本于1.5 ml离心管中,充分震荡后13000 r/min离心5 min.弃去上清,在洗涤后的标本中加入1管固态提取物(0.06 g玻璃珠),取50 μl DNA提取液加于1.5 ml离心管中,同时加入2 μl内部对照,高速涡旋震荡2 min,99 ℃干浴2 min,立即冰浴3 min,然后13000 r/min离心1 min,取上清5 μl可直接用于下游PCR加样扩增.
1.4 实验方法及判定标准
1.4.1 准确性实验
(1)鉴定后的不同GBS菌株用生理盐水稀释成浓度为105CFU/ml的10例,104CFU/ml的10例,103CFU/ml的1例,102CFU/ml的1例,10 CFU/ml的1例;无菌生理盐水制成的阴性样本5例;阴道-直肠分泌物拭子56例,分别用两家试剂盒进行检测.
(2)判定标准:总符合率、阳性符合率及阴性符合率应≥95%.
1.4.2 重复性实验
(1)将已知三份阳性标本(105CFU/ml、104CFU/ml及103CFU/ml各1例)和一份阴性样本,重复测定5次,测定2 d,计算每个标本的重复性.通过循环阈值(cycle threshold,Ct)计算变异系数CV%.
(2)判定标准:Ct值的变异系数≤5%.
1.4.3 检测下限测定
(1)鉴定后的临床GBS菌株:将上述临床GBS菌株一株稀释为104CFU/ml、103CFU/ml、102CFU/ml及10 CFU/ml,每个稀释测试5次,计算标本检出率,选取其前稀释的值,确定该试剂的检测下限.
(2)判定标准:若A和B试剂盒103CFU/ml稀释品检出率均为100%,比较102CFU/ml和10 CFU/ml检出率,以检出率更高者为优.
1.4.4 携带污染测定
(1)选取GBS阳性样本(105CFU/ml3例,104CFU/ml2例)5例,每个阳性样本后紧跟着无菌生理盐水制成的阴性标本,同时提取、扩增,重复进行4次.
(2)判定标准:无菌生理盐水制成的阴性标本检测为阴性,即无携带污染.
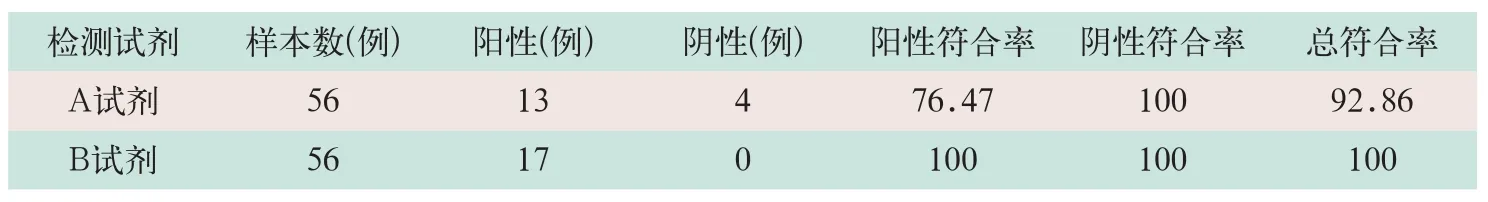
表1 A和B试剂与测序结果总符合率、阳性符合率和阴性符合率比较(%)
1.4.5 干扰和特异性试验
(1)检测标本:对GBS(105CFU/ml)中分别加入等体积5例生殖道可分离的A族链球菌、肺炎链球菌、草绿色链球菌、粪肠球菌及大肠埃希菌(105CFU/ml)的检测,以保证试剂验证GBS的准确无误.
(2)判定标准:加入GBS(105CFU/ml)的5个样本检测为阳性,而未加入GBS的5个样本检测GBS为阴性.
1.5 统计学方法
采用Excel2007及SPSS17.0统计软件,进行总符合率、阳性符合率和阴性符合率比较.
2 结果
2.1 准确性验证
(1)临床菌株准确性验证结果:A和B试剂盒检测GBS菌株(105CFU/ml菌株和104CFU/ml各10例),阴性样本5例与金标准(菌株鉴定)总符合率、阳性符合率和阴性符合率均为100%.
(2)临床拭子标本准确性验证结果:样本经过测序所得序列经Blast比对,A试剂总符合率为92.86%,阳性符合率为76.47%,阴性符合率为100%>95%;B试剂总符合率、阳性符合率和阴性符合率均为100%,B试剂符合准确性验证要求,见表1.
2.2 重复性和可报告范围性能验证
A和B试剂检测GBS样本(105CFU/ml、104CFU/ml及103CFU/ml)Ct值的CV均≤5%,3种含量标本的变异系数为B试剂较A试剂高.验证结果见表2.
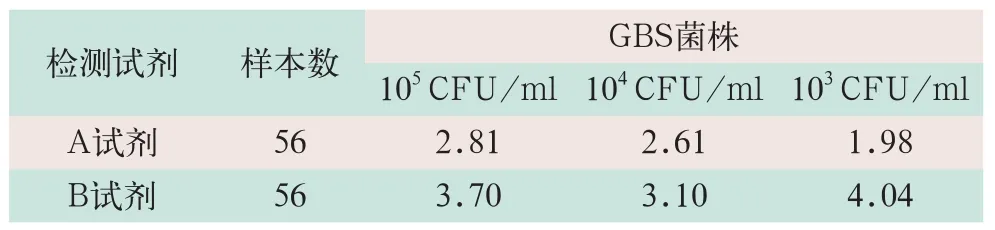
表2 A和B试剂Ct 值变异系数CV比较(%)
2.3 携带污染和可报告范围验证
每个阳性样本携带1个生理盐水制成的阴性样本重复检测4次,阴性对照实验结果均为阴性,表明生理盐水阴性对照为阴性,无携带污染,A和B试剂盒都符合要求.
可报告范围验证结论:含量为105CFU/ml和104CFU/ml样本判断为阳性;生理盐水制成的阴性样本判断为阴性,A和B试剂盒都符合要求.
2.4 最低检测下限验证
A和B试剂盒在样本含量为104CFU/ml和103CFU/ml检出率均为100%;在样本含量为102CFU/ml检出率均为20%,10 CFU/ml检出率为0,因此A和B试剂盒最低检测下限均为103CFU/ml.验证结果见表3.
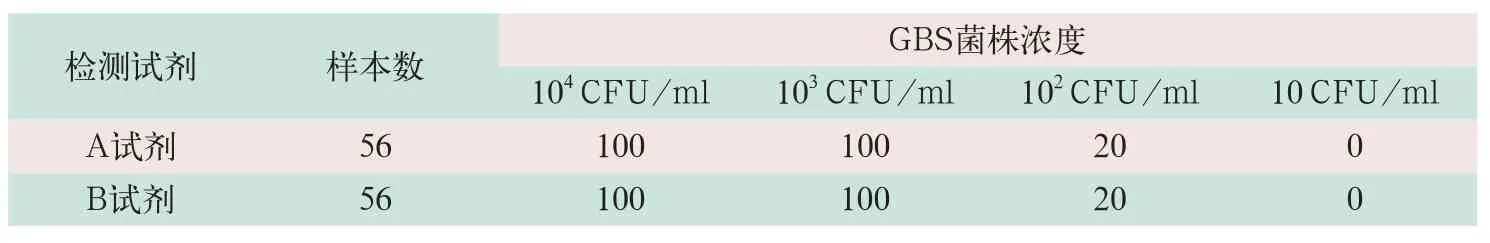
表3 A和B试剂检出率比较(%)
2.5 特异性和抗干扰能力验证
加入GBS含量为105CFU/ml的A族链球菌、肺炎链球菌、草绿色链球菌、粪肠球菌及大肠埃希菌5个样本检测GBS为阳性,而未加入GBS的5个样本检测GBS为阴性.A和B试剂盒都符合特异性和抗干扰实验要求.
3 讨论
GBS是西方国家新生儿围生期感染的首要致病菌,也是引起早产和死胎的三大致病菌之一,美国疾病预防和控制中心于1996年、2002年和2010年制定修正了围生期GBS感染筛查及防治指南.我国对于GBS产前筛查未全面普及,孕产妇未常规行GBS筛查,北京地区孕产妇GBS阳性筛查率为7.1%,深圳为18.4%,台湾地区为20.0%[4-5].由于GBS近年来感染呈上升趋势,在新生儿感染方面引起了严重后果,所以能够快速准确的检测GBS成为临床确诊的关键前提[6-8].GBS的常规检测为细菌培养法,检测时间较长,而荧光定量PCR法具备其敏感性强,准确性高[9-10]等特点在临床实验室检测中作用日益突出.
在对试剂进行多角度评估过程中,准确性的验证尤为重要,这是关系到实验结果是否可靠的前提;一个试剂是否能达到说明书的要求,正确的检测出靶基因并将其通过荧光信号的形式反映出来是关键所在.本研究实验从总符合率,阳性符合率(分析敏感性),阴性符合率(分析特异性)3方面对试剂进行准确性的评估.A试剂因总符合率(92.86%)和阳性符合率(76.47%)均<95%,不符合验证要求.重复性验证反映的是试剂稳定的指标,因为在同一时间,同一操作人员用同一批次和不同批次试剂重复加样,最终用Ct值的CV大小来量化.虽然A和B试剂在重复性验证过程中,CV值均≤5%,符合验证要求,但在含量为105CFU/ml、104CFU/ml及103CFU/ml的3种含量的测定过程中,B试剂的CV值比A试剂高,这也反应出A试剂实际上在实验操作过程中较B试剂稳定.在携带污染的检测过程中,只要操作人员遵守分子生物学实验室的操作规定和试剂说明书要求,一般都会避免此类现象的发生.最低检测下线反映的是试剂能够检测到的菌液最小浓度的能力,将菌液从108CFU/ml稀释到104CFU/ml、103CFU/ml、102CFU/ml和10 CFU/ml的4种含量梯度进行重复检测,以检出率作为判定标准,A和B试剂在最低检测下线的验证中均相同(为103CFU/ml).特异性和抗干扰能力反映的是试剂是否能够在样本中混杂有其他物质(干扰细菌)时还能够准确的捕捉靶基因的能力,因此本研究实验选取了阴道-直肠内常见的几种细菌,最终A和B试剂也都符合验证要求.
A和B试剂在重复性、携带污染、最低检测下线、特异性和抗干扰能力验证方面均符合要求,但由于A试剂总符合率和阳性符合率均<95%,不符合验证要求,最终,B试剂在性能验证过程中脱颖而出.
本研究实验从多方面对试剂进行评估,确保试剂在应用于临床前的安全性和有效性.
