一种肠镜润滑消泡剂的细胞毒性和遗传毒性生物学评价
2019-09-25黄虹蓉林钟石刘尧钟文雨
黄虹蓉 林钟石 刘尧 钟文雨
摘要:目的 對一种以二甲基硅油、甘油、羧甲基纤维素钠为成分的肠镜润滑消泡剂进行细胞毒性和遗传毒性评价,为这种肠镜润滑消泡剂在临床使用提供生物安全依据。方法 选择琼脂扩散试验对肠镜润滑消泡剂进行体外细胞毒性检测,选择细菌回复突变试验(Ames试验)、用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验(MLA试验)、体外哺乳动物细胞染色体畸变试验进行遗传毒性检测。细胞毒试验,将样品放置在固化的琼脂层上与L929细胞间接接触24 h,用中性红对细胞进行染色后显微镜下观察细胞毒性。Ames试验选用TA97a、TA98、TA100、TA102、TA1535五种组氨酸缺陷型鼠伤寒沙门氏菌株,观察肠镜润滑消泡剂对细菌回复突变率的影响;MLA试验采用小鼠淋巴瘤细胞与样品溶液接触3 h和24 h,通过计算其平板效率和大小集落形成数目计算突变频率,判断受试样品对小鼠淋巴瘤细胞突变率的影响;体外哺乳动物细胞染色体畸变试验,使样品溶液与中华地鼠肺细胞(CHL细胞)接触6 h和24 h,通过对处于有丝分裂中期的CHL细胞的染色体畸变情况进行分析,评价肠镜润滑消泡剂对CHL细胞潜在的致突变性。结果 在细胞毒试验中,受试样品与阴性对照相比,细胞数量相对较少且受试样品显微镜下观察有少量畸形和退化的细胞,为轻微的细胞毒性;Ames试验样品组回变菌落数均未比阴性对照回变菌落数增加1倍或者1倍以上且无重复性;MLA试验样品组MF值与阴性对照相比无超过126×10-6的增长;染色体畸变试验受试样品组染色体结构畸变率与阴性对照相比,差异无统计学意义(P>0.05)。结论 以二甲基硅油、甘油、羧甲基纤维素钠为成分的肠镜润滑消泡剂无潜在的细胞毒性和遗传毒性,可进一步用于临床研究。
关键词:肠镜润滑消泡剂;Ames试验;MLA试验;细胞毒性;遗传毒性
中图分类号:R394 文献标识码:A DOI:10.3969/j.issn.1006-1959.2019.16.019
文章编号:1006-1959(2019)16-0062-05
Abstract:Objective To evaluate the cytotoxicity and genotoxicity of a colonoscopy lubricant defoamer based on dimethyl silicone oil, glycerin and sodium carboxymethyl cellulose, and provide clinical use for this colonoscopy lubrication defoamer and biosafety basis.Methods The agar diffusion test was used to detect the in vitro cytotoxicity of the colon gel lubrication defoamer. The bacterial back mutation test (Ames test), the in vitro mammalian cell gene mutation test (MLA test) using mouse lymphoma cells, and the in vitro breastfeeding were selected. Genotoxicity testing for animal cell chromosome aberration test. In the cytotoxicity test, the sample was placed on the solidified agar layer for indirect contact with L929 cells for 24 h, and the cells were stained with neutral red, and the cytotoxicity was observed under a microscope. Ames test used TA97a, TA98, TA100, TA102, TA1535 five histidine-deficient Salmonella typhimurium strains to observe the effect of colonoscopy lubrication defoamer on bacterial reversion rate; MLA test using mouse lymphoma cells and sample solution After 3 h and 24 h of exposure, the mutation frequency was calculated by calculating the plate efficiency and the number of colony formation, and the effect of the test sample on the mutation rate of mouse lymphoma cells was determined. In vitro mammalian cell chromosome aberration test, the sample solution and the Chinese hamster lung cells (CHL cells) were exposed for 6 h and 24 h. The chromosomal aberrations of CHL cells in the middle stage of mitosis were analyzed to evaluate the potential mutagenicity of colon gel lubrication defoamers on CHL cells.Results In the cytotoxicity test, the number of cells in the test sample was relatively small compared with the negative control, and a small amount of abnormal and degraded cells were observed under the microscope of the test sample, which was mild cytotoxicity; The number of colonies did not increase by 1 time or more than the number of colonies of the negative control and there was no repeatability; the MF value of the MLA test sample group did not exceed 126×10-6 growth compared with the negative control; the chromosome aberration test was subjected to the sample. There was no significant difference in the chromosome structural aberration rate between the group and the negative control (P>0.05).Conclusion The colonoscopy lubricant defoamer with dimethyl silicone oil, glycerin and sodium carboxymethyl cellulose has no potential cytotoxicity and genotoxicity and can be further used in clinical research.
Key words:Colonoscopy lubrication defoamer;Ames test;MLA test;Cytotoxicity;Genotoxicity
肠镜检查是一种内窥式最直观的肠道检查方法,可以帮助医生了解患者肠道内部的情况,是检查肠道内部病变的一种常用诊断方式。同时,润滑消泡剂的使用是提高肠镜检查效率最简单、最方便、最经济的方法[1]。肠镜润滑消泡剂既可以减少肠镜与肠道黏膜的摩擦进而减轻患者的呕心感和疼痛感,也降低了医生操作肠镜的难度。作为一种表面接触医疗器械,由于它直接与人体肠道粘膜接触且使用后是由人体自身将其代谢排出,因此,对肠镜润滑消泡剂进行细胞毒性和遗传毒性评价尤为重要。本文通过体外细胞毒性和遗传毒性试验,对主要成分为二甲基硅油、甘油及羧甲基纤维素钠的受试样品的生物安全性作较详细的评价,为肠镜润滑消泡剂的发展及其在生物临床应用中提供安全可靠的依据。
1材料与方法
1.1试验材料
1.1.1受试样品 受试样品为肠镜润滑消泡剂;在无菌条件下,依据GB16886.12-2017的标准要求,取样品适量溶解在生理盐水中,作为Ames试验的样品溶液;取样品适量溶解在含10%马血清的RPMI1640培养基中,作为MLA试验的样品溶液;取样品适量溶解在含10%胎牛血清的MEM培养基中,作为体外哺乳动物细胞染色体畸变试验的样品溶液。
1.1.2试验菌株 TA97a、TA98、TA100、TA102、TA1535五种组氨酸缺陷型菌株,购自美国mltox公司;按照标准GB16886.3-2008的要求对五种菌株进行了组氨酸缺陷型鉴定、脂多糖屏障缺陷鉴定、R因子检查、uvrB修复缺陷型鉴定、四环素抗性鉴定及菌株的自发回变菌落数鉴定,鉴定结果均在规定的正常范围内。
1.1.3试验细胞株 小鼠淋巴瘤细胞L5178Y TK+/-3.7.2C,购自China Center For Type Culture Collection;用含10%马血清的RPMI1640培养基在37℃,5%CO2的培养箱中培养,细胞生长良好,悬浮生长正常,试验前先对L5178Y TK+/-3.7.2C细胞进行自发突变消除。中华地鼠肺细胞(CHL细胞),购自American Type Culture Collection;小鼠成纤维细胞(L929细胞),购自China Center For Type Culture Collection,用含10%胎牛血清的MEM培养基在37℃,5%CO2的培养箱中培养,细胞生长良好,贴壁生长正常。
1.1.4主要试剂 肝微粒体酶(S9),moltox公司产品;还原性辅酶Ⅱ(NADP),AMRESCO公司产品;2,4,7-三硝基-9-芴酮,AccuStandard公司产品;叠氮化钠(DDN),山东西亚化学工业有限公司产品;秋水仙素,aladdin公司产品;姬姆萨储备液,BASO公司产品;葡萄糖-6-磷酸钠盐(G-6-P)、丝裂霉素C(MMC)、三氟胸苷(TFT)、环磷酰胺(CP)、4-硝基喹啉氧化物(NQO)、1,8-二羟基蒽醌、二甲基亚砜(DMSO),中性红(NR),SIGMA公司产品;2-氨基芴(2-AF)、RPMI1640培养基、马血清(HS)、MEM培养基、胎牛血清(FBS),Thermo fisher公司产品;其他试剂均为进口或国产的分析纯。
1.1.5主要仪器 生化培养箱,日本三洋贸易株式会社产品;恒温振荡器,上海一恒仪器有限公司产品;CO2培養箱,美墨尔特有限公司产品;倒置显微镜,日本奥林巴斯株式会社产品;二氧化碳恒温振荡器,苏州捷美电子有限公司产品;纤维图像采集工作站,荧光倒置显微镜,德国徕卡微系统有限公司产品。
1.2方法
1.2.1细胞毒试验 选择琼脂扩散法对受试样品进行细胞毒性检测,将适宜浓度的L929细胞接种到90 mm的平皿中培养至近汇合状态,弃去培养基加入10 ml熔化琼脂培养基与含20% FBS培养基的混合液,使琼脂的最终质量浓度为1%。将受试样品小心的放置在平皿的固化琼脂上,同时用不含酚红MEM培养基作为阴性对照,用DMSO作为阳性对照,在培养箱中37℃培养24 h后选择NR进行染色,在避光条件下继续孵育3 h,显微镜观察受试样品的细胞毒性[2]。
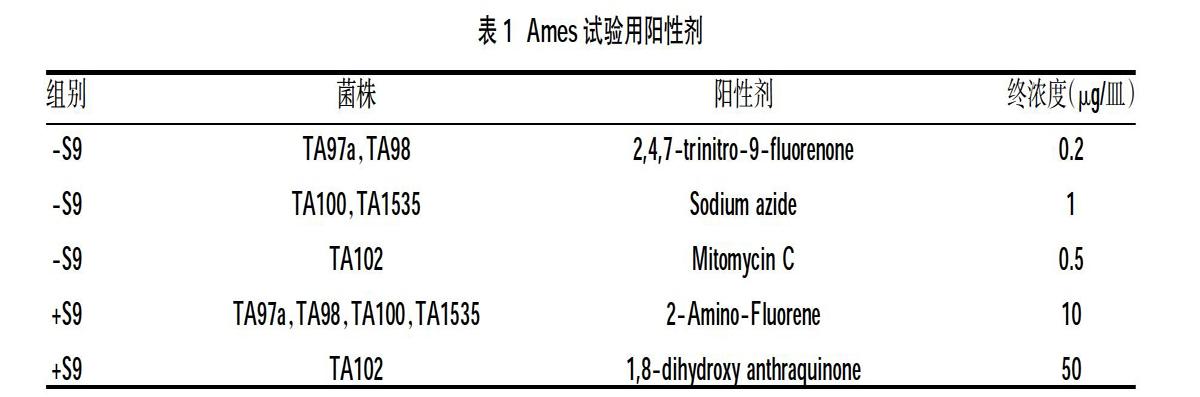
1.2.2 Ames试验 采用平板渗入法进行试验。将TA97a、TA98、TA100、TA102、TA1535菌株接种到肉汤培养基中并在37℃振荡培养以获得适宜浓度的菌悬液。依次在熔化的顶层培养基中加入菌液,受试样品溶液(终浓度5 mg/皿),分设+S9组和-S9组,同时用样品溶剂生理盐水作为阴性对照,表1所列阳性剂作为阳性对照,振荡混匀后倾入到底层培养基上,各剂量组均平行做3个平皿,在培养箱中37℃倒置培养48 h后进行回变菌落数计数,以(x±s)来表示。当样品诱发的回复突变菌落数比阴性对照增加1倍以上且具有可重复性,则可判为样品存在潜在致突变性[3]。
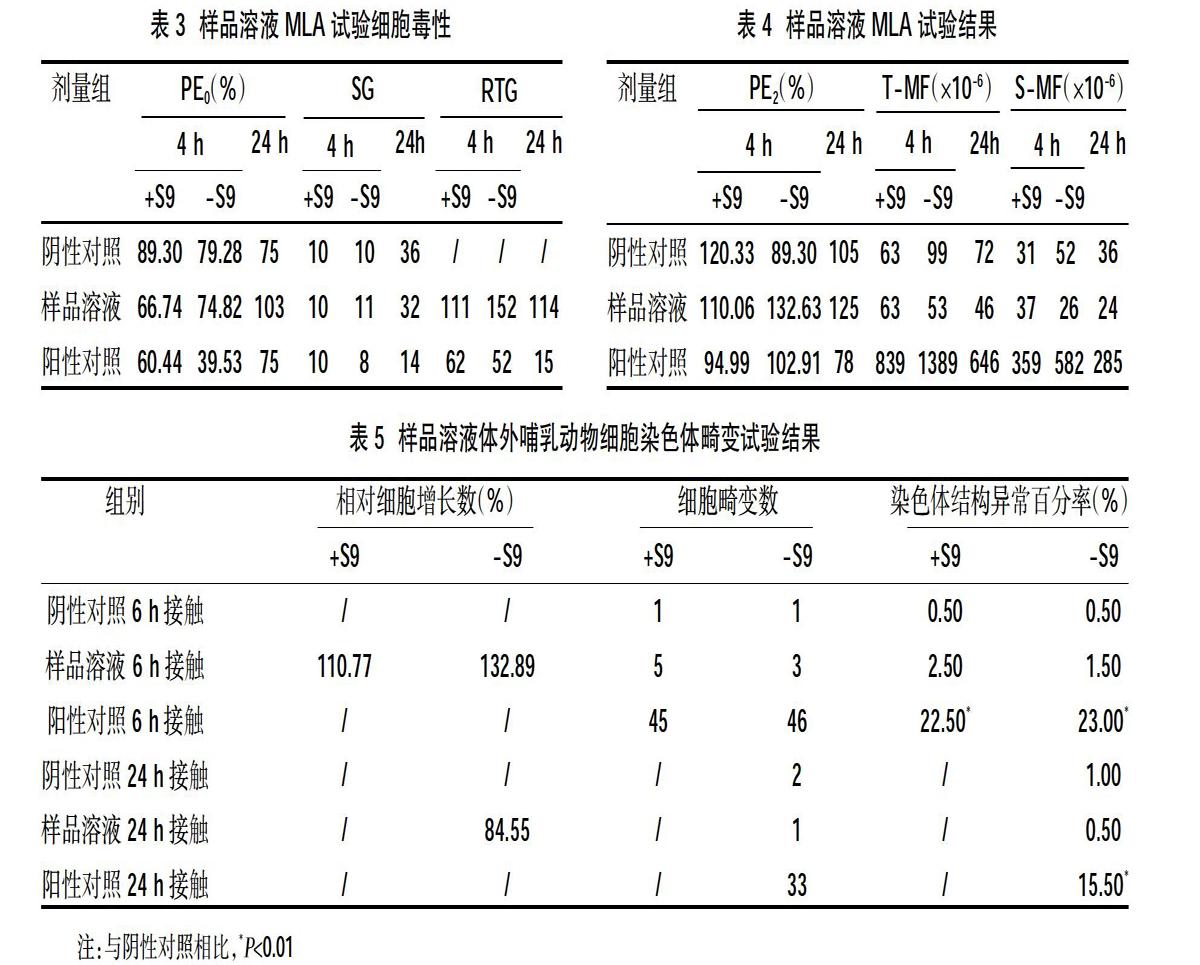
1.2.3 MLA试验 采用96微孔板法进行试验。将L5178Y TK+/-3.7.2C细胞调到适宜的浓度与样品溶液接触3 h和24 h,3 h接触分设+S9组和-S9组,同时用样品溶剂含10%HS的RPMI1640培养基作为阴性对照,用NQO和CP作为无活化系统和有活化系统的阳性对照。接触结束后调整细胞浓度为8个/ml,每个剂量组接种至2块96孔板中为第0天平板接种效率(PE0)。剩余细胞继续培养2 d,每天计数细胞数量并调整细胞浓度;第2天表达培养结束后调整细胞浓度为8个/ml,每个剂量组接种至2块96孔板中为第2天平板接种效率(PE2),同时取适量的细胞液,调整细胞浓度为1×104个/ml,加入终浓度为3 μg/ml的TFT,接种至2块96孔板中以计算TFT抗性突变频率(MF),置于培养箱中37℃,5% CO2的培养14 d后,用肉眼或显微镜观察PE0和PE2每块板有集落形成的孔数及MF平板中96孔板内的大集落数(LC)和小集落数(SC),并根据观察结果计算细胞悬浮增长率(SG)、相对总增长率(RTG)、平板接种效率(PE0和PE2)和突变频率(MF)。
1.2.4体外哺乳动物细胞染色体畸变试验 将生长良好的CHL细胞调整至适宜浓度接种到培养皿中与样品溶液接触6 h和24 h,6 h接触分设+S9组和-S9组,同时用样品溶剂含10% FBS的MEM培养基作为阴性对照,用MMC和CP作为无活化系统和有活化系统的阳性对照。接触结束后用Hanks液洗涤细胞3次,加入培养基继续培养。在收获细胞前3 h加入终浓度为1 μg/ml细胞分裂中期阻断剂秋水仙素。培养结束后用胰蛋白酶液消化细胞,记录细胞数量,对细胞进行离心、低渗、清洗、固定后得到新鲜混悬液。用混悬液制片,室温下自然干燥,并用姬姆萨染液染色。在光学显微镜下,每组挑选200个中期分裂相(染色体数为2n±2)进行染色体畸变分析。记录下观察到的染色体数目和畸变类型。
1.3观察指标 细胞毒性试验结果、Ames试验结果、计算SG、RTG、PE0、PE2和MF;计算相对细胞增长数、细胞畸变数和染色体结构异常百分率。根据OECD标准中的GEF因子规定,若样品组MF值即突变频率与阴性对照组相比超过126×10-6的增长,则判断样品结果为阳性[4]。
1.4统计学方法 采用SPSS 24.0统计软件对染色体畸变数进行统计分析,组间比较采用t检验。P<0.05为差异有统计学意义,P<0.01为统计学意义显著。
2结果
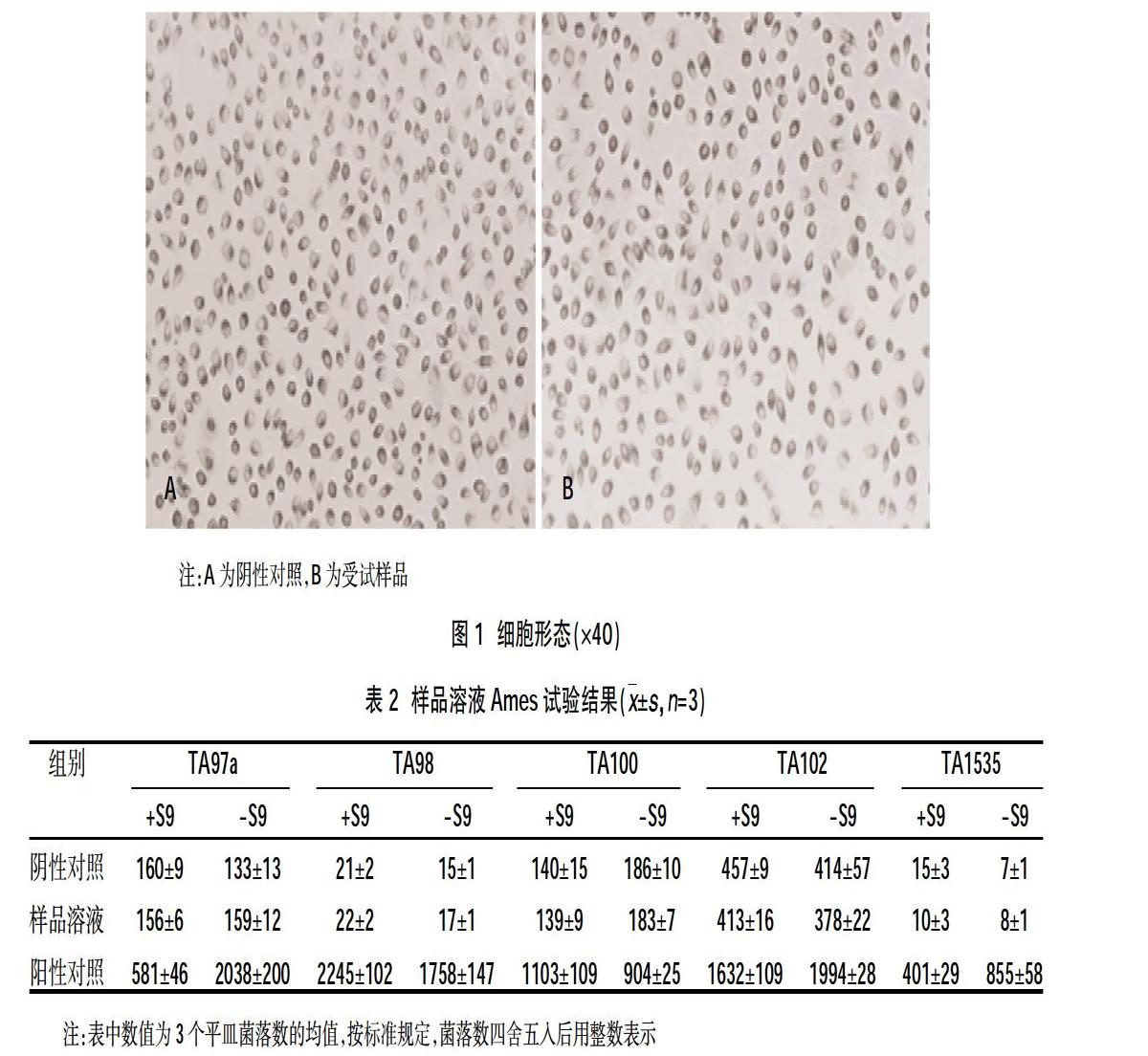
2.1细胞毒试验结果 在显微镜下观察细胞形态见图1,阴性对照和受试样品在样品周围和下方未观察到明显细胞毒性反应区域,受试样品与阴性对照相比,细胞数量相对较少且受试样品显微镜下观察有少量畸形和退化的细胞,为轻微的细胞毒性,反应级别为1级,符合医疗器械细胞毒性等级要求。
2.2 Ames试验结果 在5 mg/皿的受试浓度下,阴性对照回变菌落数在自发回变菌落数正常范围,阳性对照组回变菌落数至少为阴性对照的3倍,试验条件成立。样品组肠镜润滑消泡剂回变菌落数均未比阴性对照回变菌落数增加1倍或者1倍以上且无重复性,故-S9和+S9的试验条件下,肠镜润滑消泡剂50 mg/ml浓度的样品溶液细菌回复突变试验结果均为阴性,见表2。
2.3 MLA试验结果 阴性对照的PE0和PE2结果均在65%~120%,T-MF在50×10-6~170×10-6,对于4 h接触实验细胞总SG在8~32倍,对于24 h接触实验细胞总SG在32~180倍;阳性对照的T-MF比阴性对照高300×10-6以上,其中阳性对照的S-MF比阴性对照高150×10-6以上;各剂量组的RTG都不小于10%。试验结果表明,样品组MF值与阴性对照相比无超过126×10-6的增长。故-S9和+S9的试验条件下,肠镜润滑消泡剂溶液体外哺乳动物细胞基因突变试验结果为阴性,见表3、表4。
2.4体外哺乳动物细胞染色体畸变试验结果 阳性对照与阴性对照相比,统计学意义显著(P<0.01)。在阴性对照中的细胞毒性标准符合要求,样品5 mg/ml浓度的溶液细胞生长率>60%,因此样品5 mg/ml浓度的溶液可提供足够数量的细胞供结果分析,试验条件成立。受试样品组染色体结构畸变率与阴性对照相比,差异无统计学意义(P>0.05),且样品延长24 h接触处理的结果与阴性对照相比,差异无统计学意义(P>0.05),故-S9和+S9的试验条件下,肠镜润滑消泡剂溶液体外哺乳动物细胞染色体畸变试验结果均为阴性,见表5。
3讨论
肠镜润滑消泡剂是一种器械治疗辅助性医疗器械,按照医疗器械在预期临床使用中与人体皮肤、组织或粘膜接触的性质和时间等对医疗器械分类,进而依据GB/T 16886/ISO 10993系列标准对其进行生物学评价试验[5]。在临床使用过程中,肠镜润滑消泡剂在使用后是由人体通过自身的代谢循环将其排出体外或被胃肠道粘膜所吸收,作为一种与粘膜长期接触的表面医疗器械,对其通过细胞毒性和遗传毒性试验以分析评价该产品对人体是否有潜在的风险十分重要,本文所研究的肠镜润滑消泡剂,其主要成分包括二甲基硅油、甘油及羧甲基纤维素钠。据有关研究表明,二甲基硅油成本低,在胃肠镜检查中能改变气泡表面张力,减少肠道内气泡,且不被血液吸收,安全有效,具有较好的消泡效果[6]。甘油具有保湿和润滑的作用,可延长药物在检查中肠道内的停留时间,有利于检查[7]。羧甲基纤维素钠是一种高分子防粘连材料,由于其具有流动性、可压性和润滑黏膜的黏滞性,能够随着器官的蠕动漫布整个腹腔,因此可以有效的防止肠道内部粘连的形成[8]。目前国内外关于肠镜检查用的润滑消泡剂成分种类多,但尚无统一的认识和行业规范[9],二甲基硅油、甘油、羧甲基纤维素钠虽均为胃肠道润滑消泡剂的常用成分且在临床的使用效果良好,但目前在国内外尚无此类肠镜润滑消泡剂或者是关于其主要成分二甲基硅油、甘油和羧甲基纤维素钠的相关生物学评价研究,尤其是细胞毒性和遗传毒方面的研究极少,因此本文通过对一种以二甲基硅油、甘油、羧甲基纤维素钠为成分的肠镜润滑消泡剂进行细胞毒性和遗传毒性评价,为该种肠镜润滑消泡剂在医学临床使用提供生物安全依据,同时也为其他同类型润滑消泡剂提供借鉴。
对肠镜润滑消泡剂进行体外细胞毒性评价,因为采用浸提液法会改变受试样品的pH值,进而影响试验结果且样品在临床使用时是直接与人体黏膜接触,所以本研究选用琼脂扩散法进行体外细胞毒性评价。对肠镜润滑消泡剂的遗传毒性评价,由于没有一种单一的遗传毒性试验方法可检测所有遗传毒性终点,故遗传毒性评价大多采用组合试验的方法。本研究根据人用药物注册技术要求国际协调会议(ICH)提出的标准组合试验[10],选择的试验包括Ames试验、MLA试验和体外哺乳动物细胞染色体畸变试验,该组合具备了以下两个特点:一是涵蓋了不同进化程度的物种(包括原核细胞和真核细胞),二是包含了不同遗传学检测终点(基因突变和染色体畸变),从而合理的反映肠镜润滑消泡剂的潜在的遗传毒性。同时,由于大部分的化学物质需要经过代谢活化才能引起致突变作用,因此本研究中遗传毒试验均从有活化系统(大鼠肝微粒体酶S9)和无活化系统同时对肠镜润滑消泡剂进行更全面的评价[11]。
总之,以二甲基硅油、甘油、羧甲基纤维素钠为成分的肠镜润滑消泡剂作为一种与人体粘膜长期接触的表面医疗器械在细胞毒性和遗传毒性方面均是安全可靠的,为将来肠镜润滑消泡剂的发展及在动物实验和临床上的使用提供了稳定可靠生物安全依据。
参考文献:
[1]Rodriguez-García JL,Carmona-Sánchez R,Rosas-Vitorino C.Usefulness of oil lubrication during colonoscopy:A comparative study with the conventional technique[J].Revista de Gastroenterologia de México,2016,81(1):28-34.
[2]International Standard.Biological evaluation of medical devices-Part 5:Tests for in vitro cytotoxicity:ISO 10993-5-2009[S].Switzerland:International Organization for Standardization,2009.
[3]International Standard.Biological evaluation of medical deviceslogical evaluation genotoxicity, carcinogenicity and reproductive toxicity:ISO 10993.3-2014[S].Switzerland:International Organization for Standardization,2014.
[4]OECD 490 In Vitro Mammalian Cell Gene Mutation Tests Using the Thymidine Kinase Gene[S].United Sates Environmental Protection Agency,2016.
[5]周莹,王丽洁,杜晟威,等.医疗器械生物学评价与质量管理[J].中国医疗器械信息,2018(19):17-19.
[6]刘林玲,张波,宋艳婷,等.二甲硅油片在结肠镜检查肠道准备中的应用[J].医学信息,2018,31(21):115-117.
[7]豆甲泰,李胜文,高雪晶.多效胃镜乳剂的制备及临床应用[J].黑龙江医学,2014,38(12):1384.
[8]吴志民,崔宏力,刘国辉,等.透明质酸钠羧甲基纤维素预防术后腹膜粘连的最佳剂量筛选及机制研究:随机对照实验方案[J].中国组织工程研究,2016,20(3):418-422.
[9]黄振光,李晓敏,张宏亮.肠镜润滑剂的研究进展[J].中华消化内镜杂志,2015,32(8):578-580.
[10]曾冬明,侯丽,施燕平.医疗器械遗传毒性评价方法的应用现状及研究进展[J].中国医疗器械杂志,2012,36(5):362-364.
[11]高梅,曹冲,英永,等.不同诱导方法制备大鼠肝微粒體酶及其活性的比较[J].癌变·畸变·突变,2016,28(4):269-272.
收稿日期:2019-5-28;修回日期:2019-6-24
编辑/杨倩
