间充质干细胞传递线粒体对肺微血管内皮细胞的修复作用
2019-09-25罗靖莹黄玮玮黄晓波
罗靖莹,郭 阳,黄玮玮,黄晓波
0 引 言
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是严重威胁重患者生命的临床常见疾病。ARDS是重症医学科中导致患者死亡的主要原因[1],其病死率仍高达30%~40%[2]。肺微血管内皮细胞是ARDS失控炎症反应的受害者,也是启动者。因为缺乏组蛋白的保护,线粒体DNA很容易受到损伤。在内皮细胞中,内毒素、炎症因子和氧化应激物都能使线粒体膜的钙泵失活[3-4],因此对受损线粒体的修复至关重要。细胞移植为很多危重症疾病的治疗提供了可能,MSC是成体干细胞的一种,具有高度自我更新能力和多向分化潜能,是理想的外源性修复种子细胞来源[5]。已有大量文献研究证实MSC可以有效减轻肺损伤[6],外源性MSC可以通过直接与损伤细胞融合或者通过旁分泌机制参与肺损伤免疫炎症反应调控[7],线粒体可以通过MSC的纳米管或者微泡进行细胞间的转移[8]。因此我们推测MSC主要是通过转移有活性的线粒体来促进损伤肺微血管内皮细胞的修复,从而发挥减轻肺损伤作用的。本研究主要通过寡霉素抑制线粒体功能,以此来探究线粒体对ARDS肺微血管内皮细胞损伤的修复作用。
1 材料与方法
1.1 主要仪器和试剂小鼠骨髓来源的间充质干细胞(mesenchymal stem cell,MSCs)、小鼠肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVECs)(Sciencell公司),DMEM/F12培养基、胎牛血清(Gibco公司);抗CYP1A1、CYP1A2、eNOS、iNOS、VE-cadherin,β-actin(R&D 公司),Goat anti-rabbit IgG-HRP、Goat anti-mouse IgG-HRP(Abcam 公司),Mito-tracker Red、Mito-tracker green(Thermofisher公司),活性氧试剂盒、JC-1膜电位试剂盒(碧云天公司),FITC-dextran、dextran(seebio公司),共聚焦荧光显微镜(leica公司),细胞恒温培养箱(Thermo公司),离心机(Beckman公司),荧光酶标仪(Thermo公司),流式细胞仪(Beckman公司)。
1.2 方法
1.2.1 细胞培养MSCs和PMVECs均用含10%胎牛血清和5%双抗的DMEM完全培养基培养,置于5%CO2、37℃的恒温培养箱中。使用胶原酶包被的孔径为0.4µm的transwell小室建立共培养体系。
1.2.2 线粒体功能抑制向MSCs培养基中加入3µg/mL的寡霉素(oligomycin,oli)[9],在37 ℃下培养48 h,以此抑制线粒体的有氧呼吸,同时应向培养基内加入50µg/mL的尿苷和2.5 mmol/L的丙酮酸钠以此补充糖酵解所需的因子。48 h后用PBS洗涤3次后,得到线粒体功能抑制的MSC。
1.2.3 线粒体转移为直观评估MSCs向PMVECs转移线粒体,用200 nmol/L MitoTracker红色染料染PMVECs的线粒体20 min,mito-green绿色染料染MSC的线粒体,两者共培养24 h后,在共聚焦荧光显微镜下观察。
1.2.4 葡聚糖渗漏试验检测内皮细胞通透性测量内皮细胞的通透性时,Transwell小室上层加入1×104个PMVECs以及100µL 10 mg/mL相对分子质量40 000 FITC-dextran,下层加入5×104个MSCs以及等浓度的不含荧光的dextran。40 min后吸取双层小室顶层和底层液体各100µL,置于黑色不透光96孔板中,用荧光酶标仪测激发光波长490/485 nm,发射光波长525/530 nm,测量样品的荧光强度内皮细胞通透系数,公式如下[9]:
内皮细胞通透系数=[A]/t×1/A×v/[L]
其中[A]为下室荧光蛋白浓度,t为时间,以秒表示;A为滤过面积,以cm2表示;v为下室液体量;[L]为上室荧光蛋白浓度。
1.2.5 Western blot检测检测线粒体相关蛋白,内皮细胞的合成功能及连接功能相关蛋白。通过细胞裂解液分离提取得到蛋白,BCA蛋白定量后,通过SDS-PAGE凝胶分离蛋白质样品(40µg)并转移至PVDF膜。 使用抗CYP1A1、CYP2A2、eNOS、iNOS、VE-cadherin和β-action与5%脱脂奶粉在室温下封闭1 h。膜与一抗在4℃温育过夜后,用Tween洗膜10 min,并与二抗孵育2 h。通过化学发光(ECL)系统检测蛋白质的表达水平,β-actin作为内参。
1.2.6 活性氧检测使用碧云天活性氧检测试剂盒。向各组PMVECs中加入10µmol/L的DCFHDA,37℃培养箱中孵育20 min,无血清培养基洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA,收集细胞后用荧光分光光度计检测在488 nm/525 nm处的荧光强度。
1.2.7 线粒体膜电位(JC-1)检测使用碧云天线粒体膜电位检测试剂盒。取10~60万PMVECs,重悬于细胞培养液中,加入0.5 mL JC-1染色工作液,颠倒数次混匀。细胞培养箱中37℃孵育20 min。孵育结束后,600×g4℃离心3~4 min,沉淀细胞,用JC-1染色缓冲液(1×)洗涤2次,再用适量JC-1染色缓冲液(1×)重悬后,用荧光分光光度计检测单体(490/530)和聚合物(525/590)的荧光比值。
1.2.8 Annexin V-FITC/PI用不含EDTA的胰酶消化PMVECs后,300×g,4℃离心5 min收集细胞。用预冷的PBS洗涤细胞2次,每次均需300×g,4℃离心5 min。收集1~5×105细胞。吸弃PBS,加入100µL缓冲液(1×)重悬细胞。加入5µL Annexin V-FITC和10µL PI染色液,轻轻混匀。避光、室温反应10~15 min。加入400µL缓冲液(1×),混匀后放置于冰上,用流式细胞仪检测。
1.3 实验分组实验分为对照组、LPS组、MSC组和MSC-oli组。对照组:上层加入1×104个PMVEC以及完全培养基;LPS组:上层加入1×104个PMVEC以及含100 ng/mL的LPS的完全培养基;MSC组:上层加入 1×104个 LPS 干预的 PMVECs,下层加入 5×104个的MSCs,共培养24 h。 MSC-oli组:上层加入1×104个 LPS 预干预的 PMVECs,下层加入 5×104个寡霉素预处理的MSCs(MSC-oli),共培养24 h。
1.4 统计学分析用SPSS 20.0软件进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,数据符合正态分布且方差齐时,组间两两比较采用LSD检验,每个实验结果均重复3次,以P≤0.05为差异有统计学意义。
2 结 果
2.1 荧光染色将PMVEC中的线粒体用红色荧光预染,与MSC、MSC-oli的线粒体用绿色荧光预染,分别染色后共培养后,两组共在共聚焦显微镜下均可观察到PMVECs中存在绿色荧光MSC及MSC-oli的线粒体均可以向PMVECs转移,说明MSC、MSC-oli的线粒体均可向PMVECs中转移,且在共聚焦显微镜下直观可见但MSC组较MSC-oli组向PMVECs中转移了更多的线粒体,见图1。

图1 共聚焦镜下观察线粒体转移Figure 1 The transmission of mitochondria under confocal microscopy
2.2 线粒体蛋白含量Western blot检测显示,与对照组比较,LPS组、MSC-oli组CYP1A1和CYP1A2蛋白表达均降低(P<0.05);与LPS组比较,MSC组CYP1A1和 CYP1A2表达增加(P<0.05);MSC组CYP1A1和 CYP1A2表达较 MSC-oli组增加(P<0.05)。见图2。
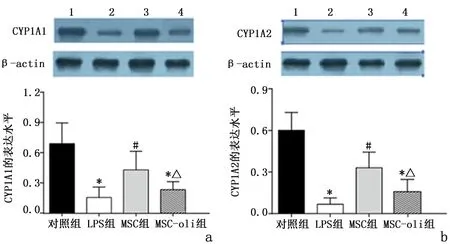
图2 线粒体相关蛋白CYP1A1和CYP1A2的表达Figure 2 The expression of mitochondrial related proteinCYP1A1 and CYP1A2
2.3 内皮细胞合成功能LPS组较对照组iNOS的表达明显增加,而eNOS明显减少(P<0.05)。MSC组较LPS组iNOS的表达水平明显下降(P<0.05),eNOS表达水明显增加(P<0.05)。MSC-oli组较MSC组iNOS表达明显增加,eNOS表达明显降低(P<0.05),见表1。
2.4 内皮细胞间连接与对照组比较,LPS组中VE-cadherin的表达降低(P<0.05),MSC组、MSC-oli组差异无统计学意义(P>0.05),见表1。
2.5 内皮细胞通透性葡聚糖渗漏实验检测PMVECs通透性结果显示,在LPS刺激PMVECs损伤后,内皮细胞的通透性明显升高(P<0.05)。MSC组较 LPS组通透性明显降低(P<0.05)。MSC-oli组较 MSC组通透性明显增高(P<0.05),但 较 LPS组 差 异 无 统 计 学 意 义(P>0.05)。见表1。
2.6 细胞凋亡与对照组比较,LPS组细胞凋亡率显著升高(P<0.05);MSC组凋亡率较LPS组明显下降(P<0.05),MSC-oli组凋亡率较MSC组明显升高(P<0.05)。见表 1,图 3。此外,LPS组的PVMECs膜电位较对照组明显降低(P<0.05);MSC组的膜电位较LPS组明显升高(P<0.05);MSC-oli组的线粒体膜电位较MSC组显著降低(P<0.05)。见表1。
表1 各组间内皮细胞相关功能的比较(±s)Table 1 The function of PMVECs in different groups(± s)

表1 各组间内皮细胞相关功能的比较(±s)Table 1 The function of PMVECs in different groups(± s)
与对照组比,*P<0.05;与LPS组比,#P<0.05;与MSC组比,△P<0.05
组别对照组LPS组MSC组MSC-oli组n 3 3 3 3 iNOS 0.13±0.03 0.45±0.08*0.20±0.05#0.43±0.04*△eNOS 0.67±0.14 0.10±0.08*0.53±0.07#0.17±0.04*△VE-cadherin 0.42±0.13 0.15±0.04*0.26±0.09 0.24±0.07通透性指数1 2.74±0.45*1.34±0.23#2.34±0.56*△凋亡率(%)2.33±1.23 23.67±1.45*11.89±2.38*#20.45±2.89*△JC-1 0.11±0.03 0.24±0.02*0.15±0.03#0.23±0.03*△

图3PMVECs细胞凋亡图Figure 3 apoptosis of PMVECs
3 讨 论
ARDS是临床上常见的疾病,其主要以顽固性的低氧血症和肺水肿为主要临床表现,目前治疗措施主要以肺保护性通气、限制液体、俯卧位通气、ECMO等手段为主[1],但病死率仍很高。内皮细胞是血管内表面的单层结构(细胞表面积约1350µm2),当炎症、肿瘤、动脉粥样硬化等发生时,内皮细胞的屏障功能会受到严重的影响,炎症因子(如组胺、缓激肽、血小板活化因子等)会增加毛细血管的通透性,使血浆蛋白等进入肺泡,这也是ARDS最重要的发病机制[11]。我们使用MSC通常来源于骨髓、脂肪、胎盘等组织,是组织工程和再生医学中最常用的细胞,很多文献都分析了MSCs对ARDS等肺疾病的治疗作用[12],MSC主要是通过其表面的趋化因子、细胞黏附分子和细胞因子共同介导的归巢作用[13],分化为肺内细胞[14],调节炎症反应,抑制免疫功能等进行肺保护[15],主要机制包括细胞植入、传导细胞信号以及转移健康的细胞器[16]。线粒体作为细胞内重要的细胞器,主要作用是通过氧化磷酸化产生能量,在很多急、慢性疾病中都能发现了其功能发生障碍。Spees等[17]首次发现MSC可以向受损的A549细胞转移mtDNA。在最新的研究中,Newell等[18]发现MSCs可以对宿主组织中线粒体的形态和功能产生特异性的影响,他们将MSC与患有线粒体疾病患者的成纤维细胞共培养,发现线粒体从分裂状态变为融合状态,说明MSC具有调节病理性线粒体的能力。在一个急性肺损伤的模型中,MSC可以向上皮细胞中转移线粒体,同时促进ATP和肺泡表面活性物质的产生[19]。Sinclair等[8]证实从骨髓、实质肺组织及肺泡灌洗液中分离的MSCs可以向支气管上皮细胞转移线粒体。
目前尚无实验研究MSC通过转移线粒体对肺微血管内皮细胞的直接修复作用。在本研究中,我们通过LPS对PMVEC预处理构建内皮细胞损伤模型,LPS是革兰阴性菌外膜的主要成分,可通过sCD14和TLR4受体介导产生局部和全身炎症反应[20-21]。然后通过向培养基中加入ATP酶抑制剂寡霉素,使其对呼吸链产生影响来抑制线粒体的功能[10],结果显示 MSC、MSC-oli与受损 PMVECs共培养后,MSC-oli组仍可以向PMVECs传递线粒体,但不能显著增加内皮细胞中线粒体相关蛋白的表达,这说明MSC可能通过微泡或者纳米管等途径传递失活的线粒体[22]。进一步我们通过共培养体系研究MSC的线粒体对间充质干细胞修复肺微血管内皮细胞的影响,结果显示,MSC组可显著提高受损内皮细胞合成蛋白的表达,降低细胞通透性,减轻细胞凋亡,而MSC-oli组的结果恰恰相反。此外,MSC及MSC-oli组中,内皮细胞的连接蛋白的表达无统计学差异。
综上所述,本研究初步探讨和研究的得出了MSCs可以向受损PMVECs传递线粒体,且能够修复受损的内皮细胞,但目前仍存在很多的不足,后续需要更多的基础和临床试验来进一步验证能量工厂线粒体对受损器官和组织的修复作用。
