放大内镜结合窄带成像与智能分光比色技术在消化道早期癌变诊断中的应用价值
2019-09-25王中良许贺春
王中良,许贺春,白 洁
(1.焦作煤业集团有限责任公司中央医院消化内科内镜室,河南 焦作 454000;2.焦作煤业集团有限责任公司中央医院检验科,河南 焦作 454000)
近年来,随着人口老龄化加剧,消化道肿瘤发病呈上升趋势。消化道肿瘤早期症状不明显,早期诊断困难[1],因此,提高消化道癌早期或者癌变前期的诊断效果仍是当前关注的重点。随着内镜技术的发展,内镜已逐渐应用于消化道肿瘤的诊断与治疗[2]。有研究显示,放大内镜结合窄带成像技术(magnifying endoscopy with narrow-band imaging,ME-NBI)、放大内镜结合智能分光比色技术(magnifying endoscopy with fuji intelligent chromoendoscopy,ME-FICE)对早期胃癌、食管癌、结直肠癌等消化道肿瘤具有良好的诊断效能[3]。基于此,本研究以337例消化道恶性肿瘤患者为研究对象,探讨ME-NBI与ME-FICE对早期消化道癌的诊断价值。
1 资料与方法
1.1 一般资料选择2016年6月至2018年7月焦作煤业集团有限责任公司中央医院收治的337例疑似早期消化道癌患者为研究对象,均经胃镜和病理组织学检查,其中175例行ME-NBI检查(ME-NBI组),162例行ME-FICE检查(FICE组)。ME-NBI组:男118例,女57例;年龄34~76(54.23±8.92)岁。FICE组:男113例,女49例;年龄37~73(53.12±8.23)岁。本研究获得医学伦理委员会批准,所有患者签署知情同意书。
1.2 检查方法
1.2.1 ME-NBI检查患者空腹,常规麻醉,白光内镜进镜(食管癌、胃癌进镜至十二指肠降段,大肠癌进镜盲部),退镜,在白光模式下观察,发现异常病变部位后使用配制液清洗(5 g NaHCO3和20 mL二甲硅油溶于500 mL生理盐水),然后收集清晰病灶白光画面,对病灶常规观察后放大观察,先行NBI观察,再于ME-NBI模式下观察病灶表面血管微细结构,然后染色(食管采用Lugol液染色,胃和大肠采用靛胭脂染色),并最终获取常规图像、放大和NBI图像、放大和染色图像,并在病变处及边缘不同部位取组织进行活检。
1.2.2 ME-FICE检查患者空腹,常规麻醉,常规白光内镜进镜(食管癌、胃癌进镜至十二指肠降段,大肠癌进镜盲部),逐渐退镜并观察黏膜异常情况,若发现黏膜异常病灶并暴露,放大内镜观察病变部位,保持视野固定,并切换至FICF模式,观察黏膜表面细微结构,然后切换至FICE模式,并采用预设的红、绿、蓝3种基色波长组合观察病变部位,并详细记录病变范围、部位及数量,病变处注入脱漆水,插入超声微探头,并检查浸润深度,病变部位靶向活检后图像存档。
1.3 判定标准早期胃癌依据VS分类系统[4],符合不规则的表面微结构/不规则的微血管和明显的分界线即可诊断。早期食管癌依据上皮乳头内毛细血管袢(intraepithelial papillary capillary loop,IPCL)分型标准,IPCL出现扩张、扭曲、管径粗细不匀、形态不规则4种改变,且可能出现IPCL延长、高度破坏及新生肿瘤血管时即可诊断[5]。早期大肠癌参照工藤Pit pattern腺管分型法,以Ⅴ1、ⅤN型为大肠癌,表现为开口大小不同、排列不规则,或开口消失/无结构[6]。
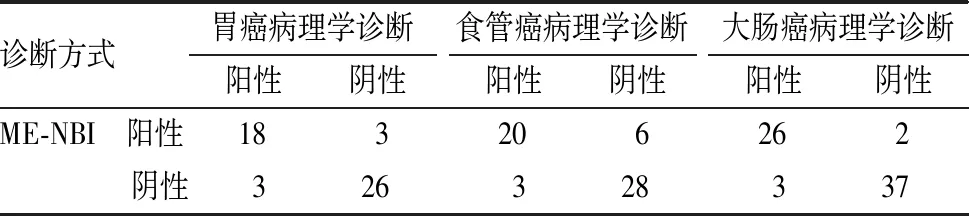
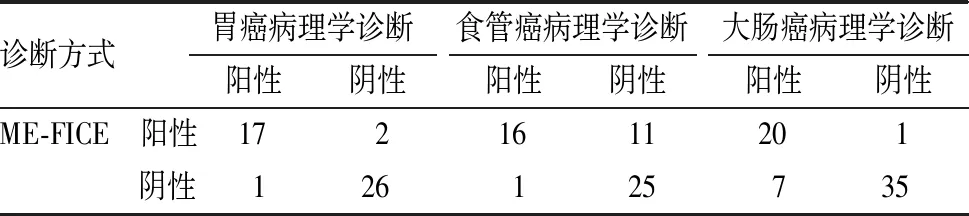
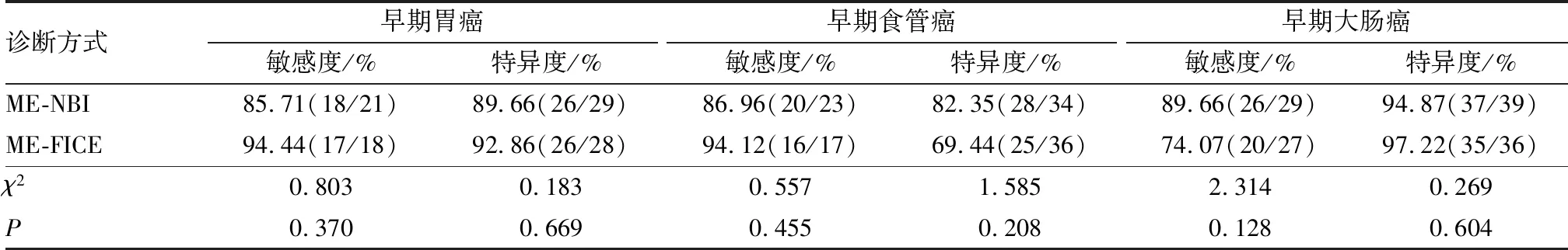
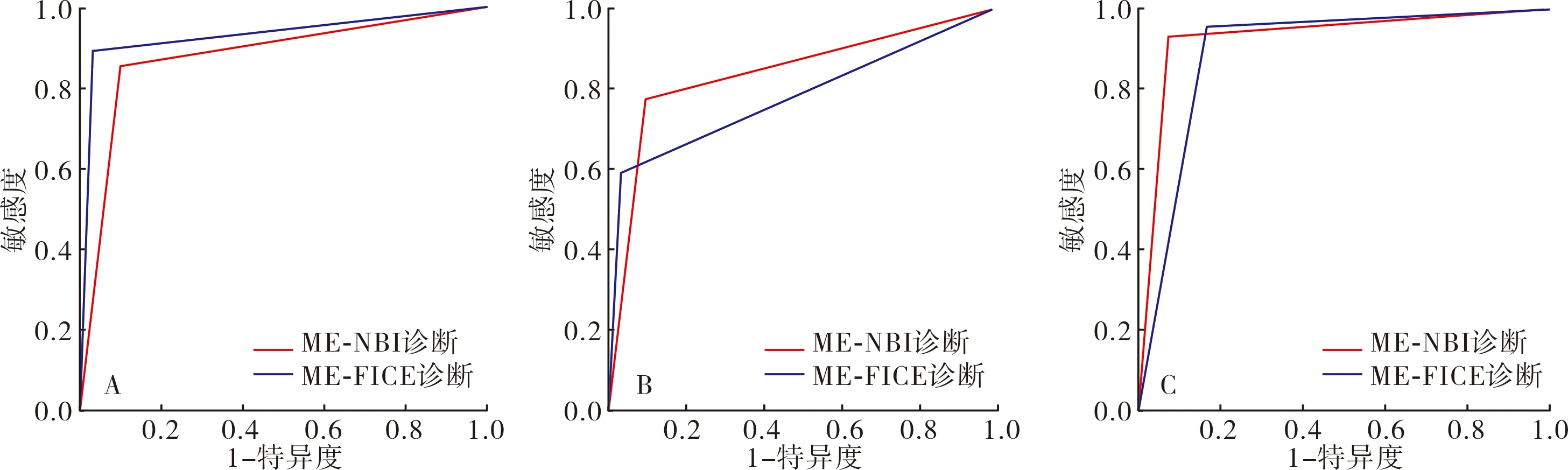
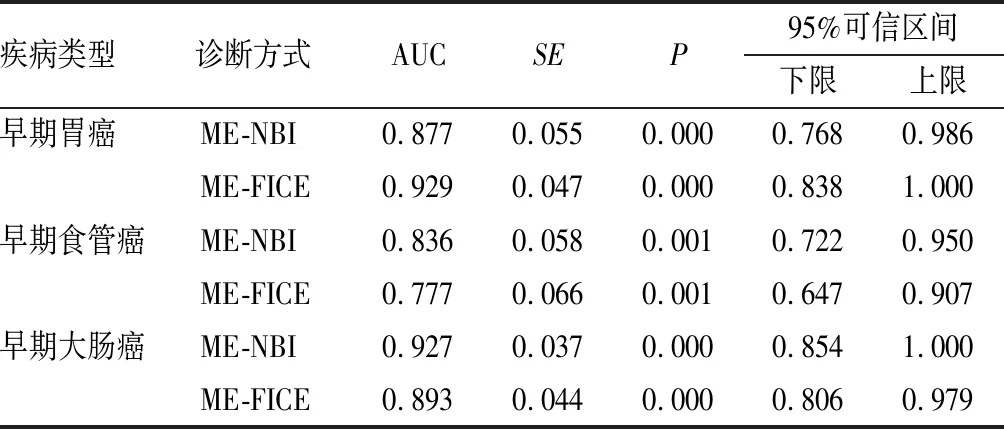
1.4 观察指标(1)以组织病理学检查结果为金标准,观察2种诊断方法与病理学诊断结果的一致性,Kappa值≥0.75为一致性好,0.4≤Kappa值<0.75为一致性一般,Kappa值<0.4为一致性较差。(2)观察2种诊断方法的准确度、敏感度和特异度,并采用受试者操作特征(receiver operator characteristic,ROC)曲线分析诊断效能,ROC曲线下面积(area under curve,AUC)≥0.9为诊断效能好,0.7≤AUC<0.9为诊断效能较好,0.5 1.5 统计学处理应用SPSS 22.0软件进行数据处理,计数资料以百分率表示,采用χ2检验,P<0.05为差异有统计学意义。 2.1 ME-NBI诊断结果与病理学诊断结果比较结果见表1。以病理学诊断结果为金标准,ME-NBI诊断早期胃癌、食管癌、大肠癌的符合率分别为88.00%(44/50)、84.21%(48/57)、92.65%(63/68),Kappa值分别为0.754、0.679、0.849,ME-NBI对早期胃癌、大肠癌的诊断与病理学诊断结果一致性较高。 2.2 放大内镜FICE诊断结果与病理学诊断结果比较结果见表2。以病理学诊断结果为金标准,ME-FICE诊断早期胃癌、食管癌、大肠癌的符合率分别为93.48%(43/46)、77.36%(41/53)、87.30%(55/63),Kappa值分别为0.864、0.550、0.733,ME-FICE对早期胃癌的诊断与病理学诊断结果一致性较高。 表1 ME-NBI诊断结果与病理学诊断结果比较 表2 ME-FICE诊断结果与病理学诊断结果比较 2.3 ME-NBI与ME-FICE诊断早期胃癌、食管癌、大肠癌的敏感度及特异度比较结果见表3。ME-NBI与ME-FICE诊断早期胃癌、食管癌、大肠癌的敏感度及特异度比较差异无统计学意义(P>0.05)。 表3 ME-NBI与ME-FICE诊断早期胃癌、食管癌、大肠癌的敏感度及特异度比较 2.4 ME-NBI与ME-FICE对早期胃癌、食管癌、大肠癌的诊断效能ME-NBI与ME-FICE诊断早期胃癌、食管癌、大肠癌的ROC曲线见图1。ME-NBI诊断早期胃癌、食管癌、大肠癌的AUC分别为0.877、0.836、0.927,ME-FICE诊断早期胃癌、食管癌、大肠癌的AUC分别为0.929、0.777、0.893;结果见表4。 A:胃癌;B:食管癌;C:大肠癌。 表4 ME-NBI与ME-FICE对早期胃癌、食管癌、大肠癌的诊断效能 近年来,我国恶性肿瘤发病率呈上升趋势,且癌谱正由发展中国家向发达国家的高发癌谱发展[7],而在新发癌谱中,与消化系统相关的恶性肿瘤占所有新发类型恶性肿瘤的50%以上[8],且胃癌、食管癌、大肠癌的发病率、死亡率均居恶性肿瘤前10位,因此,提高消化道癌患者的生存率具有重大意义。消化道癌以尽早手术为最佳治疗方案,但消化道癌早期症状不典型,且缺乏特异性生化因子,容易被忽视,多数患者确诊时已属中晚期,错过了最佳治疗时期[9]。因此,临床需重视对消化道早期癌变的诊断。穿刺活组织病理学检查仍是诊断消化道早期癌变的“金标准”,但该诊断方式有创伤性,且常因选取组织不典型而需要反复检查,给患者身心带来不良影响,降低患者接受治疗的依从性,增加患者经济负担。 影像学可提供较多的疾病信息,帮助临床医师制定更为详细的干预计划。消化道癌在发生微小病变和早期癌变时,其黏膜形态、腺管开口形态及微血管形态等多出现异常变化,因此,可通过观察可疑部位形态、规则等帮助临床医师诊断[10]。NBI、FICE均属电子染色内镜,但2种图像作用机制有所不同。NBI是利用滤光片过滤掉红光成分,保留蓝光、绿光成分,从而避免传统内镜使用红、蓝、绿三色光旋转滤光盘时因光的散射引起的图片锐度降低,而蓝、绿光的保留则提高病变部位和正常部位表面细微血管成像的清晰度[11]。FICE是利用光谱分析将普通内镜图像经处理、分析而产生的特定波长分光图像,这种分光图像可通过光谱学、电子分光学重新组合,从而生成多种频谱图像,并可根据这种图像辨别黏膜病变程度[12]。ME-NBI应用于早期胃癌诊断中,可对淡蓝色的嵴样结构进行观察(即胃肠黏膜上皮化生阶段),有研究指出,ME-NBI诊断早期胃癌的特异度、敏感度达90%以上[13]。ME-FICE因对黏膜微细凹凸形态变化敏感,从而提高常规内镜下不易发现的平坦型病变,且在诊断复杂胃食管反流病中具有较高的准确性[14]。IPCL是早期食管癌的重要观察指征[15],ME-NBI观察时,其正常组织呈现淡青色,而病灶为茶色改变,且能较精准地观察到病灶及腺管开口类型。ME-FICE参照ME-NBI下分类标准进行观察,其界限清晰,但病变部位血管杂乱、扭曲,实际操作中对IPCL的分型较难观察[16],可能导致临床漏诊。本研究结果显示,ME-NBI对早期胃癌、大肠癌的诊断与病理学诊断结果一致性较高,ME-FICE对早期胃癌的诊断与病理学诊断结果一致性较高;ME-NBI与ME-FICE诊断早期胃癌、食管癌、大肠癌的敏感度及特异度比较差异无统计学意义;ME-NBI诊断早期胃癌、食管癌、大肠癌的AUC分别为0.877、0.836、0.927,ME-FICE诊断早期胃癌、食管癌、大肠癌的AUC分别为0.929、0.777、0.893。 综上所述,ME-NBI及ME-FICE均可显著提高早期胃癌、食管癌、大肠癌等消化道早期癌变的诊断准确率,ME-NBI更适用于大肠癌、食管癌的诊断,ME-FICE更适用于胃癌的诊断,因此,临床应用中需根据具体情况选择诊断手段。此外,本研究样本量较小,结果可能有所偏差,尚有待于进一步大样本研究。2 结果
3 讨论
