肝细胞癌中microRNA-1469表达及其对肝癌细胞生物学行为的影响
2019-09-25王宇锋朱怡凤殷国志
王宇锋,朱怡凤,殷国志
(西安交通大学第一附属医院肝胆外科,陕西 西安 710061)
我国肝癌发病率较高,其中约90%为肝细胞癌(hepatocellular carcinoma,HCC),严重影响患者的身心健康[1-2]。目前,HCC的诊断与治疗水平已经有了大幅提升,但HCC患者的整体预后仍然较差,手术仍是首选治疗方式[1,3-6]。近年来,肿瘤靶向治疗为HCC患者带来了新的曙光,microRNA是研究较多且较为深入的一类靶点[7-14]。MicroRNA是一类长度18~25个核苷酸序列的非编码单链小分子RNA,其异常表达与肿瘤的发生、发展及患者预后有密切关系[15-17]。研究发现,microRNA-1469(miR-1469)与肿瘤密切相关,在食管鳞状细胞癌、肺癌及胃癌等多种恶性肿瘤中异常表达,可作为癌基因或抑癌基因参与调控肿瘤细胞的增殖、凋亡等多种生物学行为,且与肿瘤患者的预后密切相关[18-20]。目前,miR-1469在HCC中的表达及其对HCC细胞增殖、细胞活力、细胞周期、细胞侵袭和迁移等的影响鲜有报道。本研究旨在探讨miR-1469表达与HCC患者临床病理特征、预后的关系及其对肝癌细胞生物学行为的影响。
1 材料与方法
1.1 标本来源选取2010年1月至2012年12月西安交通大学第一附属医院肝胆外科手术切除的HCC组织和对应的癌旁组织(距肿瘤边缘>2 cm)标本各76例,男66例,女10例,年龄30~75岁,中位年龄49岁。所有患者术前未接受放射治疗、化学治疗及其他辅助治疗,术后经病理学检查确诊为HCC。HCC组织和癌旁组织经甲醛固定,石蜡包埋保存。所有患者术后随访36个月。本研究获得西安交通大学第一附属医院伦理委员会审核批准,患者均签署知情同意书。
1.2 细胞、试剂与仪器人正常肝细胞(LO2)及肝癌细胞HepG2、Hep3B、SMMC-7721、Huh7、Bel-7402均购自中国科学院上海细胞库;胎牛血清和达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)购自美国Gibco公司,TRIzol试剂购自美国Thermo Fisher Scientific公司,miRNA反转录试剂盒(All-in-OneTMmiRNA First-Strand cDNA Synthesis Kit)、miRNA定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒(All-in-OneTMmiRNA qPCR Kit)、miR-1469特异性引物、miRNA 内参U6引物、miR-1469过表达类似物(miR-1469 mimics)、miR-1469过表达类似物的阴性对照均购自美国Gene Copoeia公司,细胞计数试剂盒-8、流式细胞周期检测试剂盒均购自南京凯基生物科技股份有限公司,兔抗人NDRG1单克隆抗体、兔抗人β-actin多克隆抗体购自美国Abcam公司,二喹啉甲酸蛋白定量试剂盒购自上海碧云天生物技术有限公司,增强化学发光(enhanced chemiluminescence,ECL)试剂盒购自美国Milipore公司;实时荧光定量PCR仪(CFX96)、全自动凝胶电泳分析系统(170-8265)购自美国Bio-rad公司,Transwell小室购自美国Corning公司,倒置相差显微镜购自上海绘统光学仪器有限公司,流式细胞仪(FACSCanto II)购自美国BD公司。
1.3 实验方法
1.3.1 实时荧光定量PCR检测HCC组织、癌旁组织以及LO2、HepG2、Hep3B、SMMC-7721、Huh7、Bel-7402细胞中miR-1469的表达应用TRIzol提取RNA技术按照TRIzol试剂说明书步骤提取收集HCC组织、癌旁组织和LO2、HepG2、Hep3B、SMMC-7721、Huh7、Bel-7402细胞中的总RNA,当RNA样品的核酸在260 nm处的吸光度值与蛋白质在280 nm处的吸光度值的比值在1.8~2.0时,样品合格。按照miRNA反转录试剂盒说明书对RNA样品进行反转录。20 μL反转录体系:总RNA 4 μL,Reaction Mix(5×)1 μg,SuperScript Enzyme Mix(10×)2 μL,然后加入焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水补足至20 μL,混匀,离心。反应条件:37 ℃ 60 min,95 ℃ 5 min,然后置于4 ℃冰箱保存备用。依照miRNA实时荧光定量PCR试剂盒说明书进行操作。20 μL反应体系:EXPRESS SYBR Green ERTM qPCR Super Mix 10 μL,10 μmol·L-1miR-1469特异性引物或内参U6引物0.4 μL,10 μmol·L-1通用qPCR引物0.4 μL,荧光定量PCR参比染料 0.04 μL,cDNA 2 μL,DEPC处理水7.16 μL,混匀,离心。每个样本均做3个复孔。反应条件:50 ℃预孵育2 min,95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火延伸1 min,扩增40个循环。60 ℃延伸时采集荧光信号,反应结束后直接得到样本的域值循环数,应用2-△△CT法处理数据。小核RNA U6为内参。每个独立实验重复3次。引物序列:miR-1469上游引物序列为5′-ACACTCCAGCTGGGCTCGGCGCGGGGCGCG-3′,下游引物序列为5′-CTCAACTGGTGTCGTGGAGTCGG-CAATTCAGTTGAGGGAGCCCG-3′;U6上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列5′-AACGCTTCACGAATTTGCGT-3′。
1.3.2 细胞培养及Hep3B和SMMC-7721细胞转染将Hep3B和SMMC-7721细胞置于含体积分数10%胎牛血清、100 kU·L-1青霉素和100 mg·L-1链霉素的DMEM中,于37 ℃、含体积分数5%CO2的培养箱内培养。取对数生长期的Hep3B或SMMC-7721细胞,胰蛋白酶消化、离心、重悬、计数,接种于6孔板(每孔1.5×105个细胞)中继续培养,待细胞融合度达70%时将Hep3B细胞分为miR-1469 mimics组和miR-1469 control mimics组,利用Lipofectamine 2000转染试剂盒将miR-1469 mimics和对应的阴性对照转染至miR-1469 mimics组和miR-1469 control mimics组Hep3B细胞;将SMMC-7721细胞分为miR-1469 inhibitors组和miR-1469 control inhibitors组,利用Lipofectamine 2000转染试剂盒将miR-1469 inhibitors(anti-miR-1469)和对应的阴性对照转染至的miR-1469 inhibitors组和miR-1469 control inhibitors组SMMC-7721细胞。转染后继续培养48 h,然后进行后续实验。
1.3.3 实时荧光定量PCR检测转染后Hep3B和SMMC-7721细胞中miR-1469表达Hep3B和SMMC-7721细胞转染48 h后应用TRIzol提取细胞总RNA,采用紫外分光光度计测定其纯度及浓度,确保RNA样品的核酸在260 nm处的吸光度值与蛋白质在280 nm处的吸光度值的比值在1.8~2.0,然后置于-80 ℃保存备用。应用miRNA反转录试剂盒将总RNA反转录为cDNA,20 μL反转录体系如下:总RNA 1 μg,Reaction Mix(5×)4 μL,Super Script Enzyme Mix(10×)2 μL,然后加入DEPC水补足至20 μL,混匀,离心。反应条件:37 ℃ 60 min,95 ℃ 5 min,然后置于4 ℃冰箱保存备用。依照miRNA实时荧光定量PCR试剂盒说明书进行操作。20 μL反应体系:EXPRESS SYBR Green ERTM qPCR Super Mix 10 μL,10 μmol·L-1miR-1469特异性引物或内参U6引物0.4 μL,10 μmol·L-1通用qPCR引物0.4 μL,荧光定量PCR参比染料 0.04 μL,cDNA 2 μL,DEPC处理水7.16 μL,混匀,离心。每个样本均做3个复孔。反应条件:50 ℃预孵育2 min,95 ℃预变性2 min,95 ℃变性15 s,60 ℃ 退火延伸1 min,扩增40个循环。60 ℃延伸时采集荧光信号,反应结束后直接得到样本的域值循环数,应用2-△△CT法处理数据。小核RNA U6为内参。每个独立实验重复3次。引物序列:miR-1469上游引物序列为5′-ACACTCCAGCTGGGCTCGGCGCG-GGGCGCG-3′,下游引物序列为5′-CTCAACTGG-TGTCGTGGAGTCGGCAATTCAGTTGAGGGAGCCCG-3′;U6上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列5′-AACGCTTCACGAATTTGCGT-3′。
1.3.4 四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)法检测转染后Hep3B和SMMC-7721细胞的增殖能力取各组转染后48 h的Hep3B和SMMC-7721细胞接种于96孔板,每孔1.5×104个细胞,每组设3个复孔,于培养24、48、72 h每孔加入20 μL MTT溶液,继续孵育4 h后每孔加入150 μL二甲基亚砜终止反应。在酶联免疫检测仪上读取490 nm处各孔的吸光度值,每组设3个复孔,取均值,并以时间为横坐标、抑制率为纵坐标绘制细胞生长曲线。
1.3.5 平板克隆形成实验检测转染后Hep3B和SMMC-7721细胞克隆能力取各组转染后48 h细胞,经消化、离心、重悬、计数后接种于6孔板中,每孔300个细胞,每组设3个复孔,轻轻摇晃培养板使细胞分散均匀。将培养板置于37 ℃、含体积分数5%CO2的培养箱中培养,当培养皿中出现肉眼可见的克隆时(约2周)终止培养,弃去培养液,使用磷酸盐缓冲液(phosphate buffered saline,PBS)小心冲洗3次,甲醇固定15 min;然后,应用结晶紫对细胞进行染色30 min,用流水缓慢漂洗去除染色液,自然风干。观察细胞克隆形成情况,50个细胞以上的细胞集落作为1个克隆,计算克隆形成数。
1.3.6 流式细胞术检测转染后Hep3B和SMMC-7721细胞周期细胞周期检测按照细胞周期试剂盒说明书步骤进行。取各组转染后48 h细胞,预冷的PBS洗涤、离心、重悬,将细胞加入预冷的体积分数70%乙醇中固定、4 ℃过夜。次日,离心后去除乙醇,PBS洗涤、重悬,加入核糖核酸酶(终质量浓度为100 mg·L-1),37 ℃水浴30 min,加入400 μL碘化丙啶(终质量浓度为50 mg·L-1),4 ℃避光染色 30 min,使用流式细胞仪检测细胞周期,细胞周期拟合软件分析数据。
1.3.7 Transwell实验检测转染后Hep3B和SMMC-7721细胞的侵袭与迁移能力取各组转染后48 h细胞,将细胞进行消化、离心,用无血清培养基进行重悬,调整细胞浓度为2×108L-1,取100 μL接种于Transwell上室(侵袭实验的上室平铺Matrigel胶,迁移实验的上室未铺Matrigel胶),下室加入700 μL含体积分数10%胎牛血清的培养基,置于培养箱中继续培养24 h后取出小室,用棉签拭掉上室内残留的细胞,40 g·L-1多聚甲醛固定,1 g·L-1结晶紫染色,显微镜下随机选取5个视野(×100)计数穿膜细胞数,实验重复3次,取均值。
1.3.8 Western blot法检测转染后Hep3B和SMMC-7721细胞中NDRG1蛋白表达取各组转染后48 h细胞,弃培养基,0.01 mol·L-1PBS冲洗3次,加入细胞裂解液充分裂解,15 000 r·min-1离心15 min后取上清液,二奎啉甲酸法测定总蛋白浓度。电泳前将蛋白样品按5:1比例加入6×上样缓冲液,煮沸5 min后即用120 g·L-1聚丙烯酰胺凝胶电泳。4 ℃条件下23 V电压湿转12 h。50 g·L-1脱脂奶粉(三乙醇胺缓冲盐水溶液溶解)室温封闭 1 h 后加入1:1 000稀释的NDRG1一抗及β-actin一抗,4 ℃孵育过夜,含Tween-20的三羟甲基氨基甲烷缓冲液漂洗6次,每次5 min,加入二抗(按 1:10 000 稀释),室温孵育1 h。Tween-20的三羟甲基氨基甲烷缓冲液漂洗6次,每次5 min。暗室内浸入ECL液显色,胶片曝光,洗片。利用ImageJ图像分析软件对各条带灰度值进行分析,获得细胞中NDRG1蛋白相对表达量。每个实验重复3次。
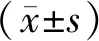
2 结果
2.1 HCC组织和癌旁组织中miR-1469的表达miR-1469在HCC组织和癌旁组织中的相对表达量分别为0.71±0.03、5.49±0.04,HCC组织中miR-1469相对表达量显著低于癌旁组织,差异有统计学意义(t=40.640,P<0.05)。
2.2 MiR-1469表达与HCC患者临床病理特征的关系结果见表1。根据76例HCC组织中miR-1469的平均表达水平(0.71±0.03),将高于平均表达水平的HCC患者纳入miR-1469高表达组(n=33),将低于平均表达水平的患者纳入miR-1469低表达组(n=43)。miR-1469表达与肿瘤直径、肿瘤数目、TNM分期、组织分化程度及微血管侵犯相关(P<0.05),与患者的年龄、性别、血清甲胎蛋白水平、静脉侵犯、Edmondson病理分级、肿瘤部位无相关性(P>0.05)。

表1 MiR-1469表达与HCC患者临床病理特征的关系
2.3 MiR-1469表达与HCC患者预后的关系结果见图1。Kaplan-Meier生存分析显示,miR-1469高表达HCC患者的3 a总体生存率显著高于低表达者(χ2=3.942,P<0.05)。
2.4 LO2、HepG2、Hep3B、SMMC-7721、Huh7、Bel-7402细胞中miR-1469表达miR-1469在LO2、HepG2、Hep3B、SMMC-7721、Huh7、Bel-7402细胞中的相对表达量分别为1.01±0.02、0.45±0.01、0.05±0.01、0.61±0.02、0.14±0.01、0.29±0.02;miR-1469在HepG2、Hep3B、SMMC-7721、Huh7、Bel-7402细胞中的相对表达量显著低于LO2细胞,差异均有统计学意义(t=20.370、38.490、12.320、31.650、24.840,P<0.05);其中Hep3B细胞中miR-1469表达量最低,SMMC-7721细胞中miR-1469表达量最高。
2.5 转染后Hep3B和SMMC-7721细胞中miR-1469表达miR-1469 mimics组和miR-1469 control mimics组Hep3B细胞中miR-1469相对表达量分别为4.47±0.15、0.05±0.01,miR-1469 mimics组Hep3B细胞中miR-1469相对表达量显著高于miR-1469 control mimics组,差异有统计学意义(t=30.320,P<0.05)。miR-1469 inhibitors组和miR-1469 control inhibitors组SMMC-7721细胞中miR-1469相对表达量分别为0.20±0.11、1.00±0.00,miR-1469 inhibitors组SMMC-7721细胞中miR-1469相对表达量显著低于miR-1469 control inhibitors组,差异有统计学意义(t=35.470,P<0.05)。
2.6 MiR-1469对Hep3B和SMMC-7721细胞增殖及克隆能力的影响结果见表2、表3和图2。培养24、48、72 h时,miR-1469 mimics组Hep3B细胞增殖能力显著低于miR-1469 control mimics组,miR-1469 inhibitors组SMMC-7721细胞增殖能力显著高于miR-1469 control inhibitors组,差异均有统计学意义(P<0.05)。miR-1469 mimics组和miR-1469 control mimics组Hep3B细胞的克隆数分别为17.00±1.73、65.67±2.33,miR-1469 mimics组Hep3B细胞克隆形成能力显著低于miR-1469 control mimics组,差异有统计学意义(t=16.750,P<0.05);miR-1469 inhibitors组和miR-1469 control inhibitors组SMMC-7721细胞的克隆数分别为93.00±2.08、27.67±1.45,miR-1469 inhibitors组SMMC-7721细胞的克隆形成能力显著高于miR-1469 control inhibitors组,差异有统计学意义(t=25.740,P<0.05)。
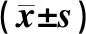
表2 过表达miR-1469对Hep3B细胞增殖能力的影响
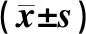
表3 下调miR-1469表达对SMMC-7721细胞增殖能力的影响
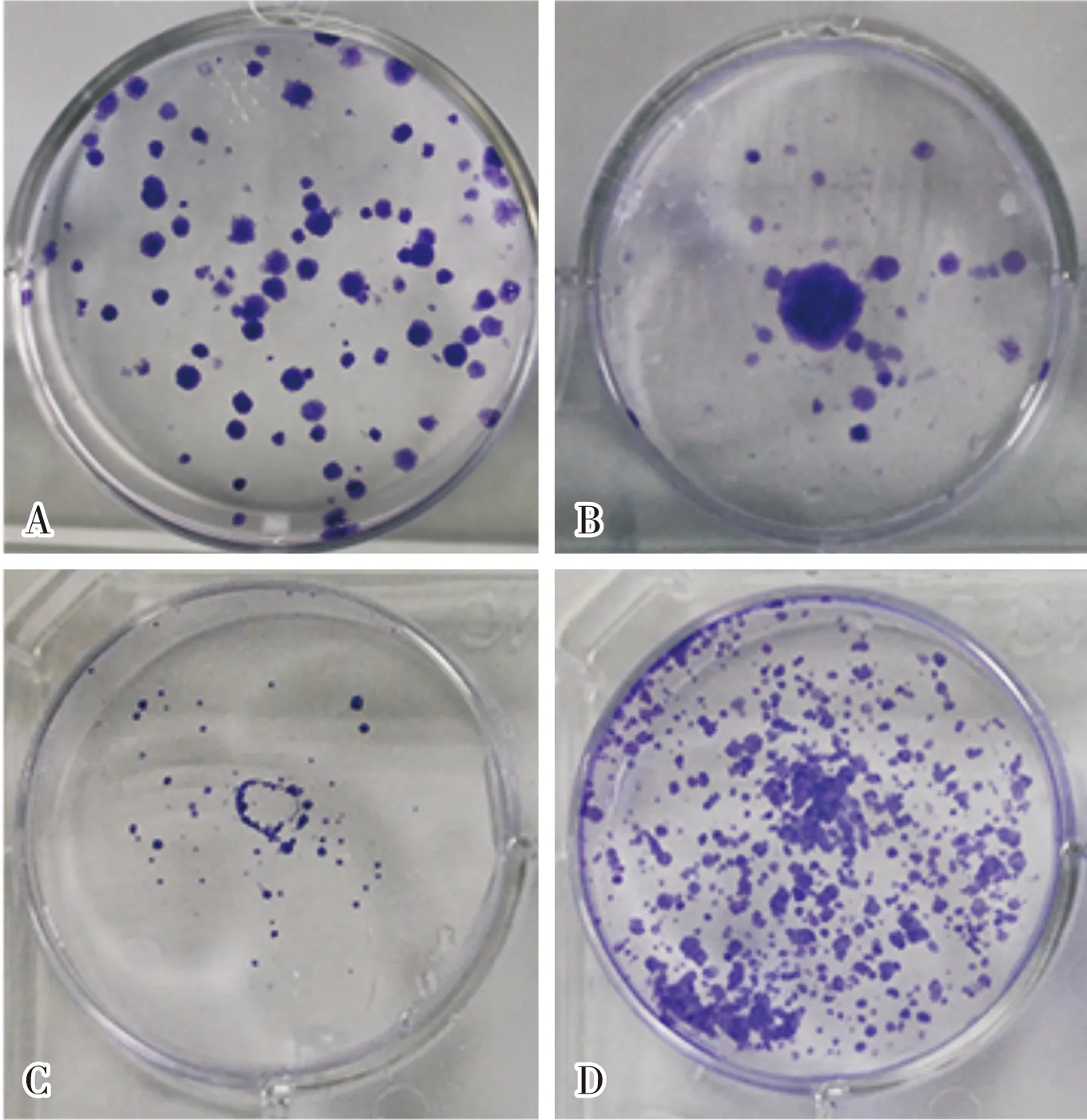
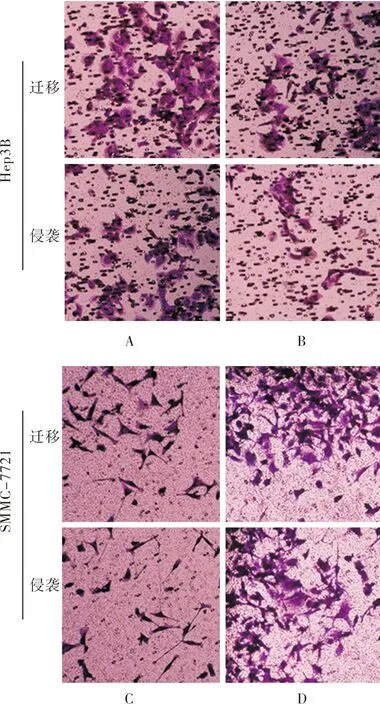
A:miR-1469 control mimics组;B:miR-1469 mimics组;C:miR-1469 control inhibitors组;D:miR-1469 inhibitors组。
2.7 MiR-1469对Hep3B和SMMC-7721细胞周期的影响结果见表4和表5。与miR-1469 control mimics组比较,miR-1469 mimics组G1期Hep3B细胞显著增多,S期Hep3B细胞显著减少,差异有统计学意义(t=20.200、23.480,P<0.05);但2组G2期细胞比例比较差异无统计学意义(t=0.633,P>0.05)。与miR-1469 control inhibitors组比较,miR-1469 inhibitors组G1期SMMC-7721细胞显著减少,S期SMMC-7721细胞显著增多,差异有统计学意义(t=4.413、6.379,P<0.05);但2组G2期SMMC-7721细胞比例比较差异无统计学意义(t=2.214,P>0.05)。
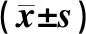
表4 过表达miR-1469对Hep3B细胞周期的影响
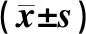
表5 MiR-1469表达下调对SMMC-7721细胞周期的影响
2.8 MiR-1469对Hep3B和SMMC-7721细胞迁移和侵袭能力的影响结果见图3。miR-1469 mimics组Hep3B细胞迁移数和侵袭数分别为59.00±2.08、29.00±2.08,miR-1469 control mimics组Hep3B细胞迁移数和侵袭数分别为35.00±1.53、20.33±1.45;miR-1469 mimics组Hep3B细胞的迁移和侵袭能力显著高于miR-1469 control mimics组,差异有统计学意义(t=9.295、3.414,P<0.05)。miR-1469 inhibitors组SMMC-7721细胞迁移数和侵袭数分别为26.00±1.16、17.33±0.88,miR-1469 control inhibitors组SMMC-7721细胞迁移数和侵袭数分别为56.33±3.18、44.67±1.45;miR-1469 inhibitors组SMMC-7721细胞的迁移和侵袭能力显著低于miR-1469 control inhibitors组,差异有统计学意义(t=8.966、16.080,P<0.05)。
2.9 miR-1469对Hep3B和SMMC-7721细胞中NDRG1蛋白表达的影响结果见图4。miR-1469 mimics组和miR-1469 control mimics组Hep3B细胞中NDRG1蛋白相对表达量分别为0.23±0.04、1.00±0.00,miR-1469 mimics组Hep3B细胞中NDRG1蛋白相对表达量显著低于miR-1469 control mimics组,差异有统计学意义(t=17.760,P<0.05);miR-1469 inhibitors组和miR-1469 control inhibitors组SMMC-7721细胞中NDRG1蛋白相对表达量分别为3.90±0.17、1.00±0.00,miR-1469 inhibitors组SMMC-7721细胞中NDRG1蛋白相对表达量显著高于miR-1469 control inhibitors组,差异有统计学意义(t=16.740,P<0.05)。
A:miR-1469 control mimics组;B:miR-1469 mimics组;C:miR-1469 control inhibitors组;D:miR-1469 inhibitors组。
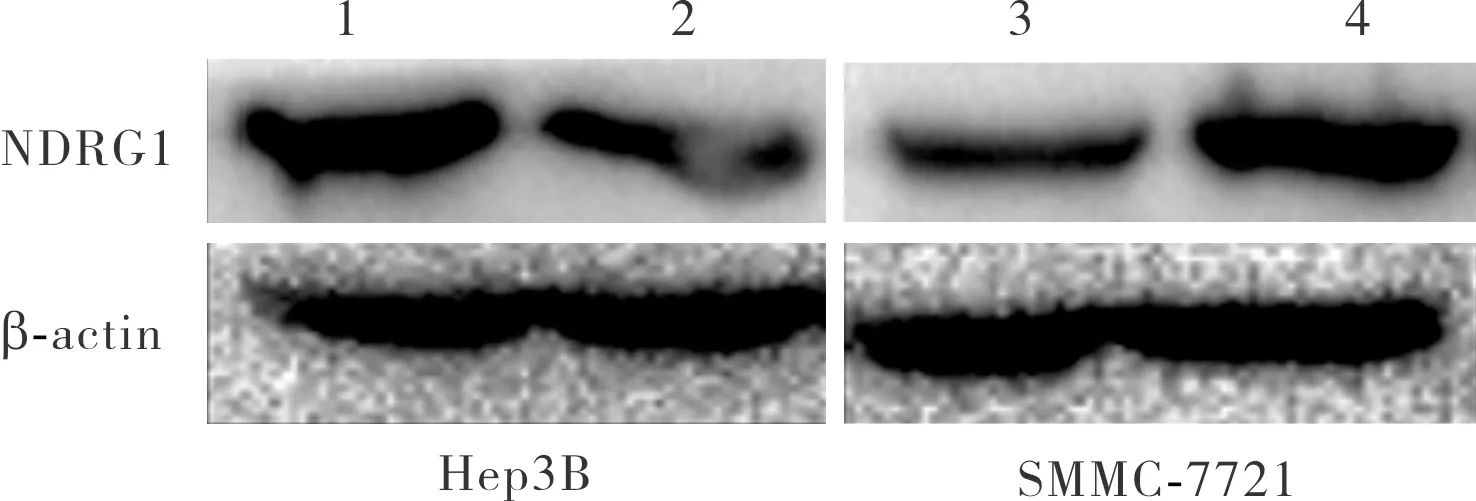
1:miR-1469 control mimics组;2:miR-1469 mimics组;3:miR-1469 control inhibitors组;4:miR-1469 inhibitors组。
3 讨论
HCC是原发性肝癌的主要组织学类型,是最常见的恶性肿瘤之一,具有较高的发病率和致死率,因此,提高HCC的诊断与治疗水平具有重要意义[21-23]。近年来,以microRNA为代表的靶点是研究热点之一[24-26]。MicroRNA主要通过与靶mRNA的3′端非编码区域(3′-untranslated region,3′-UTR)互补配对而在转录后水平对基因的表达进行负调控,导致mRNA降解或翻译抑制[17]。随着研究的不断深入,发现异常表达的microRNA与多种肿瘤的发生、发展密切相关。研究发现,miR-1469在食管鳞状细胞癌、肺癌及胃癌等多种恶性肿瘤中存在异常表达,可作为癌基因或抑癌基因参与调节肿瘤细胞的增殖、凋亡等多种生物学行为,且与肿瘤患者的预后密切相关,对判断肿瘤的恶性程度及患者预后具有一定的临床参考价值[18-20]。
本研究结果显示,miR-1469在HCC组织和细胞中的表达均显著下调,且与肿瘤直径、肿瘤数目、TNM分期、组织分化程度及微血管侵犯显著相关,miR-1469低表达HCC患者的3 a总体生存率显著低于高表达者;该结果提示,miR-1469可能是HCC的抑癌基因,对判断HCC的恶性程度及患者预后具有一定的临床参考价值。本研究结果显示,上调HCC细胞中miR-1469表达水平后,HCC细胞的活力、克隆形成能力、细胞周期及细胞侵袭、迁移能力均受到显著抑制;而下调HCC细胞中miR-1469表达水平后,上述生物学功能明显增强;该结果表明,miR-1469高表达可抑制HCC细胞的增殖能力,诱导肿瘤细胞的细胞周期阻滞,并抑制HCC细胞的侵袭、迁移能力;miR-1469为HCC的抑癌基因,可以通过抑制HCC细胞的增殖、细胞周期、侵袭及迁移而发挥其抗肿瘤作用。
为进一步探究miR-1469的作用机制,本研究应用生物信息学数据库(http://www.microrna.org/microrna/home;http://www.targetscan.org)预测miR-1469的下游靶点,发现NDRG1是上述数据库共同预测的靶点之一。NDRG1的3′-UTR具有与miR-1469结合的区域,已证实NDRG1为HCC的促癌基因。本研究结果显示,过表达Hep3B细胞中的miR-1469后,NDRG1的表达水平明显下调;而抑制SMMC-7721细胞中的miR-1469的表达后,NDRG1的表达水平显著上调;该结果提示,HCC细胞中的NDRG1可能为miR-1469的作用靶点。有研究表明,HCC细胞中过表达的NDRG1能够竞争性结合GSK-3β和Nur77,从而减少β-catenin的降解,进而激活Wnt/β-catenin通路[27]。笔者推测,HCC细胞中miR-1469能够通过靶向结合并降低NDRG1表达,从而促进β-catenin的降解,抑制Wnt/β-catenin通路,进而抑制HCC进展;但其具体作用机制有待进一步研究。
综上所述,miR-1469在HCC中表达下调,且与肿瘤数目、肿瘤直径、TNM分期、组织分化程度、微血管侵犯及患者预后密切相关;miR-1469可以通过靶向结合NDRG1并抑制其表达从而抑制HCC细胞的增殖、周期、侵袭和迁移。本研究为进一步了解HCC发生、发展的分子机制及寻找新的分子治疗靶点奠定了一定的基础。
