苜蓿根腐病生防真菌筛选鉴定及其防治效果研究
2019-09-25柴继宽赵桂琴李春杰刘文辉
曾 亮, 柴继宽, 赵桂琴, 李春杰, 刘文辉, 姚 拓*
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室, 甘肃省草业工程实验室,中-美草地畜牧业可持续研究中心, 甘肃 兰州 730070; 2.兰州大学草地农业科技学院, 甘肃 兰州 730020; 3.青海省畜牧兽医科学院, 青海 西宁 810016)
根腐病在苜蓿各主要种植区内均广泛发生,且其常造成苜蓿产量下降、品质降低及利用年限缩短等严重影响[1]。近年来,随着饲草产业结构的调整,苜蓿的种植面积和利用年限逐年增长,根腐病已开始成为影响苜蓿高产、优质、稳产的重要制约因素[2-3]。由于苜蓿根腐病通过土壤携菌传播,对其进行防治一直是该研究领域的难点,目前主要是依靠选育抗病品种、农业技术防治措施及喷施化学药剂加以控制[4-6],但在实际生产中缺乏真正有效的抗病品种,或者是该品种的抗病性极易丧失[7];一些农艺控制措施,如土壤消毒和作物轮作,可以达到一定的控制效果,但会增加生产成本,很难适应当今集约化和高效的农业种植模式需求。化学杀菌剂的过量应用不仅会引起诸如环境污染、食品药物残留以及增加经济成本等问题,还会诱发病原菌产生抗药性[8-10]。相比之下,生物防治除了能够控制病害、增加产量外,对于人类和动植物也安全无害;同时,生物防治的普遍应用可以减少环境污染,延缓病原菌抗药性的增强,间接产生一定的经济、生态和社会效益,符合可持续农业和环境友好型社会的发展趋势[11-14]。
目前对于苜蓿根腐病生物防治的研究和应用较少,仅有少量以芽孢杆菌[15-16]及生防放线菌[17]对其进行室内防效测定的报道,而对于其生防真菌的研究更属空白。因此,分离和筛选苜蓿根腐病生防菌株并对其防病效果进行研究,从而研发出相关生防制剂对苜蓿根腐病进行防治具有极其重要的现实意义。为了探索和发现苜蓿根腐病生物防治的微生物资源,本试验从苜蓿根际土壤中筛选鉴定出可以拮抗苜蓿根腐病病原菌的菌株,并进一步对其抑菌效果和盆栽防效进行研究,以期为今后生防菌肥的研发和应用提供菌种和科学依据。
1 材料与方法
1.1 供试材料
1.1.1供试土样 2018年6月,分别在敦煌、张掖、定西和固原等地采集苜蓿根腐病植株带土根系,装入无菌密封袋放入冰盒中并立即于实验室内分离纯化。该区气候干旱,日照充足,昼夜温差大(10~20℃),降水量少(40~200 mm/年)。
1.1.2供试病原菌株 供试苜蓿根腐病病原菌株4株,分别为苜蓿尖孢镰刀菌(Fusariumoxysporum)、燕麦镰刀菌(F.avenaceum)、腐皮镰刀菌(F.solani)、半裸镰刀菌(F.semitectum),均由甘肃农业大学草业学院保存。
1.1.3培养基 马铃薯葡萄糖琼脂培养基(Potato dextrose agar,PDA):马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 ml,用于菌株的分离及活化;马铃薯葡萄糖液体培养基(Potato dextrose broth,PDB):马铃薯200 g,葡萄糖20 g,蒸馏水1 000 ml,用于菌株的发酵[18]。
1.1.4供试苜蓿种子 供试苜蓿品种为甘农5号苜蓿,由甘肃农业大学草业学院提供。
1.2 试验方法
1.2.1生防真菌分离纯化 参照孙敬祖等的方法[19],在自封袋外轻轻拍打苜蓿根系使其表面附着的土壤落入袋内作为根际待测土样,称取土壤样品10.0 g倒入90 mL灭菌水锥形瓶内(瓶里放置小钢珠),室温下160 r·min-1震荡20 min充分摇匀,制得根际土壤悬液;再将自封袋内根系取出,用吸水纸吸后称取0.5 g,70%酒精溶液浸泡20 s,再放入1 g·L-1升汞浸泡30 s进行根表消毒,用无菌水反复洗净3次,再置于滤纸内吸去根表水分,放入灭过菌的研钵中,倒入5 mL无菌水充分研磨至液态。采用稀释涂抹法在培养皿内(培养基为PDA)涂抹该液态根系样品,在25℃下培养箱培养48 h后挑取菌落形态、颜色、质地不同的菌株进行真菌初步分离,并对得到的菌株用划线法进行纯化,纯化后的菌株接入试管内备用。
1.2.2生防真菌的筛选 采用对峙培养法对纯化后的菌株进行抑菌率筛选[20]。将分离保存的菌株及靶标病原菌(尖孢镰刀菌)活化后,接种在PDA培养基上距中点各2 cm处的同一水平线的两点上,设置单独接种尖孢镰刀菌为对照,25℃培养7 d后通过十字交叉法测定菌落半径并计算生长抑制率和覆盖指数从而筛选出对尖孢镰刀菌抑制率较高的菌株。生长抑制率(%)=(对照尖孢镰刀菌菌落半径-对峙培养尖孢镰刀菌菌落半径)/对照菌落半径×100。覆盖率分级标准[21]:Ⅰ级(+):生防菌与靶标菌菌落不相触;Ⅱ级(++):生防菌与靶标菌菌落相接触,且生防菌菌丝覆盖靶标菌菌落小于50%,靶标菌菌落无明显变化;Ⅲ级(+++):生防菌菌落大面积覆盖靶标菌,并在其上产生大量孢子,靶标菌生长衰败。
1.2.3生防真菌鉴定 生防真菌的分类鉴定综合其形态学特征与rDNA-ITS(Internal Transcribed Spacer)序列分子鉴定的结果。其中对真菌形态学的鉴定参照《真菌鉴定手册》[22]的技术,把生防真菌接种在PDA培养基上,25℃下培养7 d,观察菌落的颜色、纹路、生长速度等特征,同时采用扫描电镜观察其孢子的形态特征[23]。
分子序列分析鉴定采用真菌通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对菌株进行PCR(聚合酶链式反应Polymerase Chain Reaction)扩增[24],将扩增产物送至上海生工测序,所得序列登录GenBank进行序列比对,并用MEGA 5.0软件的Neighbor Joining生成系统发育树。
1.2.4生防真菌对不同苜蓿根腐病病原菌的抑菌能力测定 采用对峙培养法对生防真菌的抑菌能力进行测定(方法同1.2.2)。与生防真菌对峙的靶标病原菌分别为尖孢镰刀菌、燕麦镰刀菌、腐皮镰刀菌和半裸镰刀菌,比较其对不同病原菌的抑菌能力差异。
1.2.5生防真菌对盆栽苜蓿根腐病的防治效果 挑选长势均匀健康的苜蓿幼苗,栽入装有灭菌土的营养钵中。分别刮取25℃ PDA平板上培养10 d的病原菌(尖孢镰刀菌)与生防真菌培养物,制成孢子悬液,调整其孢子浓度分别至1.8×106CFU·mL-1和2.0×107CFU·mL-1。苜蓿幼苗移栽15 d后,用根部切伤小口后菌株悬浮液灌根的方法[25]分别接种病原菌和生防真菌以及多菌灵,以清水为对照,接种量为每盆10 mL。接种30 d后取出植株并清洗根部,观察植株根部病情并计算病害严重度和病情指数,同时测定苜蓿株高、株鲜重及根重等生长指标。
苜蓿根腐病病害分级标准:[26]
0级:根系生长健壮,无病症;
1级:主根斜切面有褐色环,侧根颜色变深;
2级:主根萎蔫,颜色变黑褐色且出现坏死,侧根大部分腐烂;
3级:根系大部分坏死,颜色黑褐色,植株枯萎死亡。
病情指数=100×∑(各级发病数×相应级别)/(调查总数×最高级数);
防治效果(%)=(对照病指-处理病指)/对照病指×100。
1.3 数据分析方法
试验所得数据结果采用Excel 2010进行统计和作图,SPSS V15.0版进行单因素方差分析(ANOVA),Duncan新复极差法进行差异显著性检验,其显著水平设定为P=0.05。
2 结果与分析
2.1 生防真菌的分离筛选
从不同生境苜蓿根系土中分离得到真菌菌株95株,通过与尖孢镰刀菌进行平板对峙试验,8株菌株的抑制率在36.0%以上(表1),其中2株抑制率超过60%,分别为ZY56(抑制率65.6%)和GY37(抑制率62.2%),与其它菌株之间差异显著,且这2株菌株对尖孢镰刀菌的覆盖指数均达到最高级别Ⅲ级(+++),具有良好的抑菌效果和生防潜力。
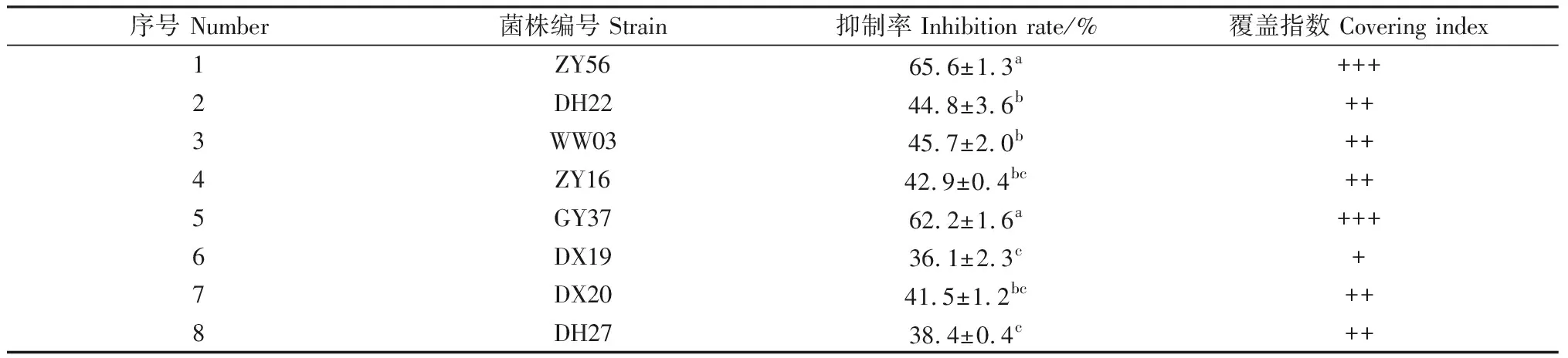
表1 生防真菌对尖孢镰刀菌的抑制率Table 1 The inhibitory percentage of biocontrol fungi on Fusarium oxysporum
注:表中数据为平均值±标准差,同列数据后不同小写字母表示在P<0.05水平差异显著。下同。“+”为覆盖指数Ⅰ级;“++”为覆盖指数Ⅱ级;“+++”为覆盖指数Ⅲ级
Note:Data in the table are mean ±SD. Different letters in the same column indicate significant difference at the 0.05 level. The same as below. “+” covering index classⅠ;“++” covering index class Ⅱ;“+++” covering index class Ⅲ
2.2 生防菌株的鉴定
对具有较好生防潜力的2株菌株ZY56和GY37进行形态特征和ITS分子序列鉴定,鉴定结果如下:
2.2.1形态特征鉴定 ZY56菌丝生长迅速,菌落深厚、致密,培养1~3 d左右菌落为白色,之后开始产生深绿色分生孢子,菌落转为绿色和灰黄色相间环斑,分生孢子球状,粘液聚成孢子头(图1);GY37菌落初呈浅白色,菌丝生长迅速,3~4 d基本长满全皿,后期产生深绿色孢子,并在菌落中间有一圈明显的绿色产孢区,周边菌落呈浅黄色,分生孢子卵圆形,粘液聚成孢子头(图1)。依据上述形态特征及魏景超《真菌鉴定手册》描述,将2株菌株初步鉴定为木霉属(Trichodermaspp.)真菌。
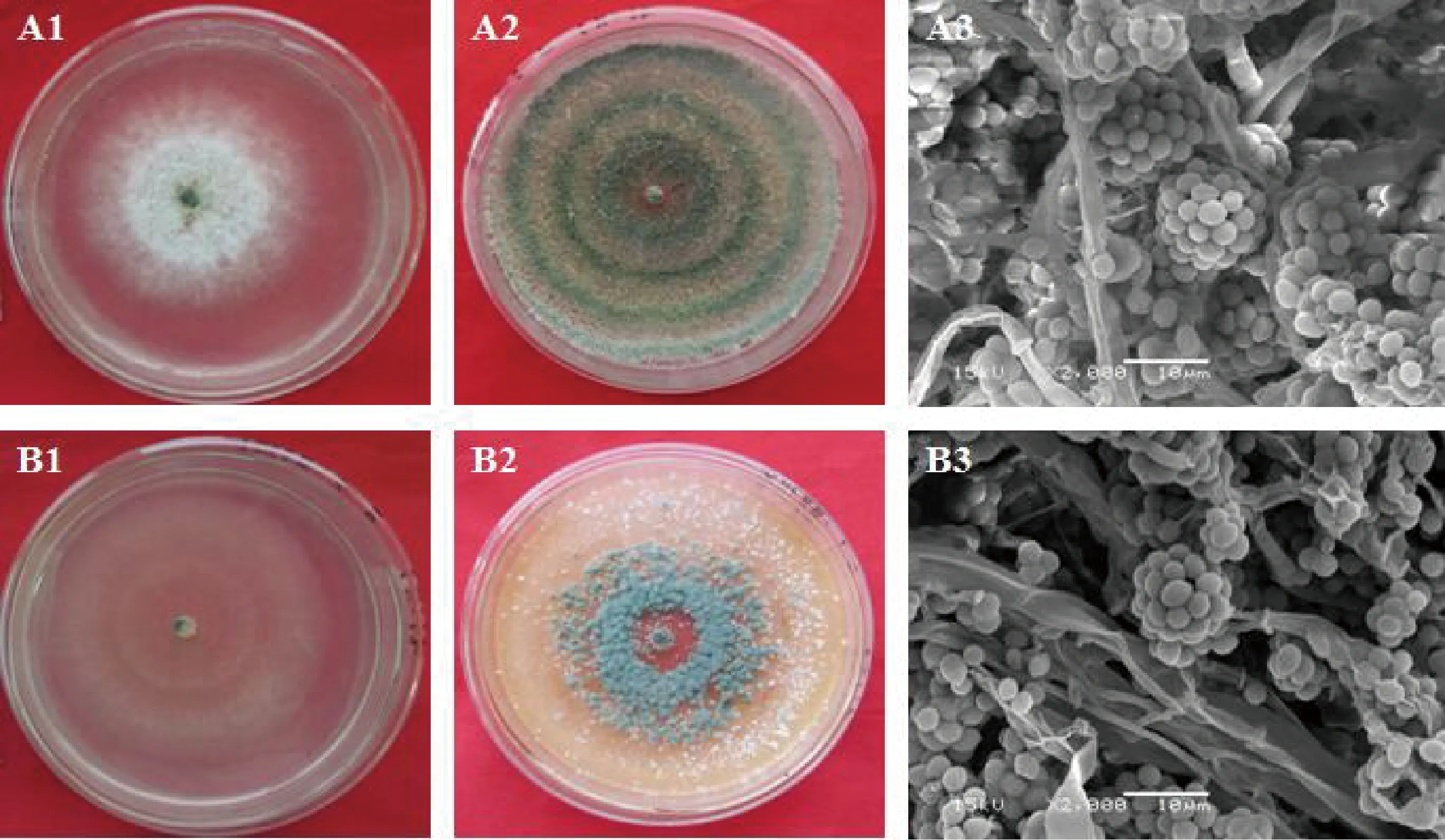
图1 ZY56和GY37的形态特征Fig.1 Morphological characteristics of ZY56 and GY37注:A1:ZY56 培养3 d菌落;A2:ZY56培养7 d菌落;A3:ZY56分生孢子;B1:GY37 培养3 d菌落;B2:GY37培养7 d菌落;B3:GY37分生孢子Note:A1:3 d colony of ZY56. A2:7 d colony of ZY56. A3:Conidia of ZY56. B1:3 d colony of GY37. B2:7 d colony of GY37.B3:Conidia of GY37
2.2.2菌株分子生物学鉴定 以2株菌株的基因组DNA为模板,ITS1、ITS4为引物对分离菌株ITS区段序列进行PCR扩增,分别得到大小为622 bp(ZY56)和626 bp(GY37)的单带,没有非特异性扩增片段(图2)。
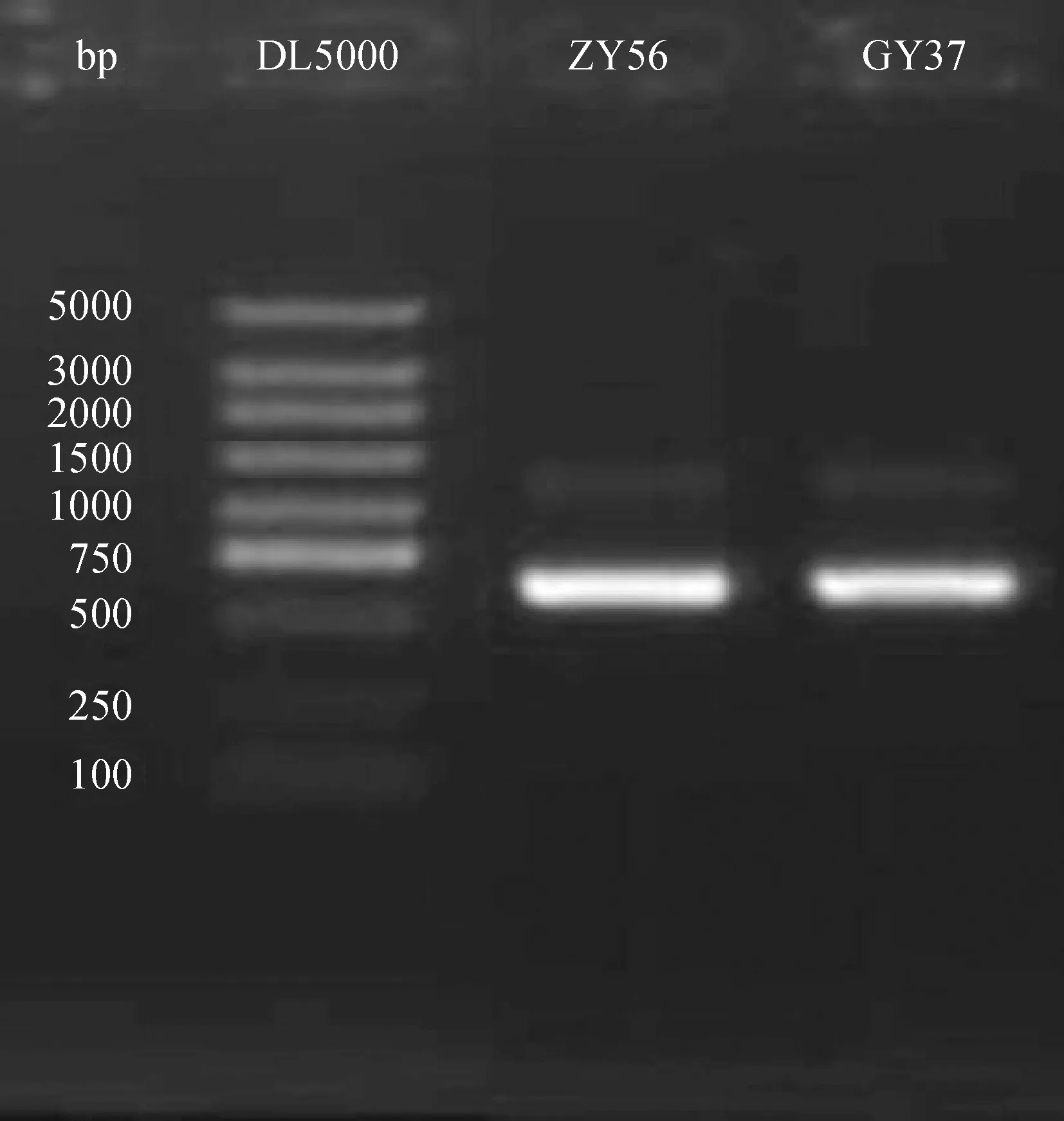
图2 菌株PCR扩增结果Fig.2 Amplification results of PCR
从Blast结果分析得出,菌株ZY56的rDNA-ITS序列与哈茨木霉(KM079608)相似性达100%,且二者处于系统发育树上同一支线,综合其形态特点将其鉴定为哈茨木霉;菌株GY37的rDNA-ITS序列与康宁木霉(EU520243)相似性达100%,且二者处于发育树同一支线,综合其形态特点将其鉴定为康宁木霉。

图3 生防真菌同源性系统发育树Fig.3 Phylogenetic tree of biocontrol fungi
2.2.3生防真菌拮抗能力测定 如图4所示,2种生防真菌对4种镰刀菌病原菌均呈现出一定的抑菌效果。对峙培养1 d后,2种生防菌菌丝生长速度就已经开始超过4种病原菌;接种2 d后,生防菌菌落逐渐占领病原菌一侧的平板,并且从第3 d开始两种菌落相接触,各病原菌菌落向中心点的生长均受到明显的抑制;接种5 d后,生防菌菌落不断侵占各病原菌所在面的平板,并开始逐渐包围病原菌,在菌落交界处大量产孢,将病原菌包围其中以控制其扩张。其中,ZY56与燕麦镰刀菌(ZY56-Av)和半裸镰刀菌(ZY56-Se)以及GY37与燕麦镰刀菌(GY37-Av)的对峙在菌落交界处形成明显的抑菌带。
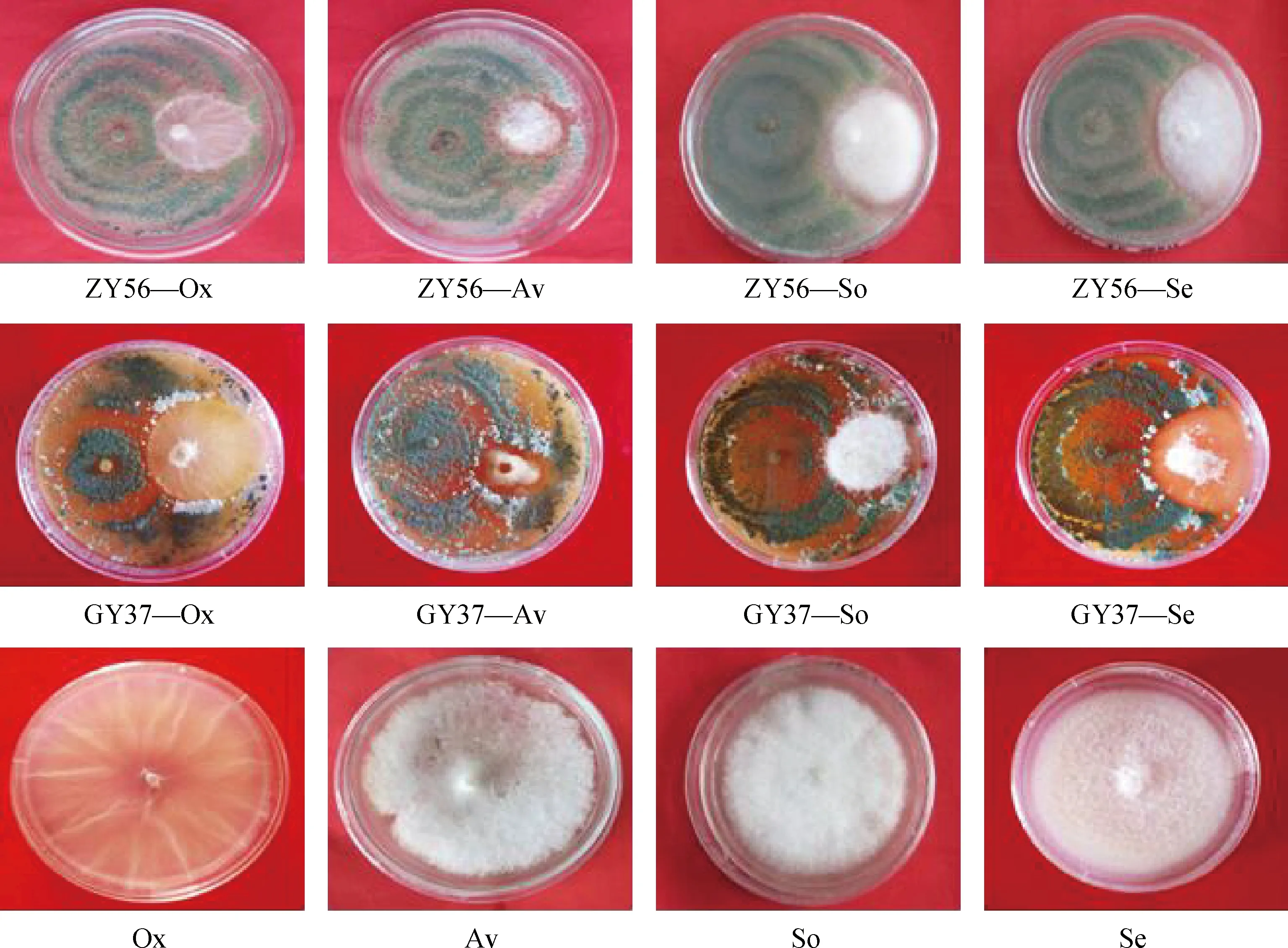
图4 生防真菌对不同镰刀菌的抑菌效果Fig.4 Antagonistic effects of biocontrol fungi on different Fusarium species注:图片均于培养7 d后拍摄,对峙图片左边一侧为生防真菌,右边一侧为不同镰刀菌。Ox-尖孢镰刀菌、Av-燕麦镰刀菌、So-腐皮镰刀菌、Se-半裸镰刀菌Note:Photo after 7 d of culture,Biocontrol fungi on left side and Fusarium on right side in petri dish. Ox-F. oxysporum,Av-F. avenaceum,So-F. solani,Se-F. semitectum
对峙抑菌实验结果表明(表2):2种生防菌对4种病原菌的抑菌率在48.5%~75.3%之间,且抑菌率随着对峙天数的增加而增大。对峙5 d时,ZY56对除燕麦镰刀菌外的其它3种病原菌的抑菌率均高于GY37,此时,GY37对燕麦镰刀菌的抑菌率为61.4%,显著高于同时期其它的对峙培养抑菌率;对峙7 d时,ZY56对尖孢镰刀菌和半裸镰刀菌的抑菌率高于GY37,分别为65.6%和57.7%,而GY37对燕麦镰刀菌和腐皮镰刀菌的拮抗作用更强,抑菌率分别为75.3%和66.1%。
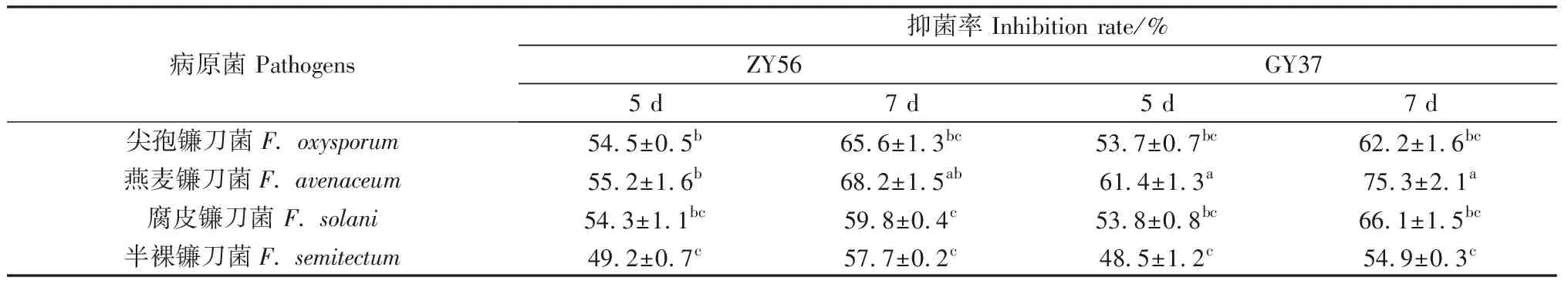
表2 生防真菌对不同病原菌的抑菌率Table 2 Inhibition rate of biocontrol fungi to different pathogens
2.2.4生防真菌对苜蓿根腐病的防治效果 从表3可以看出,致病处理F苜蓿根腐病病情指数达到33.6,与清水对照相比,其苜蓿植株的生长发育受到明显的抑制,株高、株鲜重及根鲜重等各项指标均显著低于对照水平。接种生防菌及多菌灵的3种处理,其病情指数在11.3~15.1之间,说明3种处理对苜蓿根腐病均有一定的防治效果,防效在55.1%~66.4%之间。其中接种哈茨木霉处理(ZY56+F)的病情指数最低,防效最高,其各项生长指标显著高于多菌灵处理,且具有明显生根的能力,根鲜重指标显著高于对照;接种康宁木霉处理(GY37+F)的病情指数及防效略低于多菌灵处理,但差异不显著,其各项生长指标与多菌灵和清水处理相比较也无显著差异。
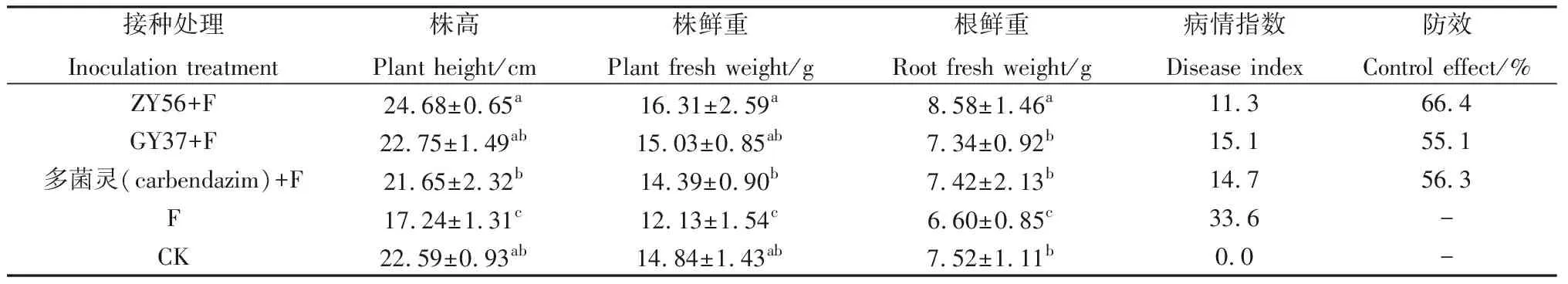
表3 生防真菌对苜蓿根腐病的防效Table 3 Control effect of biocontrol fungi on alfalfa root rot
注:F为接种尖孢镰刀菌(Fusarium.oxysporum)的处理
Note:F for the inoculation ofFusarium.oxysporum
3 讨论
镰刀菌(Fusariumspp.)是一种常见的土传病害病原真菌,也是引起苜蓿根腐病的重要致病菌[27]。Uddin与Knous[28]的研究表明,在美国内华达州苜蓿根腐病的致病菌主要为茄腐皮镰刀菌、锐顶镰刀菌(Fusariumacuminatum)、尖孢镰刀菌和燕麦镰刀菌。李敏权等[29]对陇中旱区苜蓿根腐病的研究结果显示,该病的病原主要是尖孢镰刀菌、锐顶镰刀菌和半裸镰刀菌。王多成等[30]对来自甘肃的苜蓿根腐病病原物的分析结果表明:发病部位分离到的菌株以镰刀菌占优势,且经致病性测定和接种试验证明,腐皮镰刀菌致病性最强,其次是尖孢镰刀菌和串珠镰刀菌(Fusariummoniliformin)。本试验所选用的靶标病原菌尖孢镰刀菌、燕麦镰刀菌、腐皮镰刀菌和半裸镰刀菌经接种检测均为引起苜蓿根腐病的重要致病菌,以此为靶标病原菌进行生防真菌的筛选及相关防效研究,能够获得更高效的防病菌株,也更符合生产实际的需求。
木霉菌的抗病机制除了对病原菌的空间竞争、营养竞争和重寄生作用以外,抗生作用也是其抑制病原菌的一种重要方式[31-33]。抗生作用是指木霉在其生长繁殖过程中会释放一些次生物质或分泌一些酶类,来抑制周围其他病原生物的生长,而病原菌通常对这些物质敏感,从而达到抑菌效果。这些物质包括一些挥发性物质,如乙醛[34]、6—戊烷基吡喃酮[35]等,还包括一些难挥发性物质和肽类物质,如Bissett和Benftez分别从T.Longibraciatum和T.viride中分离提纯出的抗菌肽,并对其氨基酸序列进行了测定[36-37]。同时木霉产生的酶类物质包括几丁质酶、葡聚糖酶、蛋白酶和纤维素酶等,这些酶类物质有利于木霉的重寄生和使病原菌的菌丝消解,与木霉菌的重寄生作用共同形成协同拮抗,在木霉的抗病机制中具有重要的作用[38-40]。本试验的对峙培养研究可以看出,2种生防木霉除了对皿内空间及培养基养分的竞争外,ZY56与燕麦镰刀菌(ZY56-Av)和半裸镰刀菌(ZY56-Se)以及GY37与燕麦镰刀菌(GY37-Av)的对峙在菌落交界处形成了明显的抑菌带,说明在这些对峙过程中木霉产生了某些抑菌物质,对于这些抑菌物质的具体成分和组成还需在后续试验中做进一步深入的研究和分析。
有研究表明,木霉菌除了具有抑菌抗病作用外,还能促进植物根和叶的生长,从而提高植物抵抗不良生物和非生物环境胁迫的能力,如刘连妹等[41]的研究发现,用哈茨木霉的孢子悬浮液浸泡番茄幼苗,会显著增加其植株各生长部位的增长,提高植株叶片中叶绿素含量和过氧化物酶、多酚氧化酶和超氧化物歧化酶活性。张鹤[42]的研究显示,拟康宁木霉、哈茨木霉和棘孢木霉同时使用对草莓具有明显的促进生根的效果,其植株根鲜重较单独施用处理增加40.3%。梁志怀等[43]研究报道了豇豆被哈茨木霉发酵产物浸泡,其植株的根长、根重、根体积和活力等生长指标都呈现出增加的趋势,其根系活力相比对照提高10.4%~19%。本试验也与前人的研究得到了相似的研究结果,接种哈茨木霉处理后,苜蓿植株各项生长指标均高于清水对照,根鲜重更是显著高于对照,提高了14.1%,说明哈茨木霉除了具有抑菌作用外,还会对植物产生一些促生作用。
4 结论
本试验结果表明,菌株ZY56和GY37对4种苜蓿根腐病病原菌都具有较好的抑菌效果,抑菌率在54.9%~75.3%之间,盆栽防效分别达到66.4%和55.1%,生防效果显著,且菌株ZY56处理的根鲜重指标显著高于对照,具有一定的促进生根效果,因此对苜蓿根腐病的生物防治具有较好的应用开发潜力。
