紫花苜蓿MsLEA4启动子的克隆及表达分析
2019-09-25贾会丽石永红王学敏王运琦吴欣明刘建宁方志红董宽虎
贾会丽, 石永红, 王学敏, 王运琦, 吴欣明, 刘建宁, 方志红, 张 燕, 董宽虎
(1. 山西农业大学动物科技学院, 山西 太谷 030801; 2. 山西省农业科学院畜牧兽医研究所, 山西 太原 030032; 3. 中国农业科学院北京畜牧兽医研究所, 北京 100193)
启动子是基因的一个组成部分,是位于结构基因5'端上游的DNA序列,能活化RNA聚合酶,使之与模板DNA准确地相结合并具有转录起始的特异性,因此能控制基因的表达[1]。基因启动子区一般都含有TATA-box和CAAT-box,除此之外,不同基因的启动子区都含有不同功能的顺式作用元件,这些顺式作用元件是植物应答环境胁迫的开关[2]。如紫花苜蓿(Medicagosativa)DREB1基因启动子区的DRE元件能响应干旱胁迫[3],菊花(Dendranthemamorifolium)DREB基因启动子区的GT-1元件能响应盐胁迫[4],拟南芥(Arabidopsisthaliana)WRKY基因启动子区的W-box能通过脱落酸(abscisic acid,ABA)介导响应逆境胁迫[5],水稻(Oryzasativa)GRAS1启动子区含有多个与干旱胁迫相关的调控元件[6]。当植物遭遇干旱、高盐、低温等逆境胁迫,都会诱导植物基因的调控表达,在这些过程中,启动子扮演着主要角色。
ABA是植物干旱胁迫响应的重要信号分子。干旱条件下,土壤缺水促进植物根部ABA从头合成[7],及向地上部的转运,导致ABA在叶片中积累,从而促进气孔关闭以减少水分散失等来提高陆生植物对干旱胁迫的耐受能力[8]。赤霉素(gibberellin,GA)也参与植物对非生物逆境胁迫,但有可能是通过影响ABA的信号途径来改变植物对非生物胁迫的响应[9]。胚胎晚期富集蛋白(late embryogenesis abundant,LEA)是参与植物逆境保护的一类重要蛋白,启动子区域一般含有ABREs元件,这种顺式作用元件可以通过核心基序(ACGT)与转录因子相结合,来起始ABA响应基因的转录[10],提高植物对高盐、干旱和氧化胁迫等的耐受性。
紫花苜蓿是世界上栽培最广的多年生豆科饲料作物。富含粗蛋白、维生素、各种矿物质,以及反刍动物所需要的膳食纤维,可制成干草、青贮料来饲喂奶牛、绵羊、肉牛等,也可直接进行放牧[11]。紫花苜蓿抗逆性强[12],但在高盐、干旱、低温等非生物胁迫下,也会对产量和品质造成很大影响。因此,培育耐盐、抗旱、耐低温等各种耐逆性强的紫花苜蓿品种是现在育种家的目标和任务[13]。本研究根据前期实验得到的MsLEA4基因,从紫花苜蓿基因组中克隆出MsLEA4启动子,同时根据预测到的顺式作用元件对紫花苜蓿进行相应逆境胁迫,并构建MsLEA4基因Promoter:GUS瞬时表达载体,为进一步深入研究MsLEA4基因在紫花苜蓿逆境胁迫、光调控中的作用机制提供依据。
1 材料与方法
1.1 试验材料
本实验于2017年9月-2018年7月进行。实验中所用到的植物材料为“中苜1号紫花苜蓿(Medicagosativa)”,由中国农业科学院北京畜牧兽医研究所牧草资源研究室惠赠。2017年11月挑选饱满圆润、大小一致的紫花苜蓿种子,氯气消毒24 h,置于湿润培养皿中进行发芽,生长条件为(25℃,14 h光/10 h暗)。发芽1周后,将紫花苜蓿幼苗放置在人工气候培养箱中(25℃,14 h光/22 ℃,10 h暗)进行水培生长。挑选长势一致紫花苜蓿幼苗,用海绵条裹住根茎部,放置于带孔的泡沫板上,将根部置于1/2 MS营养液(Solarbio公司)中,每三天换一次营养液,生长四周后对幼苗进行胁迫处理并提取紫花苜蓿基因组DNA。
实验中所用的拟南芥材料为哥伦比亚型,由中国农业科学院北京畜牧兽医研究所牧草资源研究室惠赠。将拟南芥种子用70%酒精消毒2 min,5%的次氯酸钠消毒5 min,然后用超纯水冲洗3次播种于1/2 MS培养基上。4℃冰箱低温春化48 h,移至培养箱中生长(22℃,16 h光/19℃,8 h暗),待幼苗长至4片叶子时移至营养钵中继续在此培养箱中生长。
1.2 试验方法
1.2.1DNA和RNA提取 选用1.1中生长四周后的紫花苜蓿幼苗叶片,取0.1 g叶片置于2 ml离心管,液氮中速冻后研磨,参照植物基因组DNA提取试剂盒(DP305,天根生化科技有限公司)的步骤和要求进行紫花苜蓿基因组DNA提取,经纯度检测合格的DNA存储于—80℃冰箱备用。
紫花苜蓿叶片总RNA提取采用Trizol法。取紫花苜蓿幼苗叶片1.0 g,用液氮速冻后研磨,迅速加入Trizol(Takara公司),按照提取步骤提取叶片总RNA。取1 μg RNA,参照反转录试剂盒First Strand cDNA Synthesis Kit(Fermentas公司),反转录成cDNA,存储于—80℃冰箱,用于实时荧光定量PCR的应用。
1.2.2胁迫处理 实验中所采取的胁迫处理为ABA,GA,光照和黑暗处理。选取1.1中生长一致的四周苗龄紫花苜蓿幼苗,分别配制含有ABA (0.1 mmol·L-1)和GA (10 mg·ml-1)的1/2 MS营养液,将紫花苜蓿幼苗放置于各胁迫中处理0,4,8,12,24,48和72 h后取样,重复3次[14]。光照处理时,将紫花苜蓿幼苗放置于连续光照下处理0,4,8,12,24,48和72 h后取样,重复3次。黑暗处理时,将紫花苜蓿幼苗放置于黑暗中处理0,4,8,12,24,48和72 h后取样,重复3次。
1.2.3实时定量PCR检测MSLEA4基因在各胁迫下的表达模式 用Trizol法提取1.2.2中不同胁迫和不同处理时间下的紫花苜蓿叶片RNA,反转录成cDNA,将得到的cDNA用ddH2O稀释至5 ng·μl-1,用于实时定量PCR检测。以紫花苜蓿ACT2基因为内参基因,引物为F1/R1(见表1)。参考SYBR Premix Ex Taq (Takara公司)的定量PCR引物设计原则,根据MsLEA4基因序列设计实时荧光定量PCR引物F2/R2(见表1),用ABI 7500荧光定量PCR仪(ABI公司,USA),采用两步法进行Real-time PCR扩增,第1步:95℃预变性30 s;第2步:95℃ 5 s,60℃ 34 s,共40个循环,每个反应重复3次[15]。反应结束后,根据得到的Ct值,将每种处理的0 h设为对照,利用2-△△ct法[16],分别计算紫花苜蓿MsLEA4基因在ABA,GA,光照和黑暗胁迫下不同时间的相对表达量。

表1 实验中的引物序列Table 1 Primers used in the study
注:下划线GAATTC为限制性内切酶EcoRⅠ酶切位点,CCATGG为限制性内切酶NcoⅠ酶切位点
Note:The underline GAATTC isEcoRⅠrestriction site,CCATGG isNcoⅠ restriction site
1.2.4MsLEA4启动子克隆 根据已经克隆得到的紫花苜蓿MsLEA4基因序列[17],分别设计SP1,SP2,SP3引物(见表1),以紫花苜蓿基因组DNA为模板,采用染色体步移法进行MsLEA4基因启动子序列的扩增。所用到的试剂盒是TAKARA的Genome Walking Kit试剂盒,根据试剂盒要求进行3步扩增,PCR产物用1%的琼脂糖凝胶电泳检测,对位置正确片段进行切胶回收(DP214,天根生化科技有限公司)。回收产物连接PMD19-T载体(TAKARA公司),将重组质粒转化大肠杆菌DH5α(天根生化科技有限公司),挑选阳性克隆送上海英骏公司进行测序。
1.2.5MsLEA4启动子序列分析 利用Plant-CARE启动子分析软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对克隆得到的MsLEA4基因启动子序列进行分析。
1.2.6MSLEA4启动子瞬时表达载体的构建及遗传转化 根据得到的MSLEA4启动子序列,分别设计带有EcoRⅠ和NcoⅠ酶切位点的引物(见表1),用EcoRⅠ和NcoⅠ双酶切pCAMBIA1301植物载体和MSLEA4启动子片段(图1),经T4连接酶进行重组连接,得到插入有MsLEA4启动子序列的MsLEA4::GUS植物超表达载体,转化E.coliDH5α 感受态细胞,进行菌落PCR验证,选取阳性菌落进行测序验证。使用冻融法将测序正确重组质粒MsLEA4 Promoter::GUS转入农杆菌菌株GV3101。采用花序侵染法转化拟南芥[18],收获的T0代种子在含有kana的1/2 MS培养基上检测,得到T1代种子,低温春化后播种。
1.2.7转基因植株GUA染色 选生长1周的T1代拟南芥幼苗进行GUS染色。将植株在90%丙酮中(冰浴)轻微固定5~10 min;在缓冲液中漂洗3次,共计l0 min;将需要染色的拟南芥幼苗、花、荚果放在1.5 ml离心管中,加入染色液浸过材料,抽气 5~l0 min,37℃遮光染色过夜,染色12~16 h;用75%乙醇脱水2~3次,每次5~10 min,然后在100%乙醇中放置约 1 h。脱色后在体式显微镜下(Nikon DIGITAL CAMERA Dxm 1200F,Japan)进行观察并拍照[19]。
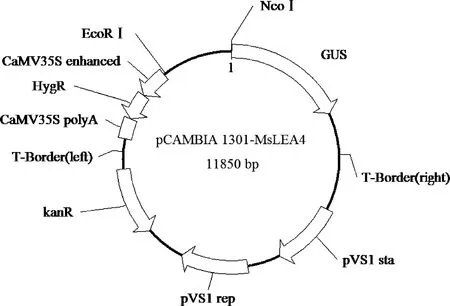
图1 MSLEA4 Promoter::GUS表达载体的构建Fig.1 Promoter::GUS expression vector of MSLEA4
2 结果与分析
2.1 MsLEA4启动子克隆
为了深入分析MsLEA4基因的表达情况,根据本实验室前期克隆得到的MsLEA4基因开放阅读框序列,分别设计特异性引物MsLEA4-GSP1,MsLEA4-GSP2,MsLEA4-GSP3(表1),采用步移法得到490 bp的MsLEA4基因启动子序列(图2)。
2.2 MsLEA4启动子序列分析
利用Plant-CARE启动子分析软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对克隆得到的MsLEA4基因启动子序列进行分析。结果显示出,MsLEA4基因启动子序列中含有一般启动子都有的典型的TATA-box和CAAT-box,其中有5个TATA-box和2个CAAT-box。序列中还含有能响应ABA调控的3个顺式作用元件ABRE,1个响应赤霉素调控的顺式作用元件P-box,2个与胚乳表达相关的结构域GCN4_motif和Skn-1 motif,1个与生物钟和昼夜节律调控相关的结构域CAANNNNATC。在MsLEA4基因启动子序列中还含有大量与光调控相关的顺式作用元件,如ATCT,Box-1,G-box,GAG-motif,GT1和I-box。所有MsLEA4基因启动子顺式作用元件位置见图3,具体数量见表2。
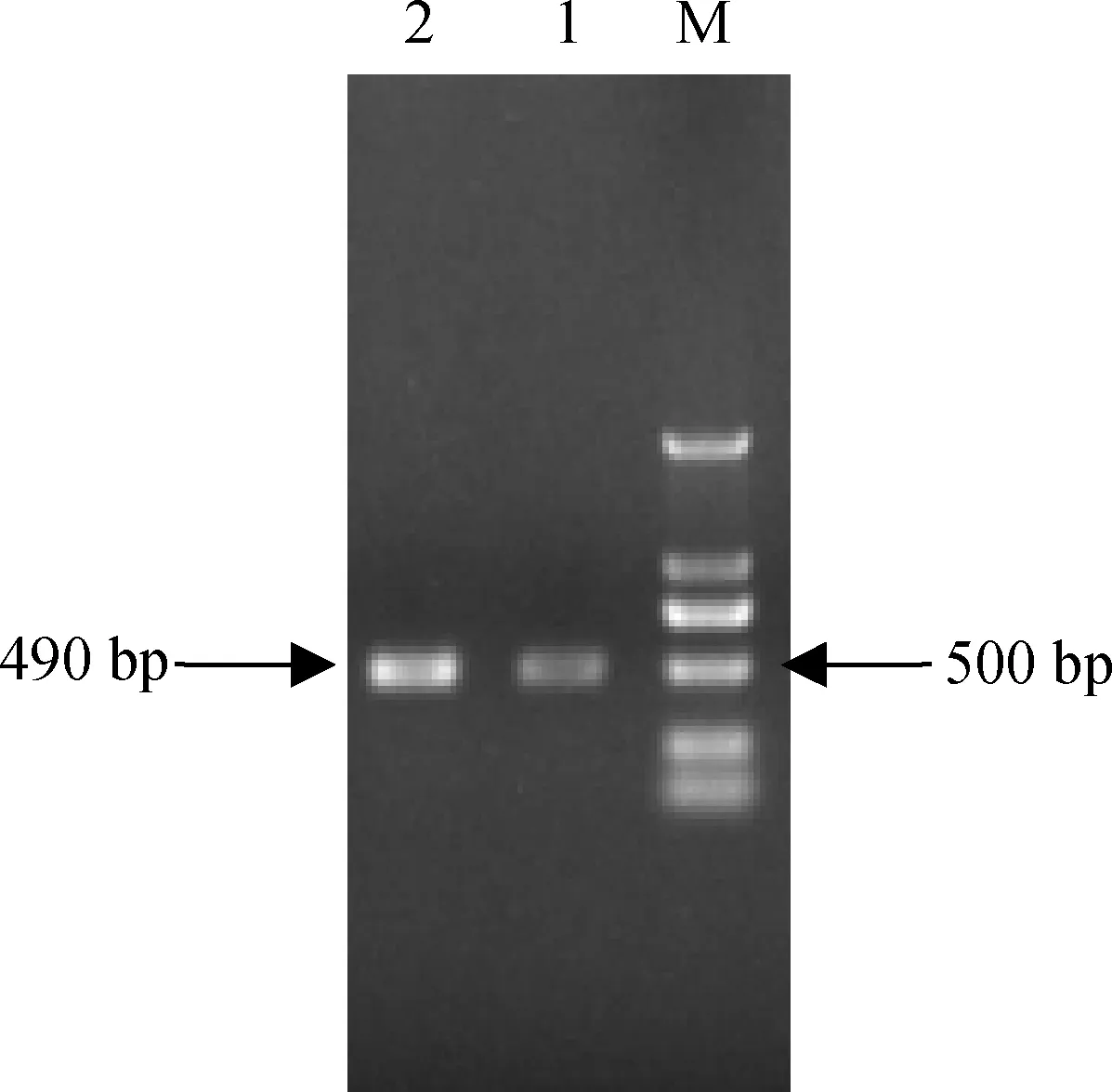
图2 MSLEA4基因启动子扩增产物Fig.2 Electroporesis result of MSLEA4 promoter注:M:DL2000; 1,2:PCR扩增产物Note:M: DNA Marker2000; 1,2: The fragment of MsLEA4 promoter

表2 MsLEA4启动子顺式作用元件种类和数量及功能分析Table 2 The types,quantities and function of cis-elements in MsLEA4 promoter

图3 MsLEA4基因启动子序列及顺式作用元件分析Fig.3 The promoter sequence and cis-element analysis of MsLEA4 from Medicago Sativa注:方框代表各种顺式作用元件Note: The various cis-elements were noted by box
2.3 不同逆境胁迫下MsLEA4基因的表达量
根据2.2克隆得到的MsLEA4启动子序列及顺式作用元件分析,对紫花苜蓿进行ABA,GA,光照以及黑暗胁迫,检测MsLEA4基因在紫花苜蓿逆境胁迫中的功能。结果显示,ABA胁迫下,MsLEA4表达量在4 h之内迅速降低,是对照的0.6倍,随后逐渐升高,8 h后迅速升高,12 h和24 h表达量达到最大,是对照的12和15倍,随后又迅速下降到与对照基本持平(图4-A)。GA胁迫前期,MsLEA4表达量与ABA胁迫类似,4 h之内表达量迅速降低,只有对照的0.2倍,随后逐渐升高,但24 h之内的表达量都低于对照,24 h之后表达量迅速升高,直到48 h表达量达到最高,是对照的10倍,随后表达量又下降到对照以下(图4-B)。持续光照12 h,MsLEA4启动子表达量才开始发生变化,12 h之后,表达量随光照时间延长逐渐增大,持续光照72 h,表达量达到最大,高于对照200倍(图4-C)。黑暗胁迫8 h,MsLEA4表达量开始发生变化,12 h之后,表达量迅速升高,24 h表达量已经达到对照的5倍,随后逐渐升高,在持续黑暗72 h,表达量达到最高,是对照的10倍(图4-D)。结果说明MsLEA4基因参与紫花苜蓿逆境胁迫和激素调控,同时受光照影响表达量也会发生明显变化,这与MsLEA4基因启动子序列中的顺式作用元件有很大相关性。

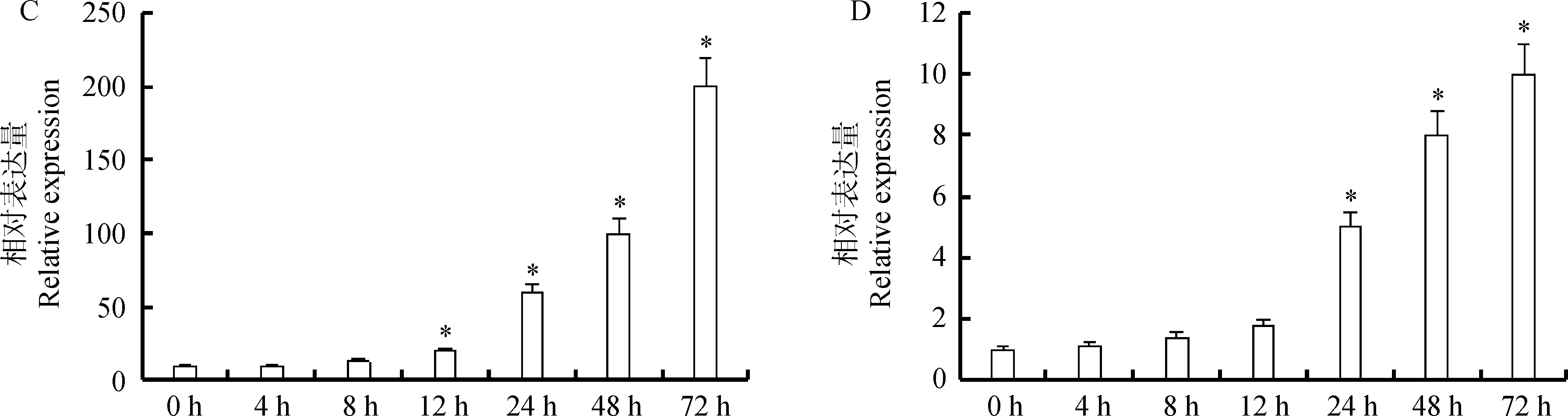
图4 MsLEA4基因在不同逆境下的相对表达量Fig.4 The relative expression of MsLEA4 under different stress注:A. MsLEA4 基因在 0.1 mmol·L-1 ABA 胁迫下的表达量。B. MsLEA4 基因在 10mg·ml-1 GA 胁迫下的表达量。C. MsLEA4 基因在持续光照胁迫下的表达量。D. MsLEA4基因在持续黑暗胁迫下的表达量。图中*代表显著性差异(P<0.05)Note: A. The expression of MsLEA4 under 0.1 mmol·L-1 ABA stress. B. The expression of MsLEA4 under 10 mg·ml-1 GA stress. C. The expression of MsLEA4 under continuous illumination stress. D. The expression of MsLEA4 under continuous darkness stress.* in the figure indicated significant difference at the 0.05 level
2.4 MsLEA4启动子Promoter::GUS超表达载体的构建及遗传转化
本研究将克隆得到的紫花苜蓿MsLEA4启动子序列插入含有GUS基因的植物双元表达载体pCAMBIA3301中(图1),通过PCR和EcoRⅠ/NcoⅠ双酶切进行验证,获得与预期大小相符的490 bp左右的MsLEA4启动子片段(图5-A)。将得到的阳性克隆进行测序检测,选择插入序列完整,无缺失、无突变的重组质粒,通过农杆菌介导的方法转入拟南芥中,T0代种子经过Kana筛选后得到9个阳性植株(图5-B),用于后续GUS染色实验。
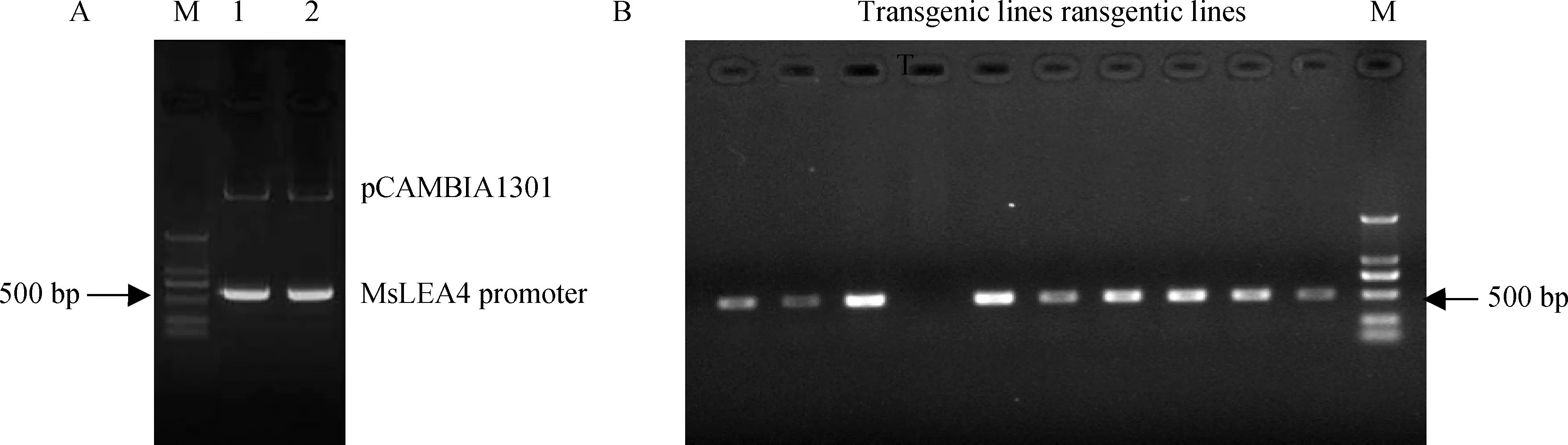
图5 MsLEA4启动子Promoter::GUS超表达载体酶切鉴定图及转基因植株PCR鉴定图Fig.5 Enzyme digestion identification of overexpression vector of Promoter::GUS and identification of transgenic lines注:A: MsLEA4启动子Promoter::GUS超表达载体酶切鉴定图B: 转基因植株PCR鉴定图Note: A. Enzyme digestion identification of overexpression vector of Promoter::GUS B. Identification of transgenic lines
2.5 MsLEA4组织特异性表达
为了检测所克隆的MsLEA4基因启动子的表达部位,取T1代转基因拟南芥幼苗不同部位的组织进行GUS染色。化学组织的GUS染色结果表明,转MsLEA4基因启动子植株的GUS基因在拟南芥花和荚果中有特异性表达,根、茎、叶组织染色结果均为阴性(图6)。

图6 MsLEA4::GUS转基因拟南芥GUS染色结果Fig.6 Histochemical GUS staining of MsLEA4 promoter overexpression Arabidopsis seedlings and wild type seedlings with pCAMBIA1301 empty vector
3 讨论
LEA主要在胚发育晚期高度表达,LEA基因启动子中有胚乳表达所必需的顺式调控作用元件,因此LEA启动子表现出较强的种子特异性[20]。本研究发现MsLEA4基因启动子区含有与胚乳合成相关的顺式作用元件GCN4和Skn-1,GUS染色发现该基因只在拟南芥的花和荚果中有表达,有可能是种子特异性启动子,同时受ABA和GA等诱导表达,也具有诱导型启动子的特性,与刘国宝、刘峰等的研究结果基本一致。ABA在植物逆境胁迫响应过程中发挥着信号分子的作用,ABRE元件是对ABA起响应作用的主要顺式作用元件[21]。LEA蛋白作为重要的逆境蛋白之一,启动子区域一般含有ABREs元件,这种顺式作用元件可以通过核心基序(ACGT) 与转录因子相结合,来起始ABA响应基因的转录[22]。除了ABREs元件外,LEA基因的启动子区域中还有富含AT序列的ATHB基序(CAATTATTA),它能与ABA信号途径中的调控因子相互作用来调控相关基因的表达。此外,在LEA基因启动子区域还含有能被ABA诱导的胚特异性表达的DPBF基序(ACACNNG)等[10]。本研究发现MsLEA4基因启动子序列中含有能响应ABA调控的 3个顺式作用元件ABRE,1个响应赤霉素调控的顺式作用元件P-box。经过验证发现,在外源ABA和GA诱导下,MsLEA4基因的表达量都有明显变化。有研究发现赤霉素调控元件也是通过影响ABA信号途径来起到对非生物胁迫的响应[9],说明该启动子可能是依赖于ABA途径来参与紫花苜蓿的逆境调控作用。启动子激活抗逆基因表达的活性不仅与其存在的顺式作用元件种类有关,还与其数量有关,单一的顺式作用元件很难发挥作用,它们或协同作用或交互作用,机制较为复杂[9]。有研究发现,启动子中的GT-1元件,也可以作为盐胁迫的正调控元件[23],G-box也能调控基因在各种环境因子作用下的诱导表达[24]。前期研究发现盐胁迫和PEG胁迫也能诱导MsLEA4基因的表达,说明MsLEA4基因参与了紫花苜蓿对多种逆境胁迫的响应,可能是其启动子区的各顺式作用元件共同起作用的结果。
本研究发现MsLEA4基因启动子中还有大量与光调控相关的顺式作用元件,如ATCT,Box-1,G-box,GAG-motif,GT1和I-box。为了验证该基因的表达是否受光照调控,对紫花苜蓿进行了光照和黑暗胁迫,发现光照和黑暗确实能影响该基因的表达,而目前关于LEA的研究,并未见有关光调控之类的报道。对MsLEA4基因启动子的序列结构进行分析后发现该启动子序列中还有一个与生物钟和昼夜节律调控相关的结构域CAANNNNATC,下一步可以继续对紫花苜蓿进行光周期和昼夜节律方面的实验,验证光周期是否能影响该基因的表达。
4 结论
MsLEA4基因启动子中含有顺式作用元件ABRE,P-box,GCN4和Skn-1,含有涉及光调控和昼夜节律相关的顺式作用元件;对紫花苜蓿进行逆境胁迫后发现,外源ABA和GA能明显诱导MsLEA4基因在紫花苜蓿体内的表达,持续光照和黑暗也会诱导该基因的表达;GUS组织化学染色结果显示,MsLEA4基因在拟南芥的根、茎、叶中均未表达,只在花和荚果中有表达。
