天麻钩藤饮对自发性高血压大鼠外周血VEGF、TNF-α及EPCs动员的影响
2019-09-25赵英强庄建国2
周 巍,赵英强,庄建国2,李 甜,王 娟
流行病学研究显示,预计到2025年全球高血压病人将增加到15.6亿人[1]。2010年我国高血压防治指南指出,目前有约2亿高血压病人,且高血压病人总体知晓率、治疗率和控制率明显较低,分别低于50%、40%和10%[2],同时高血压具有高患病率、高死亡率、高致残率的特点,已成为公共卫生事业面临的一项巨大挑战。
高血压的发生发展与血管内皮结构和功能紊乱密切相关,为目前临床研究热点之一。天麻钩藤饮是治疗肝阳上亢型高血压疾病的经典方剂,具有平肝熄风、清热活血、补益肝肾的作用。前期研究发现,天麻钩藤饮能改善自发性高血压大鼠(spontaneously hypertensive rat,SHR)的小血管舒缩功能,但对内皮功能影响的机制研究较少。本研究探讨不同剂量天麻钩藤饮及依那普利对SHR血压、内皮损伤修复及内皮祖细胞(endothelial progenitor cells,EPCs)动员的影响。
1 材料与方法
1.1 实验动物 SPF级12周龄健康雄性SHR 50只,同源、同周龄、同性别且血压正常的京都维斯特大鼠(Wistar-kyoto rats,WKY)6只,体重(250±30)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。所有动物均饲养于中国医学科学院放射医学研究所清洁级动物房,每笼5只(注:WKY为1笼),分笼喂养。饲养于室内通风橱内,恒温(24±2)℃,湿度50%~70%,自然昼夜,自由取食及饮水。
1.2 实验药物 天麻钩藤饮汤剂,组方:天麻10 g,钩藤15 g(后下),石决明20 g(先煎),山栀6 g,黄芩6 g,川牛膝12 g,杜仲12 g,益母草12 g,桑寄生12 g,夜交藤12 g,茯苓12 g。所有药物均经天津中医药大学第二附属医院中药房鉴定为正品,水提浓缩,相当于每毫升含生药1 g,4 ℃保存备用。阳性对照药,马来酸依那普利片(扬子江药业集团江苏制药股份有限公司生产,规格:每片10 mg,批号:16080110)。
1.3 实验试剂及仪器
1.3.1 实验试剂 内皮细胞生长因子(vascular endothelial growth factor,VEGF)酶联免疫吸附测定(ELISA)试剂盒(武汉华美,货号CSB-E04757 r),肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(武汉华美,货号CSB-E11987 r),大鼠CD34免疫荧光抗体(abcam,货号ab187284),Alexa Fluor 488标记抗兔IgG(中杉金桥,货号ZF-0511)和Prom1 antibody(上海群已,货号PAB12663),磷酸盐缓冲液(Solarbio),多聚甲醛(Solarbio)。
1.3.2 实验仪器 智能无创血压计BP-98A(北京软隆生物技术有限公司),筒形大鼠固定器-wi108818(北京若水合科技有限公司),小动物保温加热毯45 cm×45 cm(安迪教学实验仪器),流式细胞仪(BD accuri C6,美国),酶标仪(Tecan infinite 2000,澳大利亚)。
1.4 实验方法
1.4.1 实验分组及给药方法 本研究采用随机、平行对照设计开展动物实验。将50只SHR随机分为模型组、西药组、中药低剂量组、中药中剂量组和中药高剂量组,每组10只,同时将6只WKY作为对照组,共6组。连续给药6周,每周测量1次血压和体重。对照组:不进行药物干预,每日灌胃与实验组相同体积的生理盐水;模型组:不进行药物干预,每日灌胃与实验组相同体积的生理盐水;西药组:依那普利按3 mg/(kg·d)灌胃给药;中药低剂量组、中剂量组、高剂量组:分别予以天麻钩藤饮汤剂1.0mL/(100 g·d)、1.5mL/(100 g·d)、2.0 mL/(100 g·d)灌胃给药。
1.4.2 血压测量 正式实验前适应性测量实验大鼠血压1周,每次测量血压时使用小动物保温加热毯加热至38 ℃,SHR大鼠及WKY大鼠鼠尾预热15~20 min,筒形固定器固定大鼠,鼠尾露出,将加压感应器置于鼠尾根部,大鼠在清醒与安静状态下,无创血压计在脉搏波型稳定5 s后自动测量。每只大鼠测量5次血压,取平均值作为最终结果。
1.4.3 颈动脉结构病理学观察 各组大鼠给药6周后,均禁食12 h,末次测量血压及称重后,麻醉开胸取血备用,分离颈动脉,取2 cm颈动脉,生理盐水洗净后以10%甲醛溶液固定,进行常规石蜡包埋、切片、HE染色、光镜观察。
1.4.4 血管内皮相关指标检测 VEGF和TNF-α均采用ELISA检测,每项指标取血清50 μL,按相关试剂盒说明书进行测定。
1.4.5 循环EPCs计数测定方法 采用免疫荧光标记方法,本研究选择CD34+、CD133+细胞为EPC。EPCs检测步骤:取肝素钠抗凝100 μL外周血加1 mL红细胞裂解液,混匀,室温下静置10 min,中途混匀1次,以1 500 r/min离心5 min;小心吸净上清;加入1 mL PBS混匀洗一遍,以1 500 r/min离心5 min;弃去上清,制成200 μL细胞悬液;加入CD34抗体染色,室温避光15 min;加入固定液,混匀隔夜;加入破膜剂,洗涤后加入Alexa Fluor 488标记抗兔IgG和CD133(PROM1)抗体;加1 mL PBS混匀洗一遍,弃去上清,制成200 μL细胞悬液;采用流式细胞计数仪进行检测。

2 结 果
2.1 各组大鼠心率、收缩压(SBP)、平均动脉压(MBP)和舒张压(DBP)比较 治疗前,与对照组(血压及心率在正常范围内)比较,其余5组SBP及心率均明显升高(P<0.01),组间比较差异无统计学意义(P>0.05),具备实验条件。与模型组比较,中药高剂量组给药1周后SHR大鼠DBP、MBP首先降低;给药3周后,中药高剂量组SHR大鼠SBP和DBP明显降低(P<0.05);给药3周后,西药组SHR大鼠SBP、DBP、MBP降低(P<0.05)。给药6周后,与模型组比较,西药组和中药组高剂量组SHR大鼠降低(P<0.05)。详见表1、图1。
2.2 各组颈动脉血管结构 HE染色切片显示,对照组颈总动脉血管内膜无内皮细胞脱落,无血细胞黏附,管腔规则,动脉壁厚度均匀,弹力纤维排列整齐。模型组颈动脉血管管腔规则,动脉壁厚度欠均匀,弹力纤维部分较杂乱。西药组大鼠颈动脉血管动脉壁厚度均匀,弹性纤维较SHR组排列有序。中药低剂量组、中剂量组、高剂量组血管病理形态观察与西药组相似。详见图2。
2.3 各组大鼠血清VEGF和TNF-α比较 治疗6周后,与对照组比较,模型组和西药组及中药各剂量组血清VEGF、TNF-α浓度明显升高,差异有统计学意义(P<0.01);与模型组比较,中药低剂量组、中剂量组、高剂量组及西药组血清VEGF、TNF-α浓度均降低,差异均有统计学意义(P<0.01)。详见表2、图3。
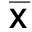

组别只数 HR(次/min) 治疗前治疗3周后治疗6周后对照组6362±31411±50 357±5 模型组7418±26478±321)467±221)西药组7426±30456±241)417±561)中药低剂量组8442±30460±311)484±281)中药中剂量组9425±25468±461)485±151)中药高剂量组9449±27454±231)449±41) 组别 SBP(mmHg) 治疗前治疗3周后治疗6周后对照组140±10146±6144±9 模型组185±13199±91)211±31)西药组192±9 184±51)2)195±121)2)中药低剂量组190±9 195±81)198±71)中药中剂量组182±11196±31)201±61)中药高剂量组184±11196±71)2)196±81)2) 组别 DBP(mmHg) 治疗前治疗3周后 治疗6周后对照组100±6104±12105±2模型组141±7158±91)157±61)西药组142±6140±101)2)149±51)2)中药低剂量组146±4151±71)151±51)中药中剂量组140±3155±41)159±111)中药高剂量组142±6147±91)2)153±41)2)
注:1 mmHg=0.133 kPa。与对照组比较,1)P<0.01;与模型组比较,2)P<0.05

A为SBP;B为DBP;C为MBP;D为心率
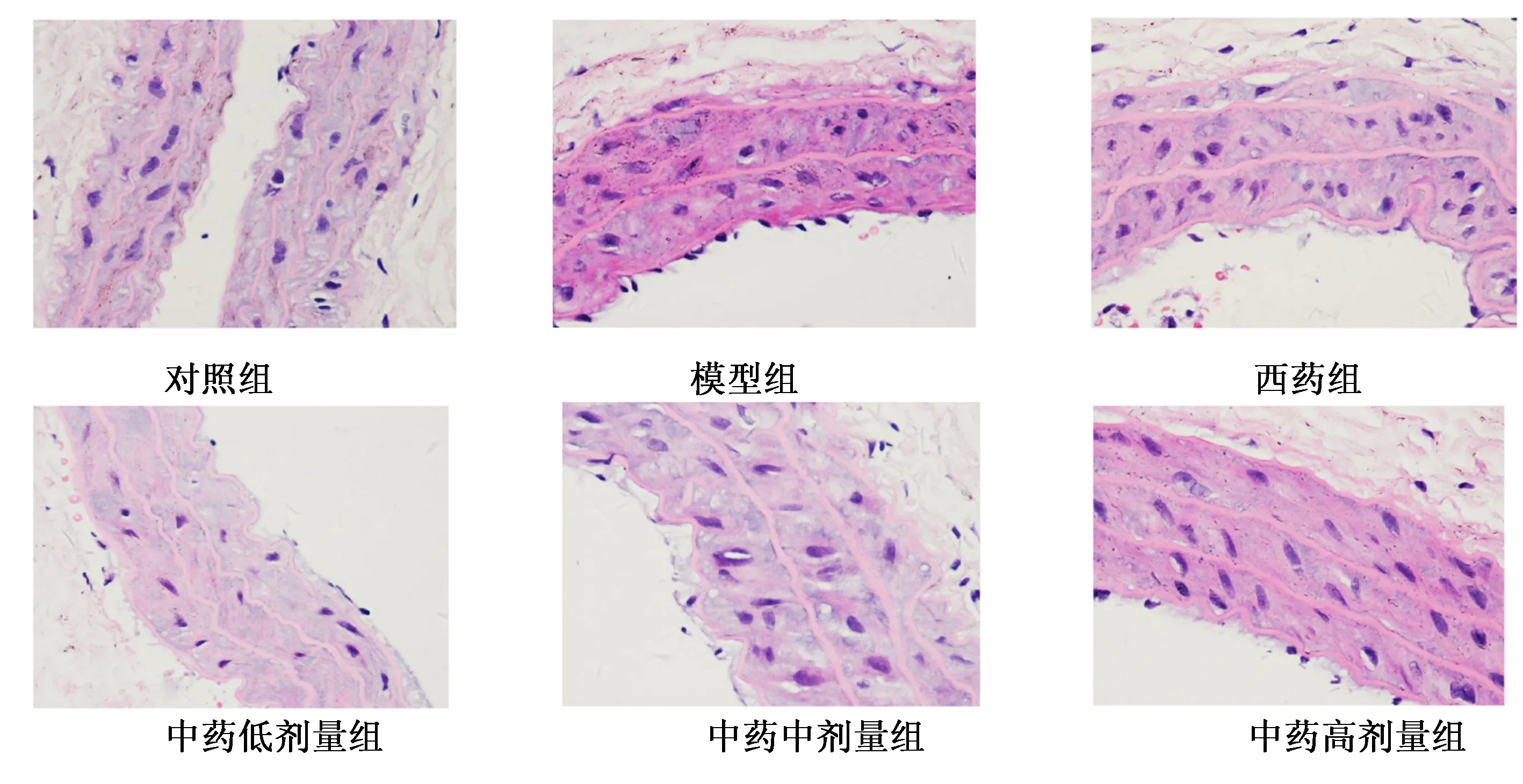
图2 各组大鼠颈动脉结构(HE染色,×400)

组别只数TNF-αVEGF对照组 679.10±3.03 33.93±1.09 模型组 7131.62±3.861) 52.44±1.521) 西药组 789.93±3.131)2)44.92±3.611)2)中药低剂量组8118.86±6.231)2)46.65±4.211)2)中药中剂量组9102.81±2.631)2)44.04±1.581)2)中药高剂量组997.55±2.481)2)41.05±1.211)2)
与对照组比较,1)P<0.01;与模型组比较,2)P<0.01
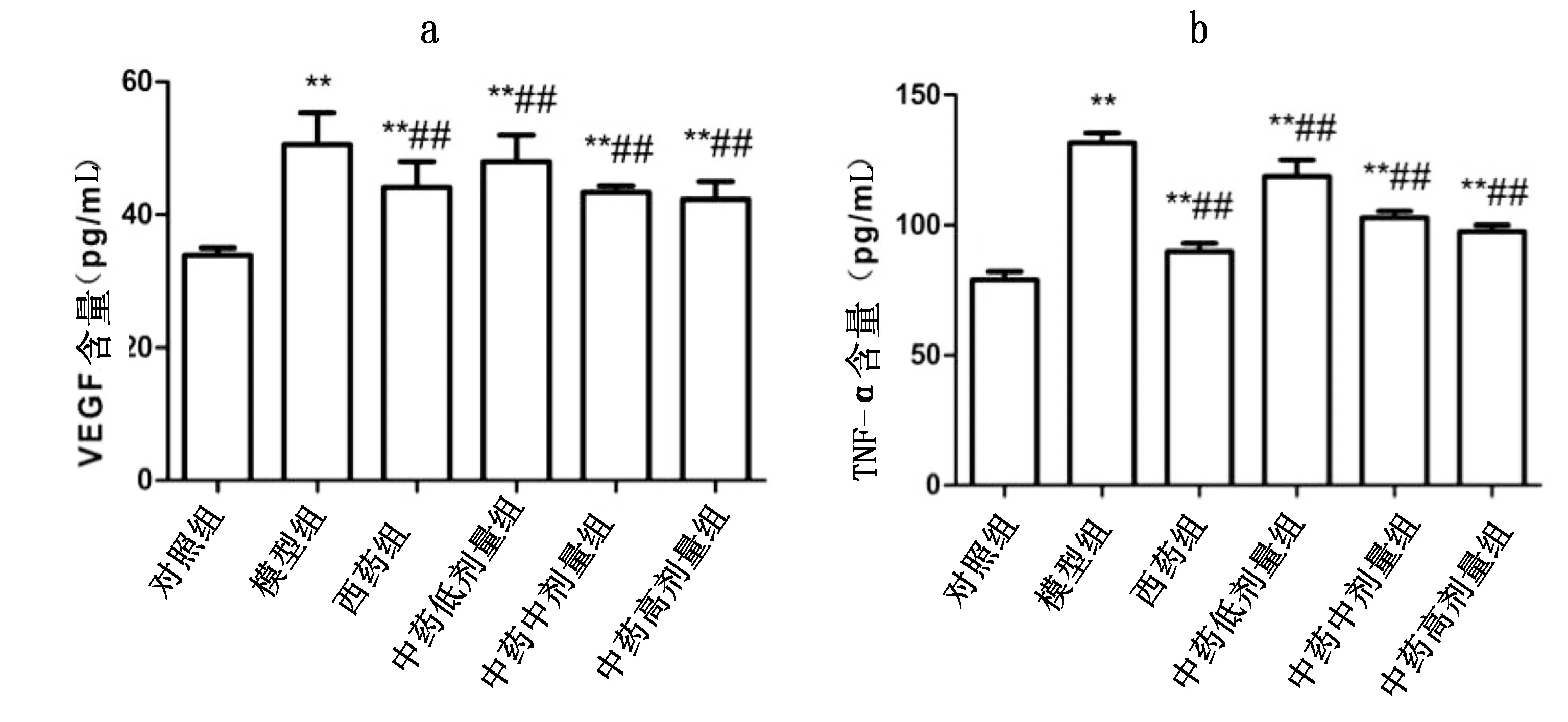
a为VEGF;b为TNF-α。与对照组比较,**P<0.01;与模型组比较,##P<0.01图3 用药6周各组血清VEGF、TNF-α表达
2.4 各组SHR大鼠循环EPCs影响 治疗6周后,流式细胞检测结果显示,与对照组比较,模型组循环EPCs所占比例明显降低,差异有统计学意义(P<0.05);与模型组比较,西药组及中药各剂量组循环EPCs所占比例均升高,且西药组及中药高剂量组升高更明显,差异有统计学意义(P<0.05)。详见表3、图4。

组别只数ECPs比例对照组60.57±0.06模型组70.30±0.091)西药组70.55±0.122)中药低剂量组80.35±0.11中药中剂量组90.41±0.21中药高剂量组90.55±0.172)
与对照组比较,1)P<0.05;与模型组比较,2)P<0.05

A为CD34PE/CD133(Prom-1) Alexa Fluor 488二维图;B为CD133(Prom-1)Alexa Fluor 488直方图;C为CD34PE直方图
图4流式细胞计数检测图
3 讨 论
高血压病是全身细小动脉持续痉挛硬化,周围循环阻力增加引起血压上升,基本病理变化是细小动脉病变。高血压持续作用下,全身细小动脉发生玻璃样变,中层平滑肌细胞增殖,内膜纤维组织和弹力纤维组织增生,血管管腔狭窄。血管内皮细胞功能障碍与高血压发生发展密切相关。血管内皮细胞分泌的多种血管活性物质,可调节血管收缩、舒张及维持血管张力。
高血压进程中,由于血管内皮损伤,VEGF可特异性地刺激血管内皮细胞增殖。有研究认为,高血压病人血清VEGF水平增加是机体的一种代偿反应,其作用是维持动脉粥样硬化状态下血管内皮细胞的正常功能,可促进受损内皮细胞修复[3]。TNF-α是一种炎性细胞因子,与炎症反应、组织损伤密切相关,可增加血管内皮通透性,内皮舒缩功能障碍,内皮细胞凋亡,引起血管内膜增生管腔变窄,促进高血压发生。多项研究发现,高血压病发生发展过程的血管内皮损伤可能引起血TNF-α水平增高[4-5],TNF-α导致的内皮功能障碍可能是高血压靶器官损害与合并症的重要因素[6]。
EPCs是一类具有特异性归巢于损伤区域并分化增殖为成熟血管内皮细胞的前体细胞。EPCs主要源自骨髓,可对刺激、组织缺血和血管损伤产生应答,动员到外周血并迁移、归巢到缺血或损伤部位,并在靶区域增殖、分化为内皮细胞。EPCs对受损血管内皮具有修复作用。相关研究发现,SHR动物模型[7]和醋酸去氧皮质酮诱导的盐敏感性高血压大鼠模型[8]EPCs数量与增殖、黏附、迁移能力均较正常对照组明显降低。顽固性高血压病人循环血液EPCs数量及增殖能力均明显下降;血液EPCs数量越低,收缩压越高[7,9]。
天麻钩藤饮由天麻、钩藤、石决明、杜仲等11味中药配伍组成,是治疗肝阳上亢型高血压病的经典方剂,也是平肝潜阳治疗的代表药物。本研究结果显示,依那普利及中药天麻钩藤饮均能降低SHR大鼠血压,随着大鼠鼠龄增加血压持续上升,药物治疗能抑制高血压升高。与模型组比较,中药高剂量组及西药组用药3周后能明显降低SHR大鼠SBP和DBP(P<0.05)。与对照组比较,模型组VEGF及TNF-α均升高,EPCs数量降低,西药组及中药高剂量组可一定程度降低VEGF和TNF-α水平,升高EPCs水平,差异有统计学意义(P<0.05)。
天麻钩藤饮具有促进血管内皮损伤修复、抑制内皮细胞凋亡、减轻血管炎性反应的作用,对血管内皮的保护作用表现为动员EPCs,升高SHR外周血EPCs数量,以促进损伤内皮的修复。
