高寒半湿润沙地草本修复期土壤微生物变化研究
2019-09-24帅林林周青平陈有军苟小林周蓉
帅林林, 周青平*, 陈有军,2, 苟小林,2, 周蓉
(1.西南民族大学青藏高原研究院,四川 成都 610041;2.青海大学畜牧兽医科学院,青海 西宁 810016;3.阿坝州茂县农业畜牧和水务局,四川 阿坝 623200)
土壤由有机质、矿物质、微生物、水等组成,是植物赖以生存的载体,也是微生物生长繁殖的重要场所[1-2]。有机质和矿物质是构成土壤养分的主要结构,是植物和微生物生长发育所需营养的关键之源[3-5];同时土壤微生物在土壤养分循环和积累过程中起着重要的作用。土壤微生物通过分解地表凋落物和地下植物根系残体,参与土壤养分的循环与转化等过程[6];而微生物多样性和微生物生物量也能对土壤质量变化产生影响[7],微生物多样性通过改变微生物功能群落影响土壤中养分循环过程,对土壤养分过程进行调控。微生物生物量也是土壤中养分的重要组成,对土壤养分循环具有积极作用。因此,土壤微生物多样性和微生物生物量的格局变化,不仅能够影响土壤养分转化,并且可能干扰植物繁殖代谢过程,所以,微生物生物量和多样性的变化是影响土壤生态系统平衡与稳定的重要因素。
青藏高原东南缘是我国典型半湿润高寒草地分布区[8]。该地区作为全国第二大藏区,是长江、黄河重要水源涵养地,同时也是高原人民生产、生活所需资料的重要来源地。近几十年来,由于受气候变化和人类活动等的影响,高寒草地遭受破坏,部分地区生态系统退化[9];尤其是在青藏高原东南缘的日干乔湿地保护区,受过度放牧、人类活动、全球变暖等的影响,使沙化急剧扩张,甚至已经成为生态系统安全的重大威胁[10],是当地经济可持续发展的重大阻碍,因此亟须开展生态治理。
灌草作为高寒地区的重要植物资源,已经在高寒沙地修复过程中被广泛运用[11-13]。目前研究者们对沙蒿(Artemisiadesertorum)、柠条锦鸡儿(Caraganakorshinskii)等灌木种植模式进行沙地治理的研究较为深入[14-15],而采用高寒草本进行沙地修复的研究较少,特别是混合草本恢复模式下高寒沙地土壤养分与土壤微生物动态变化的相关研究极为缺乏,这对脆弱的高寒生态系统进行沙地修复理论指导极为不利。因此,根据周青平等[16]和梁国玲等[17]在高寒沙地治理过程中进行的牧草品质分析,筛选出的适合高寒地区生长的牧草品种;本研究以适生性燕麦(Avenasativa)、垂穗披碱草(Elymusnutans)、中华羊茅(Festucasinensis)3种草本混播,对日干乔湿地自然保护区高寒半湿润沙地进行植被修复,通过研究土壤养分和土壤微生物含量随沙地植被修复过程的动态变化,为青藏高原半湿润沙地草本种植修复过程提供基础研究理论。
1 材料与方法
1.1 研究区域概况
研究区域位于四川省阿坝州红原县日干乔湿地自然保护区(31.51°-33.19° N、101.51°-103.23° E, 海拔3460 m)。其位于青藏高原东南缘,气候为半湿润气候,年降水量可达750 mm以上[18]。该区为典型的半湿润高寒草地,高温和降水主要集中于每年5-9月,年平均气温为1.1 ℃,极端高温出现在每年的7月,为26 ℃,极端低温出现在每年的12月,为-36 ℃(图1)。该地区冬季漫长,从11月一直持续到来年4月初,冬季土壤冻结,地表覆盖雪被。土壤表层主要为高寒草甸土,地表植物主要是适应高寒环境的中国沙棘(Hippophaerhamnoides)、沙蒿、柳树(Salixatopantha)、鹅绒委陵菜(Potentillaanserina)。

图1 研究区域2013-2016年日均温度和日降水量Fig.1 The daily average temperature and daily precipitation in study area from 2013 to 2016
1.2 植被修复试验
在研究区选择不同的种植区域,具有相似的地形、地貌特征,相同的土壤类型。将筛选的燕麦、垂穗披碱草、中华羊茅按照种子重量比10∶3∶3的比例混播,利用尖头开沟器进行沟播,播深5 cm,行宽10 cm,建植成0.5 m×0.5 m的菱形方格,覆土5 cm,形成草方格。保障种植面积内燕麦达到450万株·hm-2,所以混合种子的播种量为160 kg·hm-2,后期围栏封育管理,在每年的5月初进行混合草本种植,分4年进行播种,种植年限分别为修复1年(2016年种植),修复2年(2015年种植),修复3年(2014年种植),修复4年(2013年种植),对照组为与种植区域相邻的空白沙地。每个试验区域具有3个0.5 km×1.0 km的重复样地,每个重复的试验样地之间被10 m宽的柳树隔离带进行隔离。
1.3 样地设置及样品采集处理
根据不同的种植年限,选择地表植被调查的样地。采用时空替换方法,即利用空间的变换来代替时间的变换,用空间上不同草地修复程度来替代草地在时间上的修复顺序[19-20]。于2016年8月中旬在研究区内对不同恢复期的样地进行样品采集。在处理区和对照区分别随机选择3块100 m×100 m的样方,在每块样方内沿对角线分别选取3个10 m×10 m的样斑,每块样方内的3个样斑即为3个重复。在样斑内随机用内径为5 cm的土钻采集0~10 cm和10~20 cm 的土壤(受高寒地区气候、降水等条件影响,沙化治理一年生燕麦主要根系分布在20 cm左右,而多年生长的草本根系受到生长年限和季节性影响,草本根系也大量分布于20 cm内,因此沙地草本根系主要分布在0~20 cm土层[21]),分别将样斑内采集的3个土壤样品混合为一个样品,每块样地内3个重复,将混合后的样品保存于放有冰袋的泡沫箱中,低温环境下迅速带回实验室进行样品分析。依据草本生长特性和野外草本样方调查方法[22],在3个样地中分别沿对角线选择3个1 m×1 m 的样斑,用于统计样斑内植物物种、群落盖度、植物分布特征等。
土壤样品带回实验室后过1 mm筛, 去除沙土中的石子和根系等杂物。将过筛后的土壤分为2份: 一份用于土壤理化性质的测定;一份用于土壤微生物特性的测定。
1.4 测定方法
土壤基础养分测定:将风干的土壤利用研钵磨碎后,过0.5 mm筛。采用重铬酸钾-外加热法测定土壤有机质,采用凯氏定氮法测定全氮含量,采用钼锑钪比色法测定全磷含量[23],各项指标分别测3个重复,取平均值。
微生物生物量测定:土壤微生物生物量碳、氮、磷利用氯仿熏蒸方法进行测定[24]。称取过筛后新鲜土壤20 g两份,20 ℃下一份用氯仿熏蒸24 h,一份不做处理。2份土壤测定的差值确定微生物生物量碳、氮、磷的值。利用重铬酸钾外加热氧化,硫酸亚铁盐滴定方法测定微生物生物量碳[25];利用靛酚蓝比色法测定微生物生物量氮[26];利用钼锑抗比色法测定微生物生物量磷[27]。
微生物多样性测定:采用磷脂脂肪酸(phospholipid fatty acid, PLFAs)法[28-29],称取1 g土壤样品与按1.0∶2.0∶0.8的比例配制的甲醇、氯仿、柠檬酸盐溶液混合,离心,收集上清液,加入提取液,振荡2 h,再离心,收集上清液,分别加入10 mL的氯仿和10 mL的丙酮洗去中性脂和糖脂,最后用10 mL甲醇淋洗磷脂,分离得到混合液中的磷脂,加入1 mL 0.2 mol·L-1的甲醇溶液和1 mL甲醇甲苯混合液,37 ℃水浴加热15 min,使其分解为脂肪酸甲酯(fatty acid methyl ester, FAME),加入0.1 mL冰醋酸,用正己烷萃取磷酸脂肪酸甲酯,吹干得到脂肪酸甲酯。使用气相色谱仪测定脂肪酸含量及组成,根据双键位置、碳原子数等确定不同的磷脂脂肪酸。根据特定的磷酸脂肪酸标记物区分细菌、真菌、放线菌、革兰氏阳性菌、革兰氏阴性菌(表1)。
1.5 数据统计分析
利用多因素方差分析(ANOVAs)和最小显著差异法(LSD)分析不同修复年限和不同土层间土壤微生物生物量、土壤微生物多样性、土壤养分及pH的差异;利用单因素分析方法(One-way ANOVA)和最小显著差异法(LSD)分析不同恢复年限植物盖度变化;显著水平为P<0.05。分析土壤养分、pH、微生物生物量和微生物群落之间的Pearson相关性,所有数据通过SPSS 20.0计算。
2 结果与分析
2.1 草本不同修复阶段植被多样性变化特征
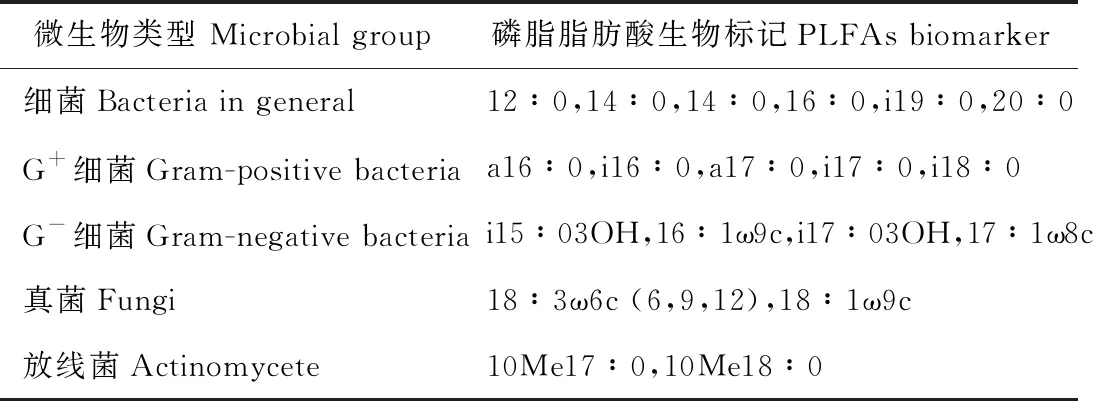
表1 磷脂脂肪酸的代表生物Table 1 PLFAs biomarkers indicating microbial group
草本恢复过程中,修复第1年,采用人工种植燕麦、垂穗披碱草、中华羊茅3种草本混播,燕麦在人工草本修复2年后消失;且随着修复期的延长,在植物群落演替过程中,逐渐出现菥蓂(Thlaspiarvense)、藜(Chenopodiumalbum)等一系列旱生草本短命植物,随后演替出现以礼草(Kengyiliamelanthera)、沙蒿、赖草(Leymussecalinus)等多年旱生植物。草本植被盖度显著增加(P<0.05),地上植被物种数从未治理前的4种,增加至修复第4年的14种;地上植被盖度从4%增加到80%,是对照的20倍(表2)。
2.2 沙地草本不同修复阶段沙地土壤pH及养分变化特征
整体来看,随着修复年限的增加,0~10 cm和10~20 cm两土层土壤有机质,全N、全P均出现先减少后增加的变化,且土壤有机质含量在恢复4年后显著(P<0.05)高于未治理沙地(表3)。其中,在人工修复第1和2年,两个土层沙地土壤有机质、全N、全P含量发生明显下降,且显著低于未修复沙地(P<0.05),表层土壤有机质变化最明显;到修复第3年开始显著增加,修复4年后,两个土层土壤全N、全P含量均恢复到未修复水平,且有机质含量增加,比未修复沙地高出了55%;但表层土壤pH在修复4年后,显著降低(P<0.05)。修复年限和土层分别对土壤pH、有机质、全N、全P具有显著影响(P<0.01),但不同修复年限与土层相互作用仅显著影响土壤pH和全P含量(表4) (P<0.05),对土壤有机质、全N含量影响不显著。
2.3 草本不同修复阶段土壤微生物生物量及多样性变化特征
以未治理沙地为对照,0~10 cm和10~20 cm根系生长层中,土壤微生物生物量及多样性随恢复年限均呈现先降低后增加的趋势(图2,表5),且除修复第1年外,下层微生物生物量始终显著(P<0.05)低于土壤表层。

表2 不同修复年限草本植被多样性调查Table 2 The vegetation diversity in different restoration stages of herbs (mean±SD, n=3)
注:同列不同小写字母表示差异显著(P<0.05)。
Note: The different lowercase letters in the same column indicate significant differences (P<0.05).
0~10 cm土层土壤微生物量碳、氮、磷的动态变化趋势为,修复的第1年,含量低于未修复的水平(P<0.05);修复2年后,微生物生物量碳、氮、磷持续增加;到修复第3和4年,微生物生物量碳、磷含量升高但差异不显著,微生物生物量氮含量则显著高于对照 (P<0.05)(图2)。10~20 cm土层的微生物生物量碳、磷含量与0~10 cm土层的变化相似;在植被恢复的最初2年内,土壤微生物生物量各组分含量显著降低(P<0.05);到修复第3年,微生物生物量碳、氮、磷含量开始增加,且微生物量氮含量显著高于未修复水平(P<0.05);但是修复4年后,微生物量氮含量降低,但高于对照。
高寒沙地植被修复样地中只检测到了细菌、G+、G-、真菌、放线菌;0~20 cm土壤微生物总量为(8.30±0.99) nmol·g-1,修复4年后增加到(10.58±2.99) nmol·g-1,其中主要类群为细菌,在修复前和修复4年后均各占微生物总量的51% (表5)。以未修复沙地为对照, 随着修复年限增加, 在0~10 cm和10~20 cm土层,土壤微生物群落呈先减少后增加的趋势。0~10 cm土层,草本修复第1和2年,沙地细菌含量显著降低(P<0.05),沙地中未检测到革兰氏阴性菌G-、革兰氏阳性菌G+、真菌、放线菌含量;修复第3年,微生物类群中各组分含量均恢复到未修复水平;4年后,细菌含量大于未修复水平,但在微生物总量中所占比例与未治理相比却下降了20%。10~20 cm土层中,草本修复第1年,微生物群落变化与上层土壤一致;2年后,沙地土壤中检测到少量真菌,其含量显著低于未修复沙地(P<0.05)。修复第3年,微生物各类菌群含量恢复至未修复水平;草本修复4年后,真菌含量下降,且显著低于未治理沙地。

表3 不同修复年限和不同土层土壤养分及pH变化Table 3 Soil nutrient and pH changes in different soil layers with different restore years
注:不同小写字母代表年限之间差异显著,不同大写字母代表土层之间差异显著(P<0.05)。下同。
Note: The different lowercase letters indicate significant differences between restore year. The uppercase letters indicate significant differences between soil layers (P<0.05). The same below.

表4 沙地土壤pH及养分在不同修复年限和土层之间的差异 Table 4 Two-way ANOVA for the effects of soil layer,restore year and their interactions on pH and nutrients

表5 草本不同恢复阶段不同土层土壤微生物多样性变化特征Table 5 Characteristics of soil microbial diversity in different soil layers (mean±SD, n=3) (nmol·g-1)
注:—表示采用PLFAs未检测到的微生物菌群的相对含量。
Note: — indicate the relative content of microbial functional communities that were not detected by PLFAs.

图2 植被修复年限下土壤微生物量碳、氮、磷的变化Fig. 2 Changes of soil microbial biomass carbon, nitrogen and phosphorus in two soil layers 不同小写字母代表年限之间差异显著,不同大写字母代表土层之间差异显著(P<0.05)。The different lowercase letters indicate significant differences between restore year;The uppercase letters indicate significant differences between soil layers (P<0.05).
沙地不同修复年限和不同土层对微生物量碳、微生物量氮、细菌、真菌、放线菌含量变化均具有显著影响(P<0.05)。修复年限对微生物总量变化具有显著影响(P<0.05),但对真菌含量变化影响不显著,土层因素对微生物生物量(碳、氮、磷)变化具有极显著影响(P<0.01),对微生物多样性(微生物总量、细菌、真菌、G-菌、G+菌)含量变化影响不显著(表6)。
土壤有机质、全N、全P 含量与微生物生物量和微生物总量及细菌呈极显著的正相关关系(P<0.01);pH与有机质、微生物总量、细菌含量极显著负相关(P<0.01),与全N、G-菌、G+菌含量变化显著负相关(P<0.05,表7)。

表6 土层、沙地土壤微生物生物量及多样性在不同修复年限和土层之间的差异Table 6 Two-way ANOVA for the effects of soil layer, restore year and their interactions on microbial biomass and diversity
3 讨论
3.1 沙地草本修复过程中地上植被变化
高寒半湿润沙化草地植被调查研究发现,随修复年限的增加,地上植被盖度显著增大,物种多样性显著增多(P<0.05);物种数从未修复的4种,增加到修复4年后的14种;沙地修复前主要以赖草、沙蒿、以礼草等多年生耐旱植物为主,而修复初期人工种植草本的介入增加了生态系统中植物个体数量,一年生燕麦作为沙地修复的前期物种,在人工种植2年后消失,这可能是由于草本修复初期,燕麦是一年生植物,生长速率快,在牧草恢复过程中,作为前期物种,涵养土壤水分,维持沙土稳定[30-32],随着沙地修复过程中土壤养分、水分等条件的改善,外来入侵物种在生态系统中数量增多,植被盖度显著增大(P<0.05)[33],燕麦和外来沙地适应性物种发生竞争,土壤养分、水分、生态位等条件的有效限制,使燕麦逐渐退出生态系统。这与左小安等[34]在科尔沁沙地研究结果相似。

3.2 土壤养分变化对沙地修复过程的响应
高寒沙地在人工种植草本条件下逐渐恢复,且土壤pH及基础养分也随之发生变化。土壤有机质含量在恢复4年后显著高于未修复沙地,且 0~10 cm土层含量大于深层(10~20 cm) (P<0.05)。沙地修复初期,人为干扰引起沙地土壤理化性质改变,沙地外来入侵物种增多,并且地表开始出现结皮[35];此外,人工种植草本对土壤养分利用较大,特别是一年生燕麦由于生长周期短,生长速度快,对沙地土壤有机质、矿物质等消耗迅速。修复3至4年后,地表凋落物增多,在微生物的作用下,形成大量腐殖质,土壤中有机质含量与未治理相比升高了55%。齐文娟等[36]在青海省果洛州建植6年的人工草地发现土壤有机质随建植年限的增加呈现先降低后增加的趋势,这与本研究结果一致。其原因是沙地修复过程中,高寒沙地由于受到环境及人为因素的影响,在植被恢复过程中,养分循环和积累与系统自我调节过程较为缓慢,因此,沙地养分变化呈现先降低后增加的趋势。
3.3 沙地修复过程对土壤微生物含量变化的影响
随着修复年限的增加,两土层土壤微生物生物量及多样性均呈现先降低后增加的趋势。这与杨希智等[37]在青海省的研究结果一致。出现这一现象的原因是:草本种植前,沙地群落物种组成单一,群落结构简单且较稳定,而在人工草本种植后,沙地修复初期,人工草本和入侵杂草对沙地土壤养分利用加剧,土壤肥力迅速下降,微生物可利用养分、水分等含量减少,使微生物生物量和多样性显著降低(P<0.05);修复3至4年后,随着燕麦等一年生植物凋亡,沙地草本凋落物归还土壤表层,微生物可利用的养分增多[38]。微生物群落以细菌为主,出现显著增加的趋势,微生物生物量增多(P<0.05),且表层微生物生物量碳、氮、磷含量显著高于深层土壤。此外,在修复4年后发现10~20 cm土层真菌含量显著低于未修复水平,原因可能是沙地恢复时间较短,凋落物主要分布在土壤上层,下层土壤中有机质与矿物质含量较低,导致真菌主要集中于土壤表层[39]。高寒沙化地区草本修复主要受该地区土壤环境的影响,特别是在特殊的降水条件下,草本生长和土壤微生物之间的关系可能受到土壤养分及pH等条件的限制,因此需要考虑降水引起的土壤中有机质、矿物质等含量的变化,更多的研究需要用于对该区域长期土壤环境动态变化的探索。
土壤微生物与土壤养分变化密切相关,地上植被的变化可调控土壤养分的变化,进而影响土壤微生物生物量和多样性的变化。研究发现通过人工建植草地,在沙地修复后土壤微生物群落显著增加[37],且土壤养分影响土壤微生物的变化,较适的土壤养分有利于植物生长和土壤微生物群落繁殖[40]。本研究中,微生物生物量与土壤养分变化差异显著(P<0.05),但微生物群落主要以细菌为主,此外,土壤微生物通过提高土壤聚集性间接影响养分循环,从而稳定土壤中有机质及矿物质含量[41],且由于土壤细菌和真菌两种微生物独特的生理特性对土壤理化性质的不同响应,其相对丰度和活性的变化也可能会影响土壤养分的循环和积累,进而引起土壤肥力的变化,但具体机理还需进一步研究。
4 结论
利用人工种植混合草本对高寒沙地进行沙化治理,修复4年后,地上植被盖度、物种数、土壤有机质含量显著增大;沙地微生物及土壤养分含量随修复过程先减少后增加,且微生物主要以细菌为主。微生物量氮在修复4年后显著高于未修复水平;革兰氏阴性菌(G-)、革兰氏阳性菌(G+)、真菌、放线菌在沙地修复第1年显著降低,修复3年后,沙地中再次检测到4种微生物菌群,4年后,土壤微生物与土壤全N,全P含量均恢复到未修复水平,且沙地土壤有机质含量显著增高。在高寒半湿润沙地进行人工种植草本对沙化草地修复具有促进作用。
