紫茎泽兰内生真菌及其根际土壤真菌的多样性研究
2019-09-24周婕苗一方方楷陈林杨志平董星凡张汉波
周婕,苗一方,方楷,3,陈林,3,杨志平,董星凡,张汉波,*
紫茎泽兰内生真菌及其根际土壤真菌的多样性研究
周婕1,2,苗一方1,2,方楷1,2,3,陈林1,2,3,杨志平1,2,董星凡1,2,张汉波1,2,*
1. 云南大学生命科学院, 昆明 650091 2. 云南大学省部共建云南生物资源保护与利用国家重点实验室, 昆明 650091 3. 云南大学生态与环境科学学院, 昆明 650091
采用传统分离培养技术和高通量测序技术, 系统研究了入侵植物紫茎泽兰不同组织内生真菌及其根际土壤真菌的物种组成差异。培养法选用三种培养基, 从其根、茎、鲜叶、腐叶等组织片段和根际土壤分离获得了140个菌株。这些真菌在97%的ITS序列同源水平下分划为43个OTUs (operational taxonomic units), 属于5个纲、30个属, 优势纲为Sordariomycetes和Dothideomycetes, 各占总分离菌株数的52.86%和30.00%。前6个优势属分别为(23.57%)、(10.71%)、(8.57%)、(6.43%)、(5.71%)、(5.71%), 占总分离菌株数的60.71%; 不同植物组织之间以及根际土壤之间的真菌群落组成差异明显, Shannon多样性指数在1.37—2.46之间。高通量测序获得了112802个序列, 在97%的ITS序列同源水平下划分为个4216个OTUs, 前6个优势种属分别为(19.81%)、(11.18%)、(5.10%)、(4.75%)、(3.27%)、(2.58%), 占测序数的46.69%, Shannon 指数在0.98—4.84之间。两种方法获得的真菌群落组成具有显著差异, 仅为共有优势属,但所揭示的不同分离来源的真菌组成情况是一致的, 即植物根、茎、鲜叶、腐叶之间内生真菌群落组成差异明显, 具有组织特异性。根际土壤与根内生真菌群落组成存在一定程度的相似, 说明两者之间联系紧密。研究结果表明, 紫茎泽兰的内生真菌具有较高的多样性, 高通量测序技术能更加全面地反映植物内生真菌的物种组成及多样性信息。
紫茎泽兰; 内生真菌; 物种多样性; 高通量测序; 组织特异性
0 前言
在陆地生态系统中, 植物与微生物组成了一个共生体。一方面, 微生物对植物的生长和生存具有重要影响, 在植物多样性和群落组成方面发挥着关键性作用, 被认为是植物在外界环境中附加基因和功能的储存库[1]; 另一方面, 植物也可以调节相关微生物的群落结构和多样性[2]。植物内生真菌是指在植物体内完成其生活史的部分或者全部, 分布于植物各个组织和器官中, 但又不引起任何病症的微生物, 与植物是一种互利互惠的共生关系[3]。大量研究显示, 植物的内生真菌可以提高宿主植物对养分的吸收能力[4], 增强对胁迫环境的抗性[5], 抵御病虫害[6]。当然, 植物内生真菌也受到宿主种类以及环境因素的影响[7]。
近年来, 有研究工作表明宿主同当地微生物形成的新关系决定了外来植物的竞争力[8]。大多数情况下, 根际土壤微生物对本地植物的生长是不利的, 表现为“负反馈调节作用”, 然而却能促进外来植物的生长, 从而提高其竞争力[9–10]。此外, 内生真菌也能影响外来植物的入侵。例如, 北美入侵植物矢车菊()的成功入侵部分归于链格孢属 () 内生真菌对其竞争能力的增强[11]; 内生真菌()也促进了高羊茅()的入侵[12]。
紫茎泽兰()属菊科泽兰属多年生草本植物, 原产于中美洲的墨西哥和哥斯达黎加一带[13]。自20 世纪40 年代从中缅边境传入云南省后, 以每年约20 公里的速度向东、向北入侵, 目前已在我国西南地区广泛分布, 并有进一步入侵我国东部地区以及整个长江以南各省区的趋势, 防治形势极其严峻[14]。紫茎泽兰的入侵给我国的农业、林业、畜牧业、生态环境和人畜造成了极大的威胁[15]。目前关于紫茎泽兰的入侵机理研究集中在化感作用[16]、土壤养分的改变[17]、土壤微生物群落的组成[18]。少数研究报道了其叶内生真菌的组成[19–21], 但关于其内生真菌在不同组织的物种组成和多样性尚未见报道, 也没有系统关于其地上部分、地下部分内生真菌和根际土壤真菌的组成差异的研究。这极大地限制了人们对内生真菌在紫茎泽兰入侵过程中扮演的作用机制的了解。
本研究以云南省昆明西山森林公园内严重入侵区域的紫茎泽兰为对象, 结合传统分离培养技术和 Illumina MiSeq 第二代测序技术, 系统研究了其根际土壤以及根、茎、叶等各组织内生真菌的组成情况, 为未来探讨这些真菌的来源、传播方式以及对其竞争力的影响机理等奠定基础。
1 材料与方法
1.1 样品采集
2015 年 8 月于云南省昆明市西山森林公园内(102°22¢12¢¢E, 24°30¢36¢¢N), 随机采集三株健康紫茎泽兰植株的根、茎、鲜叶、腐叶以及根际土壤样品。鲜叶采集健康植株的内生菌物种数较高的第四对叶片[19]。采集的组织和土壤样品放于无菌聚丙烯袋中, 低温保鲜, 于 24 h 内进行真菌分离。
1.2 真菌分离与纯化
1.2.1 培养基配方
利用 3 种选择培养基 MEA(2%麦芽浸膏琼脂培养基)、NS(镰刀菌选择性培养基)以及 ZY(紫茎泽兰植物营养液培养基)进行真菌分离培养。(a) 2%麦芽浸膏琼脂培养基(MEA): 麦芽浸膏 0.6 g, 大豆蛋白胨 0.06 g, 琼脂 18 g, 加去离子水补足至 1000 mL[22]。(b) 镰刀菌选择培养基(NS): 磷酸二氢钾(KH2PO4) 1 g, 硫酸镁(MgSO4·7H2O)0.5 g, 蛋白胨 15 g, 琼脂 20 g, 加去离子水补足至 1000 mL; 灭菌后冷却至 55 ℃, 加入PCNB (Terraclor 75%)1 g, 硫酸链霉素 0.3 g, 硫酸新霉素 0.12 g[23]。(c) 植物营养液培养基(ZY): 采集新鲜健康的紫茎泽兰茎叶 200 g, 剪碎, 加去离子水煮约 30 分钟后过滤, 在滤液中加蔗糖 15 g, 琼脂 18 g, 加去离子水补足至 1000 mL[24]。
1.2.2 真菌分离和培养
(1)植物组织样品 植物内生真菌参考叶片段法进行[22], 首先将植物材料用流水清洗, 剔除有伤材料, 再分别取紫茎泽兰叶片、茎秆、根进行表面消毒, 用70%乙醇依次浸泡 2 min, 3 min, 5 min, 0.5%次氯酸钠依次浸泡 2 min, 5 min, 5 min, 最后分别用无菌水冲洗 6 次, 无菌滤纸片吸干。剪成 2 x 2 mm2的小片段分别接种于2% MEA、NS 和ZY 三种类型的培养基上, 每种培养基 3 个重复, 每皿放置 16 段。
(2)土壤样品 通过常规土壤稀释分离法进行。称取10 g新鲜土样, 放入盛有100 mL无菌水的三角瓶中, 28 ℃, 180 r·min–1, 摇瓶30 min使土壤充分打散, 制成10–1、10–2、10–3悬液, 分别吸取0.1 mL 土壤悬液注入2% MEA、NS 和ZY 培养皿上, 涂布均匀, 静置5—10 min。每个稀释度涂布3 个重复。
将上述所有培养皿置于28 ℃培养箱中倒置培养, 从第3 天开始连续观察统计菌落的数量和形态。挑取典型的菌株, 分离纯化并单菌落斜面保存, 4 ℃保存备用。
1.2.3 高通量测序
将上述获取的植物材料和根际土壤样品直接装入灭菌的管子, 经液氮快速降温保存, 每个样品重复三次, 送上海欧易公司进行高通量测序。
1.3 真菌鉴定
(1) 形态观察 采用经典的形态学方法进行内生真菌归类, 通过观察菌落的颜色、菌落形态、菌丝分枝以及孢子的有无、大小、形状和产孢结构类型等特征, 将真菌初步分类后进行分子鉴定。
(2)分子鉴定 将归类的内生真菌, 采用 CTAB 法提取基因组 DNA, 并用通用引物 ITS 4 和ITS 5 进行 PCR 扩增, PCR 产物送至华大基因公司测序。所得序列使用软件Bioedit 和SeqMan 7.1.0、Editseq 进行序列比对、校正和整合, 使用软件Clustal X2 统一截取, 计算并构建距离矩阵, 再运行 Mothur 软件进行OTU 聚类划分; 高通量测序利用 UPARS 算法进行OTU 聚类; 本实验以 97% 的相似度作为分类标准。随机选取每一个OTU 的代表序列, 并在NCBI 中进行同源性分析, 确定菌株种属关系。
1.4 数据统计分析
Shannon多样性指数¢=–∑ln(), 其中为属(或种)级真菌数量占群落个体总量的比例, ln 表示的自然对数[25]; 利用 Mothur 软件做稀释曲线分析, 预测样本在给定测序深度下, 所可能包含的物种总数及其中每个物种的相对丰度[26–27]; 利用非加权组平均法(UPGMA)揭示样本间或者组间的系统分类情况; 利用相似性系数(Similarity Coefficient)描述两个样本间的内生真菌物种组成的相似程度。=2/ (+), 其中为两样本间共有的内生真菌种类数,,分别为不同的单个样本内的内生真菌种类数。
2 结果与分析
2.1 菌群结构和组成分析
通过培养法从紫茎泽兰各组织(叶、茎、根、腐叶)和土壤样品中共分离得到140 株真菌, 根据其 ITS 序列在 97% 的相似水平, 共划分为 43 个OTUs, 分属于 5 个纲、30 个属, 优势纲为Sordariomycetes 和Dothideomycetes, 各占总分离菌株数的52.86%和 30.00%, 前 6 个优势属分别为(23.57%)、(10.71%)、(8.57%)、(6.43%)、(5.71%)、(5.71%), 占总分离菌株数的 60.71%。高通量测序共得到 112802 条序列, 分为 4216 个OTUs。结果显示, 高通量测序所得真菌具有较丰富的种群多样性, 且优势种属分离与培养法存在不同,(19.81%)、(11.18%)、(5.10%)、(4.75%)、(3.27%)、(2.58%)为其前 6 个优势种属, 占总分离菌株数的 46.69%, 仅有优势种属与培养法是共有的。
2.2 不同分离来源的真菌多样性和物种组成
2.2.1 不同分离来源的真菌多样性
培养法获取的不同分离来源的真菌数目在 6—26 个OTUs之间, 鲜叶的 Shannon 多样性指数最高为 2.46, 根的最低为1.37。而高通量测序所得OTU 数在 372—1951之间, Shannon 指数最高的是腐叶为 4.84, 根和鲜叶次之, 分别为 3.96 和 3.52 (表 1)。从高通量测序的物种稀释曲线来看, 随着抽样深度的加深, 多样性不断增加, 在抽样深度为 1500 条序列时, 各个样本的 Shannon 多样性指数趋于平缓, 说明已达到较好的测序深度(图 1)。此外, 聚类分析表明土壤真菌群落和紫茎泽兰根内生真菌的来源一致; 紫茎泽兰叶、茎、腐叶的内生真菌的组成更相似(图 2)。
2.2.2 不同分离来源的真菌物种组成
培养法获取的真菌归为 30 个属(图 3)。不同分离来源的物种组成和优势属不同, 其中, 鲜叶的种属最多, 共有 20 个属, 占总分离种属的 66.67%。优势属在不同来源的分布也有明显差异, 根和土壤的优势属分别为和;虽然在根、茎、鲜叶和腐叶中均有分布, 但在鲜叶中的优势特别明显;与倾向于分布在植株地上的部分包括茎、鲜叶和腐叶, 但主要集中在腐叶上, 而主要集中在茎中。
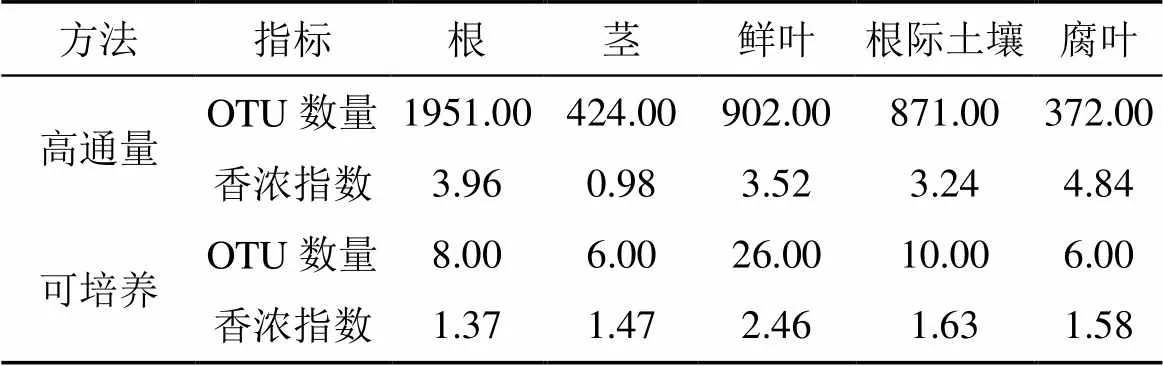
表1 不同植物组织、根际土壤的真菌多样性和OTUs数量统计
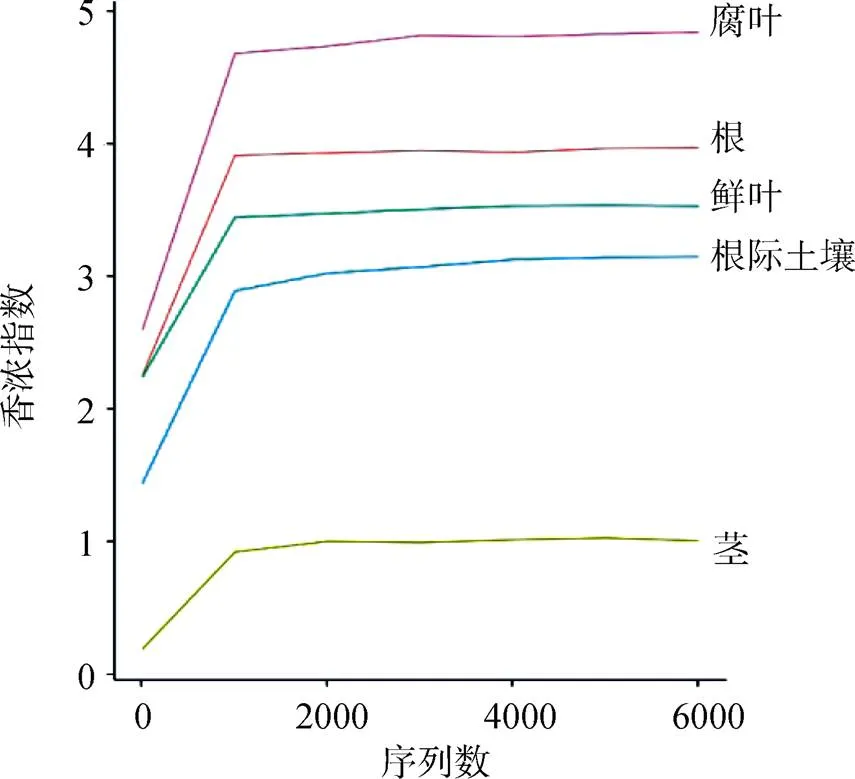
图1 各样本稀释曲线
Figure 1 Rarefaction curves for all samples
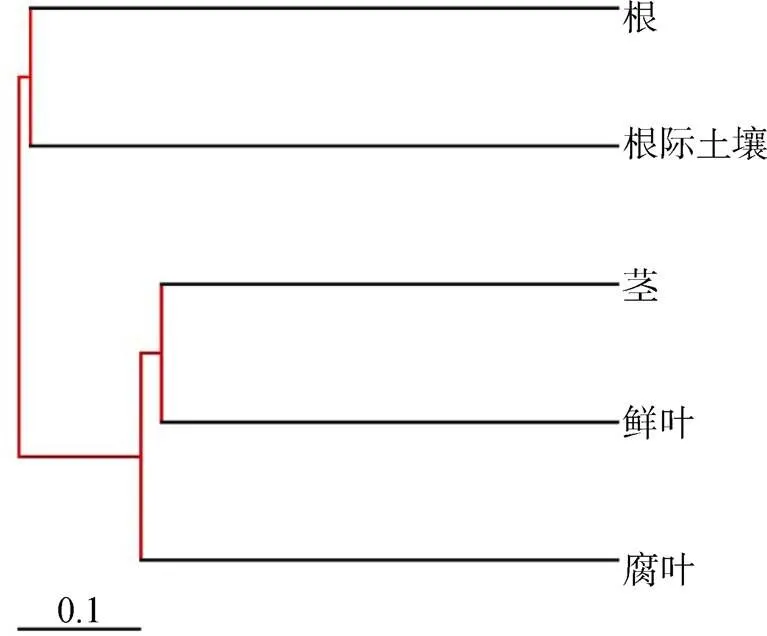
注: Bray—Curtis可靠性Support分析, 采取重叠随机抽样算法, 对Bray—Curtis的可靠性进行分析。图中红色部分代表可靠性支持为75%—100%。
Figure 2 Cluster analysis of all samples obtained by high throughput sequencing
虽然高通量技术得到的群落结构与培养法具有明显差异(图 4), 但也表明来自植株不同组织和土壤的物种组成和优势属是不同的。从数量排在前 30 的真菌属来看,、、这三种真菌在所有样本中都广泛分布, 但鲜叶中主要是和; 根际土壤中主要是; 茎和腐叶中更为显著。此外, 一些内生真菌还具有明显的组织特异性, 如和仅分布于根组织中且数量优势; 而和只在腐叶中得到。
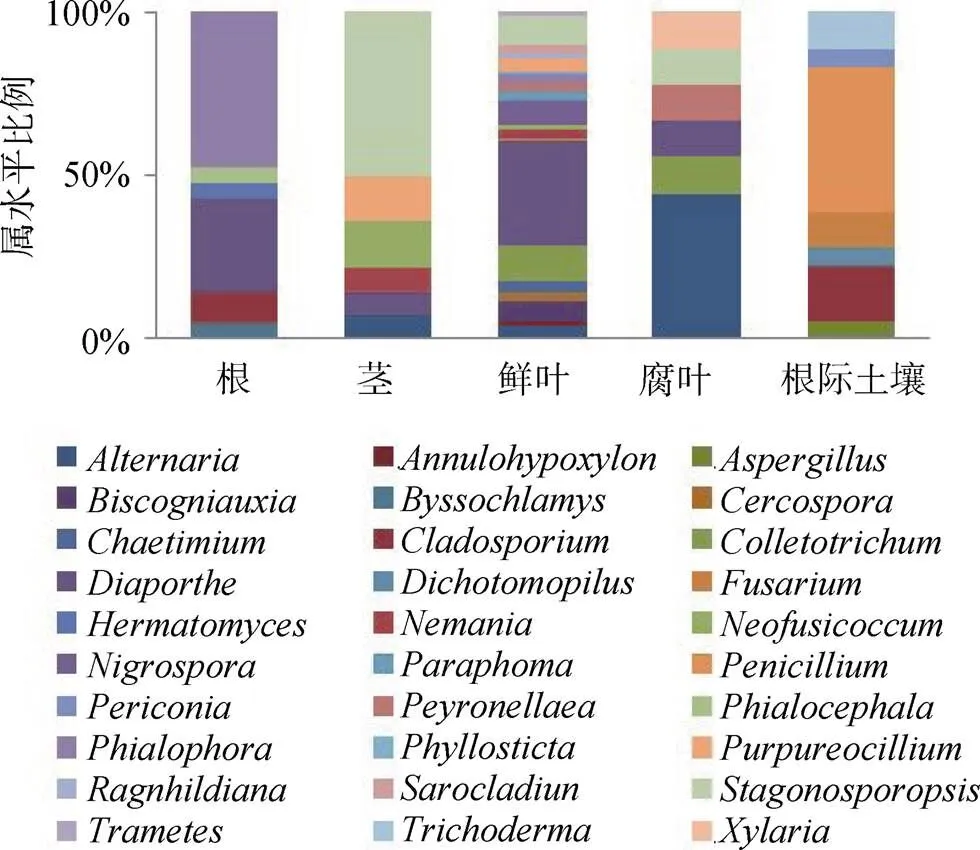
图 3 纯培养群落结构分布柱状图
Figure 3 Histogram of fungal community structure obtained by culture-dependent method
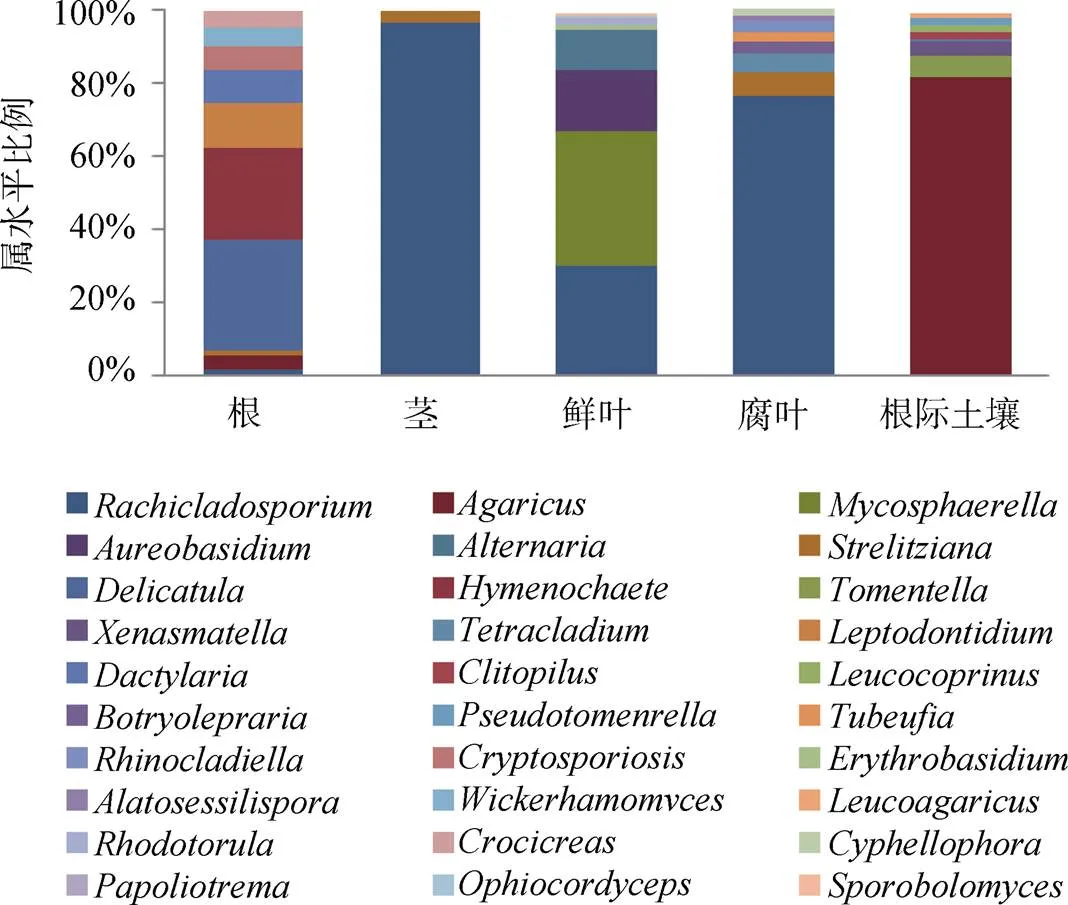
图 4 高通量测序群落结构分布柱状图
Figure 4 Histogram of fungal community structure obtained by high throughput sequencing
2.3 不同培养基分离的真菌组成和多样性
NS、ZY和MEA三种培养基分离出的真菌种类分别为 17、17 和 23, 各占总分离种属的 56.67%、56.67%和76.67%(图 5)。三种培养基的 Shannon 指数分布在 2.6—2.8 之间, 按照MEA > NS > ZY大小排列(表 2)。不同培养基间的相似性指数分布在 0.5—0.71 之间, 培养基间的相似指数都较高, 说明不同培养基间菌群的组成差异较小(表 2)。NS、ZY 和MEA 三种培养基均分离出的属共有 9 种, 包括、、、、、、、、, 其中在 NS、ZY、MEA 三种培养基上优势极为明显, 各占 21.95%、27.27% 和 21.82%。NS 培养基分离的真菌优势种还包括(12.20%)、(9.76%), 且仅在 NS 培养基上为优势种。ZY 培养基分离的真菌优势种包括(18.18%)、(11.36%)、(10%); MEA 培养基分离的真菌优势种包括(12.73%)、(10%)。
3 讨论
本研究首次结合高通量测序技术与传统培养法来研究入侵植物紫茎泽兰不同组织和根际土壤的真菌组成。两种方法获取的真菌结果有明显差异, 前者能更加全面反映紫茎泽兰内生真菌的物种组成及多样性信息。不过, 尽管高通量测序信息量大, 但大量序列无法得到准确的物种归类; 其次, 该方法也无法获得活菌体, 阻碍了下一步的功能验证实验。传统培养法由于受培养条件的限制, 获取的真菌种类较少, 低估样品的多样性。但因其成本低以及可获得活菌体等特点, 对下一步的功能验证实验具有重要意义。
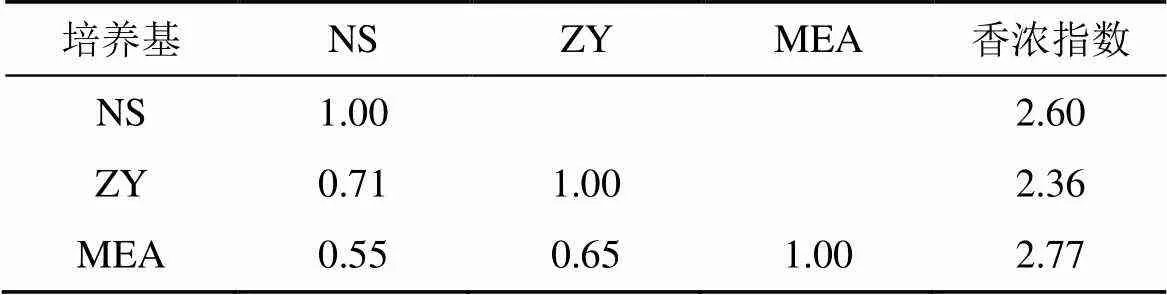
表2 不同培养基获取的真菌多样性相似性比较
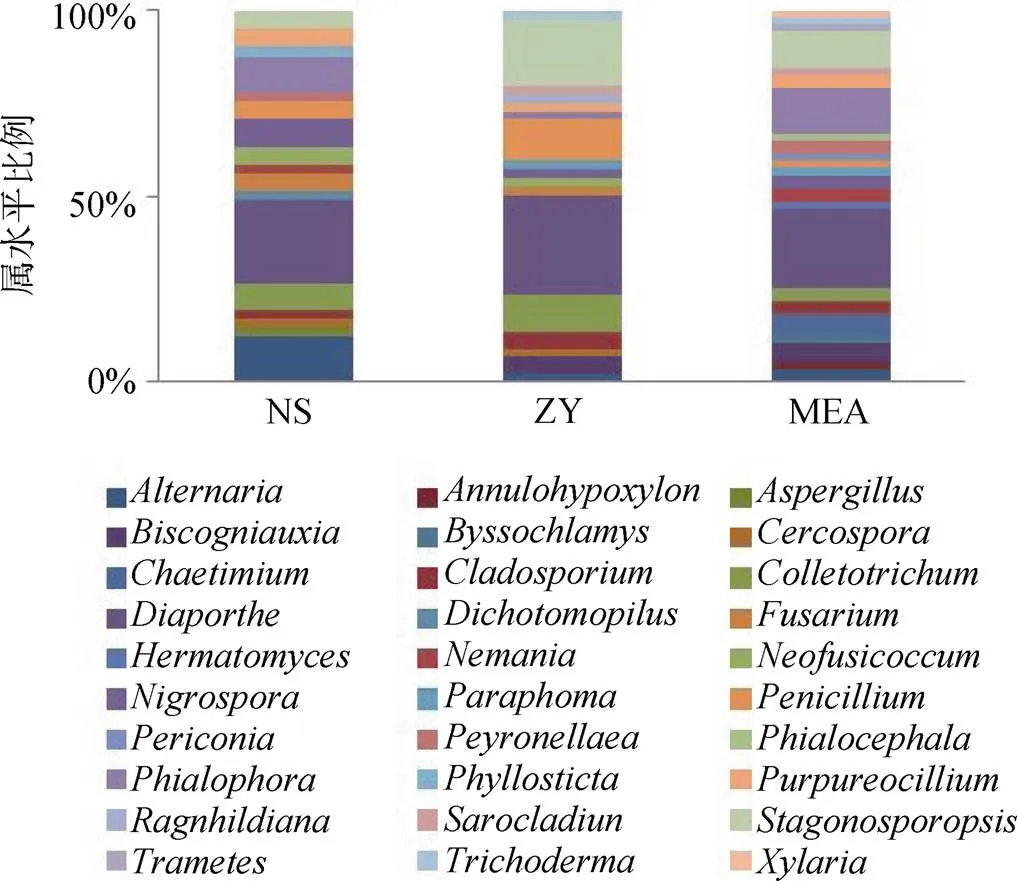
图 5 不同培养基获得的真菌群落结构分布柱状图
Figure 5 Histogram of community structure obtained by different culture media
有趣的是, 尽管两种方法获得的内生真菌种属上有巨大差异, 但都观察到了属真菌(图 3, 4)。在早期有关紫茎泽兰叶内生真菌[21]和叶病斑真菌[28]的报道中, 该真菌都大量存在。其次, 两种方法都表明紫茎泽兰不同组织部位的内生真菌物种组成差异明显, 优势种群也有所不同, 表现出一定的组织特异性, 这可能是由于外部环境和宿主两者共同作用的结果。比如, 通过培养法得到的叶优势内生真菌主要是和等(图 3), 与潘田扬等报道的紫茎泽兰叶内生真菌相比, 优势种属相似, 但群落组成存在差异, 这可能与采样的不同环境气候因素有关[21]。高通量测序获得的紫茎泽兰根内生真菌和其根际土壤真菌的种属组成有很大相似性, 支持早期的观点, 即根际土真菌由于与根密切接触, 在长期的相互作用过程中有机会选择性地进入到植物体内成为内生真菌[29]。但培养法的结果表明, 紫茎泽兰根际土壤真菌优势种属主要为、、、, 其中仅与根内生真菌有重叠, 这可能是根际土壤和根系的可培养菌群种类存在差异, 导致两者的相似度较低。
聚类分析结果表明紫茎泽兰茎、叶、腐叶等地上部分的内生真菌相似, 有别于地下部分真菌如根内生真菌和根际土壤(图 2)。从物种组成来看, 培养法分离的腐叶内生真菌优势种为,、和等, 与鲜叶和茎中的种属也有重叠(图 3)。这些结果表明, 尽管叶内生真菌随叶片枯萎、凋落于土壤表面, 但由于土壤环境并不适合其繁殖或存活, 这些真菌并未广泛进入到土壤, 反而可能通过感染紫茎泽兰的新芽或新生苗, 从而定植于地上部分。这些叶内生优势真菌是否确实可能通过腐叶进行传播, 使其成为一种有别于土传和气传的传播途径和载体, 有待未来进一步的研究验证。
传统培养方法受培养基的种类影响很大[30]。本研究中采用的 NS、ZY 和 MEA 三种培养基分离效果差异主要表现在优势类群的丰度上, 而对物种结构影响较小(表 2, 图 5)。相较于 NS 和 ZY 培养基, MEA 培养基分离的真菌数量和多样性都略高于前两者, 与早先的报道一致[21]。由于 MEA 培养基配方较为简易, 成分相对稳定[31], 因此在分离紫茎泽兰内生真菌的研究中, 建议选择 MEA 培养基。
本次研究的紫茎泽兰种群仅采自昆明地区, 样地较为单一。虽然紫茎泽兰叶内生真菌在不同地理和入侵历史尺度下表现差异[20], 但在这些背景变化下紫茎泽兰不同组织器官的内生真菌物种组成是否也呈现相似的规律性变化还有待进一步探究。最后, 由于紫茎泽兰中分离得到的优势内生真菌如、和等也有大部分的种类作为植物的泛病原真菌广泛存在, 表明紫茎泽兰内生菌与当地植物病原菌之间可能存在一定联系, 它们的角色转换关系以及相关的入侵生态学效应值得进一步深入探索。
[1] VANDENKOORNHUYSE P, QUAISER A, DUHAMEL M, et al. The importance of the microbiome of the plant holobiont[J]. New Phytologist, 2015, 206(4): 1196–1206.
[2] REINHOLDHUREK B, BÜNGER W, BURBANO C S, et al. Roots shaping their microbiome: global hotspots for microbial activity[J]. Annual Review of Phytopathology, 2015, 53(1): 403–424.
[3] PETRINI O. Taxonomy of endophytic fungi of aerial plant tissues[M]//Fokkema N J, Microbiology of the Phyllosphere. Cambridge University Press, 1986:175–187.
[4] ABBASPOUR H, SAEIDISAR S, AFSHARI H, et al. Tolerance of Mycorrhiza infected pistachio (L.) seedling to drought stress under glasshouse conditions[J]. Journal of Plant Physiology, 2012, 169(7): 704–709.
[5] 任安芝, 高玉葆. 内生真菌侵染对黑麦草种子萌发、幼苗生长及渗透胁迫抗性的影响[J]. 植物生态学报, 2002, 26(4): 420–426.
[6] OWNLEY B H, GRIFFIN M R, KLINGEMAN W E, et al.: endophytic colonization and plant disease control[J]. Journal of Invertebrate Pathology, 2008, 98(3): 267–270.
[7] 宁祎, 李艳玲, 周国英,等. 青海上北山林场野生桃儿七根部内生真菌群落组成及多样性研究[J].中国中药杂志, 2016, 41(7): 1227–1234.
[8] PUTTEN W H V D, BARDGETT R D, BEVER J D, et al. Plant–soil feedbacks: the past, the present and future challenges[J]. Journal of Ecology, 2013, 101(2): 265–276.
[9] CALLAWAY R M, BEDMAR E J, REINHART K O, et al. Effects of soil biota from different ranges on Robinia invasion: Acquiring mutualists and escaping pathogens[J]. Ecology, 2011, 92(5): 1027–1035.
[10] GUNDALE M J, KARDOL P, NILSSON M C, et al. Interactions with soil biota shift from negative to positive when a tree species is moved outside its native range[J]. New Phytologist, 2014, 202(2): 415–421.
[11] ASCHEHOUGA E T, METLEN K L, CALLAWAY R M, et al. Fungal endophytes directly increase the competitive effects of an invasive forb[J]. Ecology, 2012, 93(1): 3–8.
[12] RUDGERS J A, MATTINGLY W B, KOSLOW J M. Mutualistic fungus promotes plant invasion into diverse communities[J]. Oecologia, 2005, 144(3): 463–471.
[13] FENG Jianmeng, ZHU Youyong. Alien invasive plants in China: risk assessment and spatial patterns[J]. Biodiversity and Conservation, 2010, 19(12): 3489–3497.
[14] WANG Qi, WANG Chenghaun, ZHAO Bin, et al. Effects of growing conditions on the growth of and interactions between salt marsh plants: implications for invasibility of habitats[J]. Biological Invasions, 2006, 8(7): 1547–1560.
[15] OELRICHS P B, CALANASAN C A, MACLEOD J K, et al. Isolation of a compound from(Spreng.) [(Spreng.)] causing hepatotoxicity in mice[J]. Natural Toxins, 1995, 3(5): 350–354.
[16] 杨明挚, 吕霞, 张婷,等. 入侵植物紫茎泽兰化感作用及其途径研究[J].植物分类与资源学报, 2011, 33(2): 209– 213.
[17] 蒋智林, 刘万学, 万方浩,等.紫茎泽兰入侵对土壤肥力特征的影响及其动态研究[J]. 农业环境科学学报, 2008, 27(1): 267–272.
[18] XU Chanwen, YANG Mingzhi, CHEN Yunjiao, et al. Changes in non-symbiotic nitrogen-fixing bacteria inhabiting rhizosphere soils of an invasive plant[J]. Applied Soil Ecology, 2012, 54: 32–38.
[19] JIANG Huan, SHI Yuntao, ZHOU Zhenxin, et al. Leaf chemistry and co-occurring species interactions affecting the endophytic fungal composition of[J]. Annals of Microbiology, 2011, 61(3): 655–662.
[20] MEI Liang, ZHU Ming, ZHANG Dezhu, et al. Geographical and temporal changes of foliar fungal endophytes associated with the invasive plant[J]. Microbial Ecology, 2014, 67(2): 402–409.
[21] 潘田扬, 殷照青, 李仙杰, 等. 入侵植物紫茎泽兰叶内生真菌多样性研究[J]. 微生物学杂志, 2015(5): 73–78.
[22] ARNOLD A E, HERRE E A. Canopy cover and leaf age affect colonization by tropical fungal endophytes: Ecological pattern and process in T(Malvaceae)[J]. Mycologia, 2003, 95(3): 388–398.
[23] KOMADA H. Development of a selective medium for quantitative isolation offrom natural soil[J]. Review of Plant Protection Research, 1975, 8: 114–124.
[24] 王静, 罗国玖, 蒙远涛, 等. 紫茎泽兰内生菌的分离及其代谢物的除草活性[J]. 江苏农业科学, 2013, 41(5): 99–101.
[25] SHANNON C E. The mathematical theory of communication[J]. M.d.computing Computers in Medical Practice, 1963, 14(14): 306–317.
[26] HECK K L, BELLE G V, SIMBERLOFF D. Explicit Calculation of the Rarefaction Diversity Measurement and the Determination of Sufficient Sample Size[J]. Ecology, 1975, 56(6): 1459–1461.
[27] KEMP P F and ALLER J Y. Bacterial diversity in aquatic and other environments: what 16S rDNA libraries can tell us[J]. FEMS Microbiology Ecology, 2004, 47(2): 161–177.
[28] 屠然, 黎亚洁, 李颖, 等. 入侵植物紫茎泽兰叶斑真菌多样性及其致病性研究[J]. 云南大学学报, 2009, 31(5): 521–527.
[29] 曹晋静. 喜树微生态系真菌多样性及其药化研究[D]. 贵州: 贵州大学, 2009.
[30] 陶诗, 刘一令, 黄小香, 等. 春兰菌根真菌的分离及培养特征研究[J]. 北方园艺, 2010(16): 108–111.
[31] 黄芳, 张春英. 不同消毒和培养基条件对兰花菌根真菌分离的影响[J]. 生物学杂志, 2013, 30(5): 93–95.
Diversity of the endophytic and rhizosphere soil fungi of
ZHOU Jie1,2, MIAO Yifang1,2, FANG Kai1,2,3, CHEN Lin1,2,3, YANG Zhiping1,2, DONG Xingfan1,2, ZHANG Hanbo1,2,*
1. School of Life Sciences, Yunnan University, Kunming Yunnan Province 650091, China 2.State Key Laboratory for Conservation and Utilization of Bio-Resources in Yunnan, Yunnan University, Kunming Yunnan Province 650091,China 3. School of Ecology and Environmental Science, Yunnan University, Kunming Yunnan Province 650091, China
Endophytic and rhizosphere soil fungi of an invasive plantwere investigated by both traditional culture-dependent and high-throughput sequencing techniques. Using three culture media, totally 140 strains were isolated from plant tissue fragments and rhizosphere soil suspension. At the level of 97% of ITS sequence similarity, these fungi were divided into 43 OTUs (operational taxonomic units), belonging to 5 classes and 30 genera. The dominant classes were Sordariomycetes and Dothideomycetes, accounting for 52.86% and 30.00% of the total isolates, respectively. The top six dominant genera were(23.57%),(10.71%),(8.57%),(6.43%),(5.71%) and(5.71%), accounting for 60.71% of the total isolates. The fungal community composition was significantly different among the root, stem, fresh leaves, rotted leaves and rhizosphere soil, and the Shannon’s diversity index ranged from 1.37 to 2.46. At the level of 97% of ITS sequence similarity, 112802 sequences obtained by high-throughput sequencing were divided into 4216 OTUs. The top six dominant genera were(19.81%),(11.18%),(5.10%),(4.75%),(3.27%) and(2.58%), accounting for 46.69% of the total sequences, with the Shannon’s diversity index ranging from 0.98 to 4.84. The composition of fungal community obtained by these two methods was significantly different, and shared only one dominant genus. However, both two methods indicated that the composition of fungal community was significantly different among plant roots, stems, fresh leaves and rotted leaves, with a tissue specificity. Interestingly, the composition of rhizosphere soil and root endophytic fungal community was similar, indicating a high relatedness of these fungi. Our results showed that the endophytic fungi ofhad high diversity. High-throughput sequencing techniques, relative to traditional culture techniques, could reveal more comprehensive and diverse plant endophytic fungal community.
; endophytic fungi; species diversity; high-throughput sequencing; tissue specificity
10.14108/j.cnki.1008-8873.2019.05.001
Q938.1
A
1008-8873(2019)05-001-07
2018-09-21;
2019-05-31
国家自然科学基金(30960077, 31360153)
周婕(1994—),女, 硕士研究生, E-mail: 1015807995@qq.com
张汉波, 男, 云南大学生命科学院, 博士, 教授, 博士生导师, 主要研究方向为微生物生态学,E-mail: zhhb@ynu.edu.cn
周婕, 苗一方, 方楷,等. 紫茎泽兰内生真菌及其根际土壤真菌的多样性研究[J]. 生态科学, 2019, 38(5): 1-7.
ZHOU Jie, MIAO Yifang, FANG Kai, et al. Diversity of the endophytic and rhizosphere soil fungi of[J]. Ecological Science, 2019, 38(5): 1-7.
