偶氮类显色剂的合成及其在口蘑微量铜测定中的应用
2019-09-23苏逸菲汤梦怡徐善东
苏逸菲,汤梦怡,徐善东,李 强,,*
(1.北京林业大学生物科学与技术学院,北京 100083; 2.北京林业大学理学院,北京 100083)
铜是动植物体内非常重要的微量元素,其在人体内有许多生理功能,与人体的造血功能、抗氧化作用密切相关[1-2]。正常成年人体内含铜量为80~150 mg,每日最低的铜摄取量为2~3 mg,缺乏或过剩都会引起生理功能障碍和疾病,可见,对食品中的微量元素铜进行研究具有一定的重要性和必要性[3-5]。为避免缺铜,最重要的就是要充分保证膳食中有足够铜的摄入,以满足身体的需要。口蘑子实体中粗蛋白、粗脂肪、粗纤维等含量丰富;氨基酸种类齐全,含有钾、钠、钙、镁、铜、铁、锌、锰和硒等多种人体必需的矿质元素,其中镁、铜、铁、锌和硒的含量均高于其他常见食用菌子实体[6-7]。口蘑中的铜是人们获取铜元素的重要来源,因此,检测口蘑中的铜含量具有重要意义。
对于铜的测定,常规的检测方法有:电化学分析法、原子吸收光谱法、电感耦合等离子体发射光谱法、分光光度法、原子荧光光谱法等[8-13]。分光光度法具有操作简单、灵敏度高、准确度高、价格低等优点[14-17]。目前,已经有许多显色剂被设计合成并用来检测铜离子。但是,很多报道的显色剂分子结构比较复杂,需要繁琐的合成步骤[18-19]。因此,设计合成结构简单、选择性好的显色剂仍具有一定的挑战性。
偶氮类试剂是目前光度法测定过渡金属元素的高灵敏显色剂,可与多种金属离子发生显色反应,常用于分光光度法测定金属离子含量[20-21]。其中,杂环偶氮类显色剂近年来发展迅速,合成的噻唑、吡啶及喹啉偶氮显色剂测定铜的分光光度法研究已有较多报道[22-27]。而含羧酸偶氮类试剂用于光度法测定铜的研究却较少。乔永生等[28]应用该类试剂进行光度法测定用于铝合金中铜的光度分析,结果理想。为了扩大含羧酸偶氮类试剂测定金属离子的应用范围,探究这类显色剂的分析性能和结构之间的内在联系,本文合成未见报道的3,5-二甲酸-4′-羟基偶氮苯应用分光光度法测定铜。
本文在合成3,5-二甲酸-4′-羟基偶氮苯的基础上,采用IR、1H-NMR和MS确定了其组成和结构,并研究了其UV-Vis的光谱性质。在研究确定3,5-二甲酸-4′-羟基偶氮苯与铜的显色反应条件的基础上,建立分光光度法测定口蘑中铜的含量的方法,以期为3,5-二甲酸-4′-羟基偶氮苯分光光度法在食品中铜检测的应用提供一定的实验依据。
1 材料与方法
1.1 材料与仪器
口蘑 市售;5-氨基间苯二甲酸甲酯 上海澄绍生物科技有限公司;苯酚 北京笃信精细制剂厂;乙酸钠、亚硝酸钠、氢氧化钠、N-N二甲基甲酰胺、无水乙醇、盐酸 北京化工厂;实验用水为二次蒸馏水。
W-100型高速万能粉碎机 天津市泰斯特仪器有限公司;UV-2600型紫外可见分光光度计 上海天美科学仪器有限公司;SHB循环水式多用真空泵 郑州长城仪器厂;PB-10酸度计 赛多利斯科学仪器有限公司;X-4B显微熔点仪 上海仪电物理光学仪器有限公司;330FT-IR傅里叶变换红外光谱仪 赛默飞世尔科技(中国)有限公司;JNM-ECA600型600M核磁共振谱仪 日本电子株式会社;New ultrafleXtreme MALDI TOF/TOF质谱仪 德国布鲁克公司;optima 8X00系列ICP光谱仪 珀金埃尔默股份有限公司。
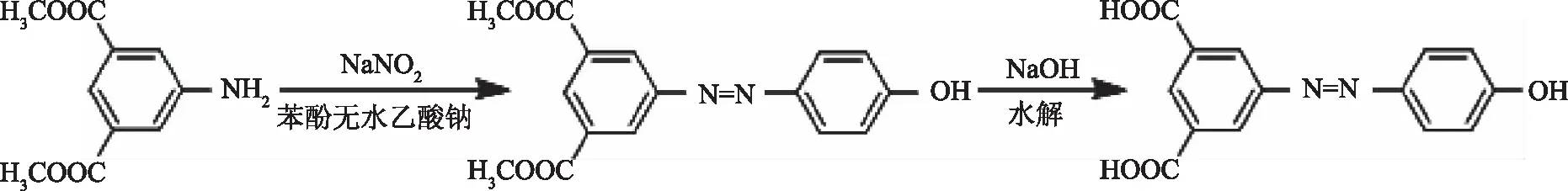
图1 3,5-二甲酸-4′-羟基偶氮苯的合成Fig.1 Synthesis of 3,5-dicarboxylic acid-4′-hydroxyazobenzene
1.2 实验方法
1.2.1 标准溶液的配制 Cu2+标准储备液:称取0.2144 g氯化铜于100 mL烧杯中,加入2.0 mL浓HCl、20 mL蒸馏水溶解移入100 mL容量瓶中,用蒸馏水定容备用;取备用溶液1.00 mL于100 mL容量瓶,用蒸馏水定容备用。其他金属离子储备液溶液配制:CaCl20.1776 g、Pb(NO3)20.5296 g、ZnCl20.2179 g、HgCl20.4344 g、AgNO30.2718 g、FeCl30.2595 g均按照上述铜离子溶液配制方法进行配制。实验用金属离子均为1.6×10-4mol·L-1硝酸盐或氯化物的水溶液。
1.2.2 样品前处理 口蘑(105±3) ℃下烘干10 h后粉碎,按照国标中湿法消解步骤进行消解[29]。称取5.0000 g于带刻度消化管中,加入10 mL 69%硝酸、0.50 mL 72%高氯酸,在可调式电热炉上消解(120 ℃/0.5~1 h、升至180 ℃)。消解至冒白烟,消化液呈无色透明或略带黄色,取出消化管,冷却后用水定容至50 mL,制成样液a,混匀备用。
1.2.3 显色剂的合成与表征
1.2.3.1 显色剂的合成 3,5-二-甲酸甲酯-4′-羟基偶氮苯的合成:5-氨基间苯二甲酸甲酯8.40 g(40 mmol)、NaNO223.1 g(44 mmol)、苯酚4.50 g(48 mmol)、乙酸钠36.1 g(440 mmol),按照文献[30]中的方法进行合成。
3,5-二甲酸-4′-羟基偶氮苯的合成:取上述反应所得3,5-二-甲酸甲酯-4′-羟基偶氮苯于圆底烧瓶中加入50 mL甲醇,60 mL 10% NaOH,在水浴锅中50 ℃条件下反应12 h,最后用37% 浓HCl调至pH=1,抽滤并用水洗涤,真空干燥(45 ℃、3 h)。得黄色固体,称量并用显微熔点仪测得其熔点。
1.2.3.2 显色剂3,5-二-甲酸-4′-羟基偶氮苯的表征 红外光谱:显色剂与溴化钾晶体(约1∶20 的重量比)一起磨细混匀,制成薄片,立即在330FT-IR傅里叶变换红外光谱仪上测定,扫描范围400~4000 cm-1。
紫外光谱:显色剂储备液稀释10倍,以无水乙醇做参比,用UV-2600型紫外可见分光光度计在200~600 nm进行光谱扫描。
核磁共振氢谱:将显色剂溶于CDCl3中,封管,于JNM-ECA600型600 M核磁共振谱仪上测定。
质谱:将显色剂溶于CDCl3中,于New ultrafleXtreme MALDI TOF/TOF质谱仪上测定。
1.2.4 条件的优化
1.2.4.1 波长选择 称取0.0040 g 3,5-二甲酸-4′-羟基偶氮苯,用乙醇溶液溶解在100 mL容量瓶中,配制1.40×10-4mol·L-1储备液。吸取3.00 mL显色剂于10 mL的比色管中,无水乙醇定容,以无水乙醇做参比在200~600 nm进行光谱扫描,记录在λ=320 nm处的吸收强度A0;吸取2.00 mL铜储备溶液于10 mL的比色管中,加入pH=9.18的四硼酸钠缓冲溶液1.00 mL,混匀后加入3.00 mL显色剂,用无水乙醇定容,以无水乙醇做参比,在200~600 nm进行光谱扫描。显色剂与铜形成的物质即为配合物。
1.2.4.2 显色剂用量的选择 在7只10 mL的比色管中依次加1.00、1.50、2.00、2.50、3.00、3.50、4.00 mL显色剂,混匀后用无水乙醇定容至10 mL,以无水乙醇做参比,在分光光度计上测得其在320 nm处的吸光值。
1.2.4.3 其他金属离子选择性的考察 在7只10 mL的比色管中依次加入2.00 mL铅、锌、汞、银、铁、铜储备溶液,3.00 mL显色剂,加入四硼酸钠溶液1.00 mL,用无水乙醇定容,以无水乙醇做参比,在200~600 nm进行光谱扫描。
1.2.4.4 介质酸度的选择 配制邻苯二甲酸氢钾溶液(pH=4.0),混合磷酸盐溶液(pH=6.86)和四硼酸钠溶液(pH=9.18)三种缓冲溶液;配制0.01 mol·L-1的HCl和NaOH溶液。
在7只10 mL的比色管中依次加入2.00 mL铜储备溶液、3.00 mL显色剂,在酸度计pB-10的测量下分别用滴加邻苯二甲酸氢钾溶液(pH=4.00),混合磷酸盐溶液(pH=6.86)和四硼酸钠溶液(pH=9.18)调节pH4、5、6、7、8、9、10,以无水乙醇做参比,在分光光度计上测得其在320 nm处的吸光值,并且计算ΔA。
1.2.4.5 缓冲溶液用量的选择 在7只10 mL的比色管中依次加入2.00 mL铜储备溶液、3.00 mL显色剂,再依次加入四硼酸钠溶液0.50、1.00、1.50、2.00、2.50 mL,无水乙醇定容至10 mL,以无水乙醇做参比,在分光光度计上测得其在320 nm处的吸光值,并且计算ΔA。
1.2.4.6 配位比测定 在5只10 mL比色管中固定显色剂用量,即移取3.00 mL显色剂,通过改变两者的摩尔浓度的组成比,分别设置显色剂与铜离子浓度比为:2∶1、3∶2、1∶1、2∶3、1∶2,即依次移取铜储备液1.25、1.60、2.50、3.75、5.00 mL,然后再依次加入四硼酸钠缓冲溶液1.0 mL,在分光光度计上测得其在320 nm处的吸光值,并且计算ΔA。
1.2.5 方法学考察
1.2.5.1 标准曲线的绘制 在7只10 mL比色管中,依次加入铜储备溶液0.00、0.20、0.60、1.00、1.50、2.00、2.50 mL,加入3.00 mL显色剂,1.0 mL pH=9.18的四硼酸缓冲溶液,混匀后用无水乙醇定容定容,以无水乙醇做参比,在分光光度计上测得其在320 nm处的吸光值,并且计算ΔA。做吸光度差值对铜浓度的标准曲线,求出直线回归方程。
1.2.5.2 检出限、定量限及检测重现性 检出限:移取铜储备溶液2.00 mL于10 mL的比色管中,然后依次加入3.00 mL的显色剂,1.00 mL pH=9.18的四硼酸缓冲溶液,混匀后用无水乙醇定容定容,以无水乙醇做参比,在分光光度计上测得其在320 nm处的吸光值,并且计算ΔA,上述操作重复11次。检出限=3.3σ/S,σ-响应值的偏差,S-标准曲线的斜率。
定量限:用信噪比法确定定量限[31],定量限=10σ/S。
检测重现性:用11次测定的相对标准偏差表示检测重现性(精密度)。
1.2.5.3 回收率的测定 取2只10 mL的比色管中依次移取待测样液a 1.00 mL、3.00 mL显色剂、四硼酸钠溶液1.00 mL,在分光光度计上测得其在320 nm处的吸光值,并且计算ΔA,根据标准曲线计算样品浓度C1。然后再取2只10 mL的比色管中依次移取待测样液a 1.00 mL、3.00 mL显色剂、四硼酸钠溶液1.00 mL,依次加入铜储备液1.00、1.50 mL,无水乙醇定容至10 mL,以无水乙醇做参比,在分光光度计上测得其在320 nm处的吸光值,并且计算ΔA,根据标准曲线计算加标后浓度C2,上述操作重复操作3次。回收率(%)=(C2-C1)×100/加标浓度。
1.2.6 样品测定 移取待测样液a 3.00 mL置于比色管中,然后依次加入3.00 mL显色剂,1.00 mL pH=9.18的四硼酸缓冲溶液,混匀后用无水乙醇定容,以无水乙醇做参比,在分光光度计上测得其在320 nm处的吸光值,并且计算ΔA,上述操作重复操作3次。计算样品中铜含量。
移取待测样液a 3.00 mL置于比色管中,无水乙醇定容,于ICP光谱仪中测定铜离子含量,重复测定三次,计算得样品中铜含量。
1.3 数据处理
红外谱图、紫外谱图用Origin 9.0制图;文中折线图均用Microsoft Excel制图。试验结果以平均值的置信区间[32](置信度为95%)表示即:
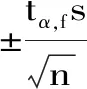
2 结果与分析
2.1 显色剂的表征
最终得3,5-二-甲酸甲酯-4′-羟基偶氮苯9.70 g,产率92.0%,显微熔点仪测得熔点为214.5~215.3 ℃。
2.1.1 红外光谱 红外光谱(KBr压片,cm-1)结果如图2所示。由图2可知,3357 cm-1为羟基的伸缩振动峰,3069 cm-1为苯环上碳氢键的伸缩振动峰,1705 cm-1为羧基上-CO的伸缩振动峰,1594、1503 cm-1为苯环骨架振动峰,1458 cm-1为-N=N-的伸缩振动峰,1214 cm-1为Ar-O伸缩振动峰,850~600 cm-1苯环上碳氢键的弯曲振动峰。由此可见该化合物中含有的官能团有-OH、苯环、-COO-、-N=N-。
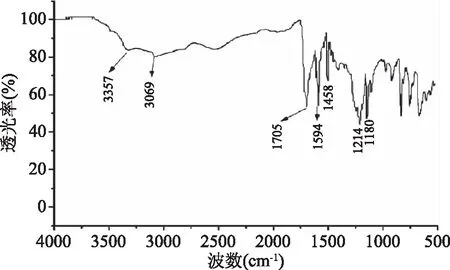
图2 显色剂的红外图谱表征Fig.2 IR spectrum of chromogenic reagent
2.1.2 紫外光谱 紫外可见光谱(乙醇为溶剂)结果如图3所示。由图3可知,λ=203 nm和λ=256 nm的峰值为苯环的E2吸收带和B吸收带,对应苯环的π-π*跃迁。偶氮苯在近紫外区(~350 nm)有一个很强的吸收[18],偶氮苯类化合物的紫外可见吸收光谱会受到苯环上取代基的影响,吸收峰会红移或者蓝移。该显色剂由于苯环上含有羧基和羟基两种取代基,羟基与苯环构成的共轭给电子效应大于羧基的吸电子效应导致显色剂的最大吸收峰会红移[33],所以本实验结果中λmax=357 nm即为偶氮苯键的吸收峰,对应n-π*跃迁,ε380 nm=1.7×105L·mol-1·cm-1。
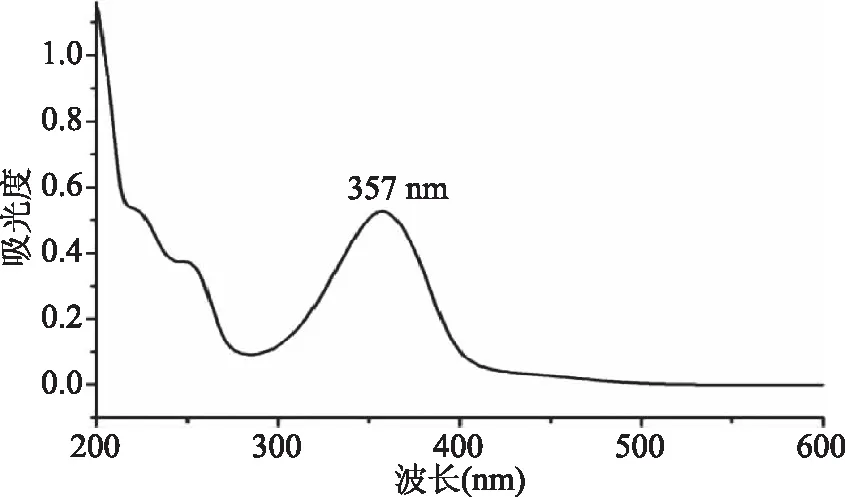
图3 显色剂的紫外图谱表征Fig.3 UV-vis spectrum of chromogenic reagent
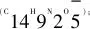
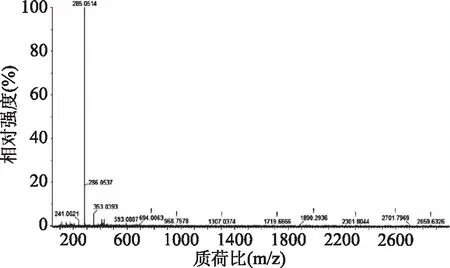
图4 显色剂的质谱图Fig.4 MS spectrum of chromogenic reagent
2.1.4 核磁共振氢谱 核磁共振氢谱(以CDCl3为试剂,600 MHz)结果如图5所示。图5中共有4组峰,第一组峰ppm=8.56,单重峰,氢质子类型为1个H,由于苯环上羧基的吸电子效应使原本苯环上氢的位移移动到8.56,如图中1位置所示;第二组峰ppm=8.50,单重峰,氢质子类型为2个H,由于羧基吸电子效应以及偶氮键的给电子效应,使其化学位移比1号氢红移,如图中2位置所示;第三组峰ppm=7.88~7.91,两重峰,氢质子类型为2个H,由于共轭效应以及苯环上相邻位置上的氢使3号位置上的氢裂分形成两重峰,如图中3位置所示;第四组峰ppm=6.97~6.99,二重峰,氢质子类型为2个H,由于相邻碳上的氢使4号位置裂分成两重峰,如图中位置4所示。理论上酚羟基和羧酸根中的氢应该出现在核磁图谱中,可能由于溶剂中混入少量的碱中和了其中的氢离子。
图5 显色剂的核磁共振氢谱表征Fig.5 1H-NMR spectrum of chromogenic reagent
通过以上的波谱分析,充分证明了3,5-二甲酸-4′-羟基偶氮苯的合成。
2.2 检测条件优化
2.2.1 波长选择 本实验中配合物λmax=380 nm处,原显色剂也有吸收,会对测定结果有干扰。本研究中,根据显色剂及显色剂与Cu2+形成配合物的紫外吸收光谱的特点,改选用λ=320 nm作为工作波长。在该波长下,配合物在λ=320 nm无吸收。因此,只要固定显色剂的用量(一般为过量),先测得显色剂在λ=320 nm处的吸光值A0,再测得加入Cu2+后在λ=320 nm处的吸光值A1,吸光度ΔA=A0-A1即表示为显色剂与Cu2+的反应的量。因此λ=320 nm处显色剂的吸光度差值ΔA=A0-A1,可以作为Cu2+定量分析的依据。
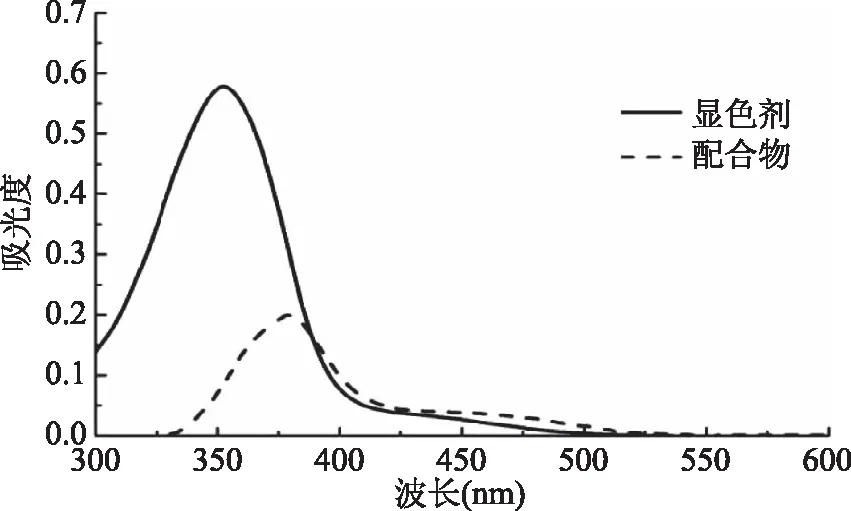
图6 显色剂及其形成的Cu2+配合物的吸收曲线Fig.6 The absorption curve of the chromogenic reagent and the Cu2+ complex formed by chromogenic reagent
2.2.2 显色剂用量选择 中国药典规定:紫外测定中,溶液的吸收度应控制在0.3~0.7范围内,定量分析灵敏度范围好,低浓度的紫外吸收才呈线性[34]。图7实验结果表明,在此范围内选择合适浓度即当显色剂添加量为3.00 mL时,显色剂浓度为4.00×10-5mol·L-1,吸收强度在此范围内。因此本实验中选择显色剂的用量为3.00 mL。
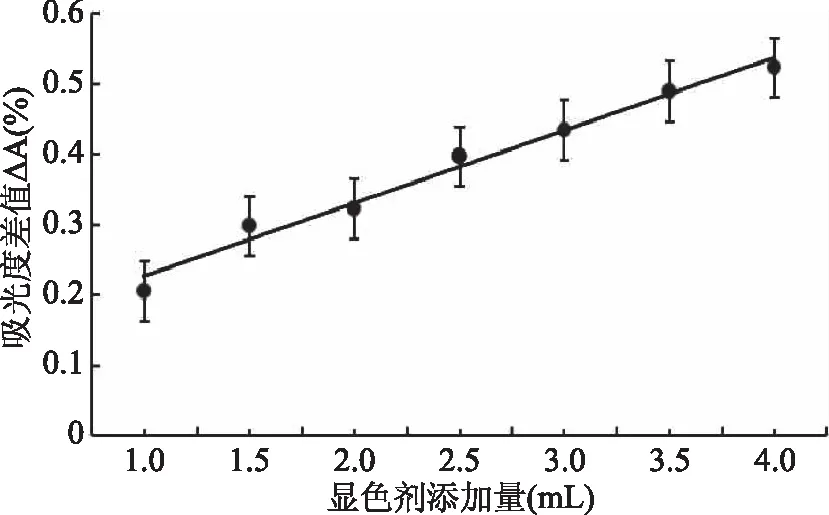
图7 显色剂添加量对吸光度差值的影响Fig.7 Effects of the amount of chromogenic reagent on the difference in absorbance
2.2.3 其他金属离子选择性的考察 图8中可见,Ca2+、Zn2+、Fe3+、Pb2+、Hg+、Ag+这几种口蘑中常见的金属离子和显色剂的混合溶液与显色剂本身的紫外吸收光谱基本一致,表明Ca2+、Zn2+、Fe3+、Pb2+、Hg+、Ag+这几种重金属离子与显色剂均没有反应。因为若形成新的配合物,其紫外吸收光谱应该发生变化。故可以认为以上金属离子对于在320 nm处测定铜离子没有干扰。
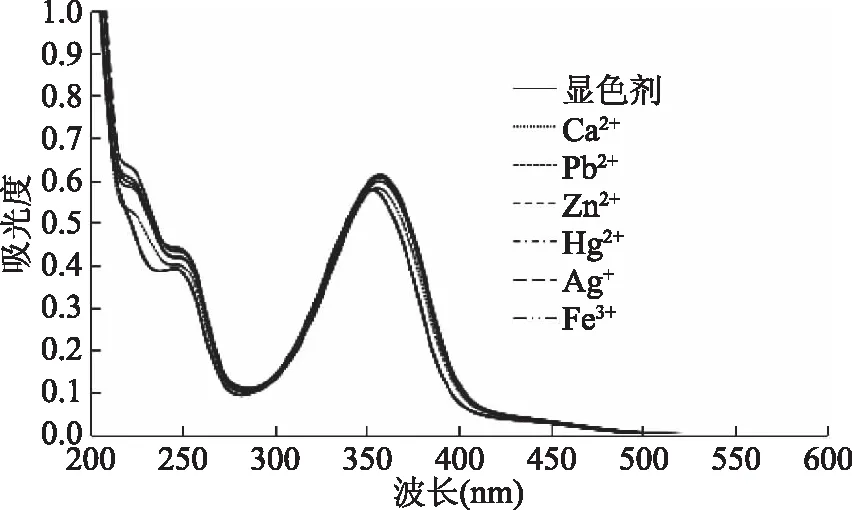
图8 不同金属离子与显色剂反应的吸收曲线Fig.8 Absorptions curves of different metal ions reacting with chromogenic reagent
2.2.4 介质酸度的选择 在pH4.0~10.0范围内,研究了pH的变化对吸光度差值的影响。图9实验结果表明:在所研究的pH范围内,显色剂与Cu2+均能发生显色反应,随着pH的增大,配合物的产率也逐渐增大,并在pH为9.0时,反应体系的吸光度差值最大且基本稳定。可能的原因为显色剂中的羧基在碱性条件下全部生成钠盐,有利于其与Cu2+配位[35]。因此,本实验选用pH为9.18的四硼酸缓冲溶液进行测定。
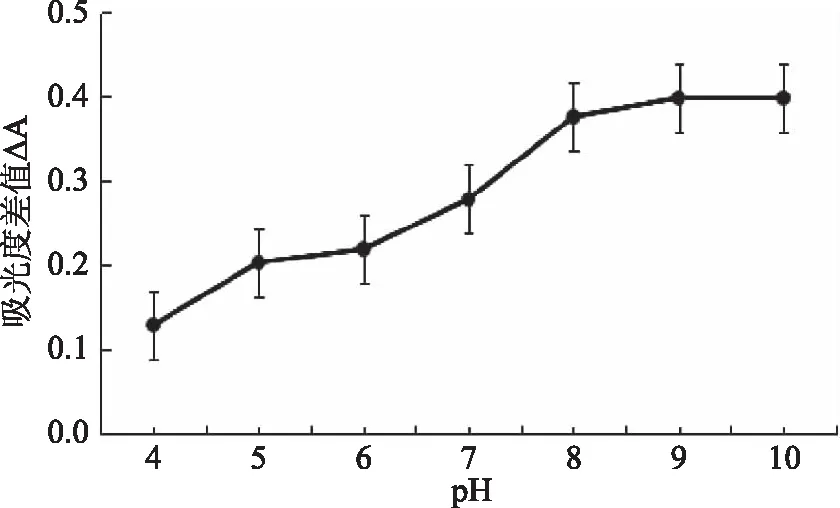
图9 介质酸度对吸光度差值的影响Fig.9 Effects of medium acidity on absorbance difference
2.2.5 缓冲溶液用量的选择 显色剂本身是羧酸类物质,在与Cu2+的配位反应中有H+放出,随着反应的进行,溶液的酸度会增大,酸度的增加会影响已生成配合物的稳定性,也不能满足指示剂变色要求的最适宜酸度范围,导致产生很大的误差,其反应原理相似于EDTA滴定法测定金属离子[36]。因此,在测定中必须加入适量的缓冲溶液。图10实验结果表明,当缓冲溶液用量在0.5~1.00 mL范围内,吸光度差值随着缓冲溶液用量的增加而增大。当缓冲溶液用量大于1.00 mL时,体系吸光度基本稳定。所以,本实验选用四硼酸钠缓冲溶液用量为1.00 mL进行测定。
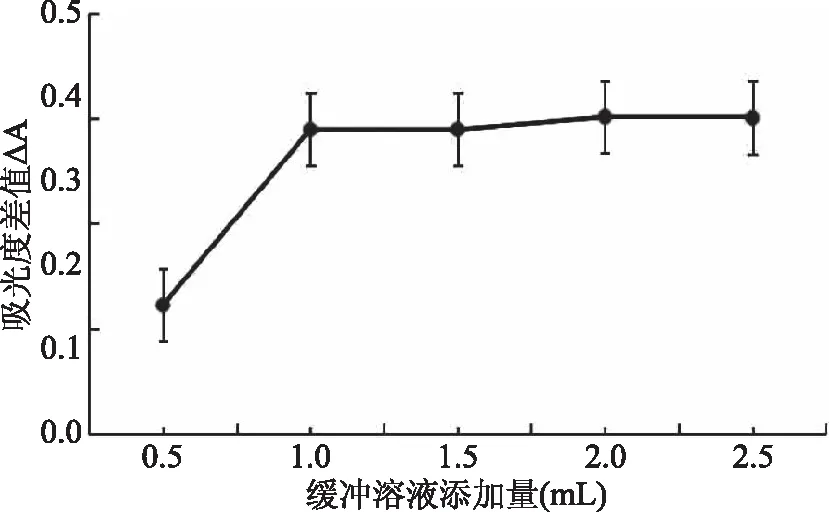
图10 缓冲溶液用量对吸光度差值的影响Fig.10 Effects of buffer solution amount on absorbance difference
2.2.6 配合物络合比的测定 固定显色剂用量,在Cu2+浓度增加的过程中,显色剂会与铜离子反应使显色剂浓度降低,导致显色剂在320 nm处的ΔA增大。当Cu2+浓度增大到与显色剂完全反应时,显色剂浓度降为0,ΔA达到最大。图11实验结果表明,当配位比为1∶1时,ΔA最大且保持不变,说明体系中显色剂已被铜离子所结合,即表明显色剂和铜离子作用的结合比为1∶1。因此,显色剂与铜离子的比例选择为1∶1。
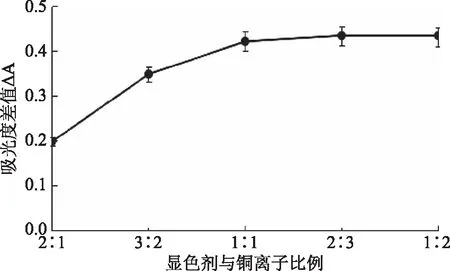
图11 显色剂与铜离子比例对吸光度差值的影响Fig.11 Effects of the ratio of chromogenic reagent to copper ion on the difference in absorbance
2.3 方法学考察结果
2.3.1 标准曲线 以铜离子浓度为横坐标,吸光度A为纵坐标如图12所示,建立标准曲线,在0~2.50 μg·mL-1范围内,铜离子浓度与吸光度有良好的线性关系,符合比尔定律。标准方程为Y=0.1696x+0.0237,R2=0.9921,摩尔吸光系数为4.3×104L·mol-1·cm-1。
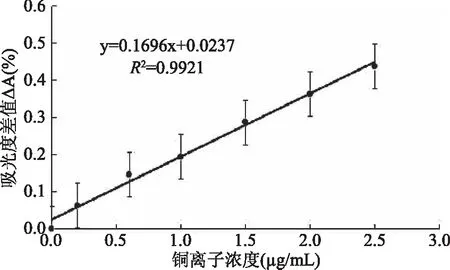
图12 显色剂与铜离子反应的标准曲线Fig.12 Standards curve of reaction between chromogenic reagent and copper ion
2.3.2 检测限及检测重现性 对2 μg·mL-1铜溶液进行了11组平行测定,由表1可见,此方法对铜的检测限为0.064 μg/L,SD值为0.003,RSD平均值为0.93%,表明本方法有良好的精密度。
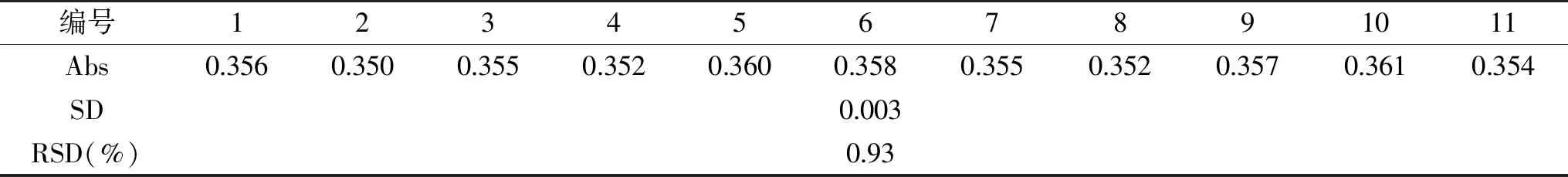
表1 重现性实验结果表Table 1 Reproducibility experiment result table
2.3.3 回收率的测定 为考察方法的可靠性,进行了回收率试验,实验测定了两组样品,每组测定三次,由表3可见回收率在97.0%~101.3%之间,RSD为0.93%~1.50%,证明方法的准确度可以满足分析样品的要求。
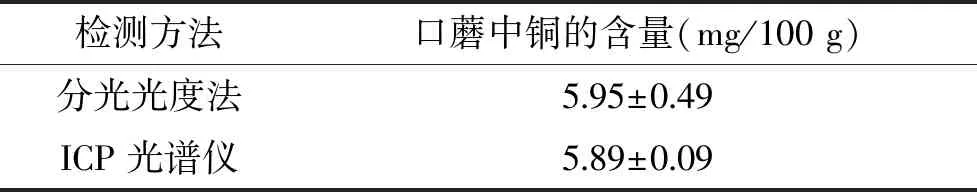
表3 样品检测结果Table 3 Sample test result
2.4 样品测定结果
在上述实验的基础上,对口蘑中铜含量进行了分光光度法检测以及ICP光谱仪检测,结果见表2,其中分光光度法测得口蘑中铜含量为(5.95±0.20) mg/100 g,ICP光谱仪测得口蘑中铜含量为(5.89±0.07) mg/100 g,两种方法测得口蘑中铜含量几乎吻合,表明本实验中此方法可行。
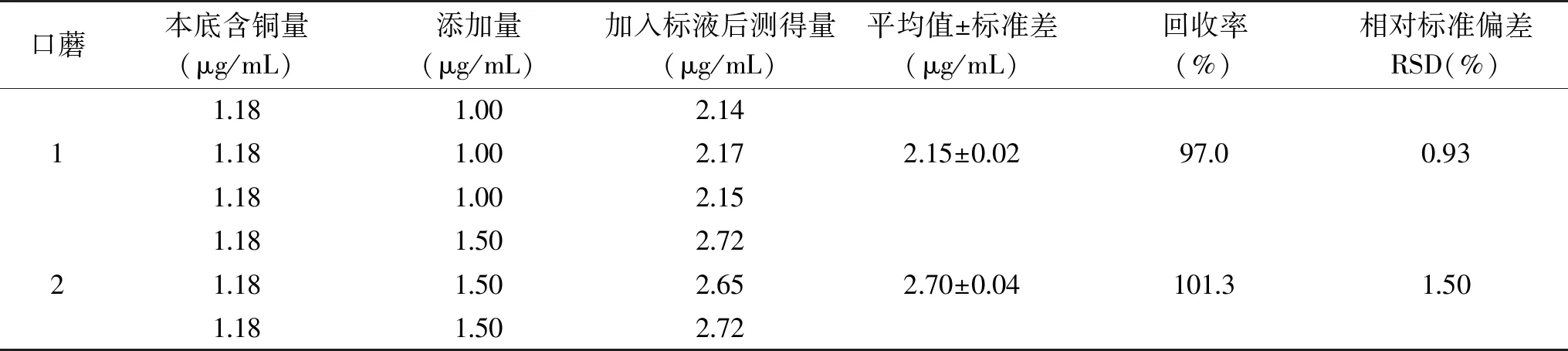
表2 回收率的测定Table 2 Determination of the recoveries
3 结论
本文合成了一种新型偶氮显色剂3,5-二甲酸-4′-羟基偶氮苯,并对其结构进行了表征。显色剂与Cu2+生成配合物的最佳参数为:1.4×10-4mol·L-1的显色剂3.00 mL,pH约为9.18的四硼酸钠缓冲溶液1.00 mL,且显色剂与Cu2+配比为1∶1(显色剂可选择性地识别Cu2+,两者形成了1∶1的配合物)。由于实验中配合物与显色剂的紫外可见光谱显示两者色差不大,根据配合物及显色剂的紫外可见光谱的特征,创造性地选择了320 nm为工作波长,间接地测定了Cu2+的含量。实验结果表明,铜(Ⅱ)的质量浓度在0~2.5 μg·mL-1内遵从比尔定律,R2=0.9921,摩尔吸光系数为4.3×104L·mol-1·cm-1,加标回收率为97.0%~101.3%,RSD为0.93%~1.50%,用于口蘑中Cu2+的测定结果与ICP结果几乎吻合,说明该法具有精密度高和准确度高的优点,有望推广到其它食品中微量铜的测定。
