GM-1预处理对布比卡因脊神经毒性模型大鼠脊髓组织JNK信号通路的影响
2019-09-23罗茜刘本铨吉杰梅封青刘敬臣
罗茜,刘本铨,吉杰梅,封青,刘敬臣
(广西医科大学第一附属医院,南宁530021)
椎管内麻醉因其镇痛效果确切、对全身血流动力学影响小、术中易于管理等优点,在临床工作中被广泛应用。布比卡因作为酰胺类局麻药的代表药物,是椎管内麻醉的常用药物,但其被证实具有潜在的脊神经毒性[1]。椎管内麻醉后局麻药神经毒性相关性并发症主要有短暂性神经综合征(TNS)、马尾综合征等[2],一旦发生,则预示预后不良。因此迫切地需要寻找可能的治疗药物。单唾液酸四己糖神经节苷脂(GM-1)广泛存在于神经细胞膜上,具有维持细胞膜上Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶稳定性、减轻细胞水肿、促进细胞存活、轴突生长和突触形成的作用[3],是治疗脊髓外伤的常用药物。动物和细胞研究均表明,GM-1可以治疗布比卡因诱导的凋亡蛋白半胱天冬酶-3(Caspase-3)的表达,减轻神经元凋亡[4],表明GM-1对布比卡因脊神经毒性有一定的治疗作用。c-Jun氨基末端激酶(JNK)信号通路作为细胞凋亡的调控通路之一,参与Caspase-3表达的调控[5]。研究表明,布比卡因神经细胞的毒性与JNK信号通路的激活相关[6],而抑制JNK信号通路有利于脊髓外伤大鼠运动功能的恢复[7]。但5%布比卡因鞘内注射前,应用GM-1进行预处理能否通过调节JNK信号通路减轻布比卡因脊神经毒性,目前还未见报道。2018年3月~2019年3月,本研究旨在观察GM-1预处理对布比卡因脊神经毒性大鼠JNK信号通路的影响。
1 材料与方法
1.1 动物与试剂 SPF级成年雄性SD大鼠108只,体质量280~300 g(广西医科大学动物实验中心提供)。PE-10导管(内径0.28 mm,外径0.61 mm,Smith Medical,英国);GM-1(批号:国药准字H20070243,阿根廷TRB公司);布比卡因(Sigma公司); YLS.12A型鼠尾光照测痛仪(淮北正华生物仪器设备有限公司,安徽);蛋白酶K工作液(索莱宝公司);TUNEL反应混合液(瑞士Roche公司);DAB底物(武汉博士德生物工程公司);蛋白酶抑制剂(索莱宝公司);磷酸酶抑制剂(索莱宝公司);RIPA裂解液(索莱宝公司);4蛋白上样缓冲液(索莱宝公司);磷酸化JNK(p-JNK)一抗(Cell Signaling公司);内参蛋白GAPDH一抗(Proteintech公司);山羊抗小鼠荧光二抗(Licor公司);Odessey红外荧光扫膜仪器(Licor公司);RNAiso(TaKaRa公司);PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa公司);SYBR Premix Ex Taq Ⅱ kit (TaKaRa公司);JNK上游引物5′-ATCTCCGTAGACGAAGCTCTCCAG-3′ ;JNK下游引物:5′-GACGCCATTCTTAGTTCGCTCCTC-3′;GAPDH上游引物:5′-GGCATGGACTGTGGTCATGA-3′;GAPDH下游引物:5′-TTCACCACCATGGAGAAGGC-3′(引物均来自生工生物有限公司)。
1.2 动物分组与蛛网膜下腔置管 按随机数字表法均分为三组:生理盐水组(saline组)、布比卡因组(S+B组)和GM-1预处理组(G+B组)各36只。采用改良Yaksh法[8]对各组大鼠行鞘内置管。预先用生理盐水浸润的PE-10导管于L5~L6椎间隙向头端蛛网膜下腔置入导管1.5 cm,置入过程如见大鼠反射性甩尾及生理盐水从导管口向外溢出,可证实导管在蛛网膜下腔。将导管固定于肌肉上,皮下埋管并将导管远端从颈部穿出,在颈部皮肤开口处缝扎固定,火烧封口。置管后单笼饲养3 d,出现下肢运动障碍者剔除;其余大鼠鞘内注射2%利多卡因20 μL,注药后30 s内出现双下肢麻痹且30 min内恢复证明蛛网膜下腔置管成功,饲养2 d用于后续实验,否则剔除。
1.3 干预方法 G+B组从导管向鞘内注射GM-1 30 mg/kg;saline组和S+B组同时鞘内注射等量生理盐水。24 h后,S+B组、G+B组鞘内注入5%布比卡因0.12 μL/g 3次,每次间隔1.5 h;saline组同时注入等量生理盐水。各组做完相应处理后,分别观察0、1、3、5、7、14 d。
1.4 检测指标
1.4.1 感觉功能及运动功能评价 ①感觉功能评价:行甩尾反应潜伏期(TFL)检测。用鼠尾光照测痛仪于鞘内注射药物前(基础值)及注药后(实测值)0、1、3、5、7、14 d,测定并记录各组大鼠的TFL。测量3次,每次间隔5 min,取平均值,结果换算成最大抗辐射热效应百分比(%MPE),换算公式为:%MPE=(实测值-基础值)/(最大值-基础值)×100%。为避免组织损伤,TFL最大值为16.01 s。②运动功能评价:行后肢运动功能BBB评分[9]。0分为无可见的后肢运动,21分为运动功能正常。为避免大鼠昼夜痛域的差异,所有的测量均在早上9:00~11:00完成。
1.4.2 脊髓组织损伤观察 TFL测定和BBB评分结束后,三组各时点随机取6只大鼠,麻醉后用4 ℃生理盐水经左心室灌注至肝脏发白。迅速取出腰膨大处脊髓组织。采用Takenami等介绍的评分方法进行脊髓组织损伤评分(SD评分)[1]。评分标准包括:①病变分布评分:取脊髓组织于4%多聚甲醛中固定,常规石蜡包埋,连续切片行HE染色光镜下观察。0分为没有发现明显病变;1分为病变仅局限于后根;2分为病变后根延伸至相应的白质区域。②病变严重程度评分:取脊髓后根1 mm×1 mm×2 mm,3%戊二醛磷酸缓冲液固定后,电镜下观察后根及白质。0分为无病变;1分为轻度病变(局部的髓鞘和轴突病变);2分为中度病变(分级1~3分);3分为严重病变(弥漫性的髓鞘和轴突病变)。脊髓组织损伤评分为病变分布评分与严重程度评分之和。
1.4.3 脊髓组织细胞凋亡检测 采用TUNEL法。将石蜡包埋脊髓组织切片,片厚3 μm。组织切片经脱蜡水化,滴加蛋白酶K工作液,37 ℃条件下反应15 min。滴加TUNEL反应混合液至组织切片,37 ℃暗湿盒中反应1 h;PBS漂洗,滴加DAB底物,暗湿盒(37 ℃)中反应10 min;PBS漂洗、苏木素复染、梯度乙醇脱水、甲苯透明、中性树胶封片;在光学显微镜对每个样品的5个随机镜下观察阳性细胞,Image J软件分析计算阳性细胞百分比。
1.4.4 脊髓组织p-JNK蛋白表达检测 采用Western blotting法。冻存脊髓组织加入含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液于冰上研磨,低温离心,吸取上清。BCA法测定并记录各蛋白样品的浓度。加入蛋白上样缓冲液混匀,煮沸变性后备用。各蛋白样品中吸取等量蛋白于10%SDS-PAGE胶中电泳分离,湿转法转移蛋白至PVDF膜。p-JNK一抗(稀释比1∶1 000)和内参蛋白GAPDH一抗(稀释比1∶3 000)摇床上4 ℃孵育PVDF膜过夜,TBST洗膜。山羊抗小鼠荧光二抗(1∶5 000)室温孵育PVDF膜1~2 h,TBST洗膜。Odessey红外荧光扫膜仪器扫描所得PVDF膜。扫描结果采用Image J软件分析,以p-JNK蛋白条带灰度值和内参蛋白GAPDH条带灰度值的比值反映p-JNK蛋白相对表达水平。
1.4.5 脊髓组织JNK基因表达检测 采用qRT-PCR法。RNAiso提取总RNA。PrimeScript RT reagent Kit with gDNA Eraser将所得总RNA逆转录为cDNA。SYBR Premix Ex Taq Ⅱ kit检测目的基因JNK及内参基因GAPDH的表达。JNK mRNA含量根据每个样本的GAPDH含量进行标准化,结果用相对定量2-ΔΔCt法分析。

2 结果
2.1 各组感觉功能比较 注药后各时点,S+B组、G+B组的%MPE均高于saline组(P均<0.05);注药后3、5、7、14 d,G+B组的%MPE低于S+B组(P均<0.05)。见表1。
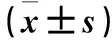
表1 各组感觉功能比较
注:与saline组比较,*P<0.05;与S+B组比较,#P<0.05。
2.2 各组运动功能比较 saline组各时间点的BBB评分均为21分。注药后0、1、3、5、7、14 d,S+B组、G+B组的BBB评分均低于相应时间点的saline组(P均<0.05);注药后5、7、14 d,G+B组BBB评分均高于表S+B组(P均<0.05)。见表2。
2.3 脊髓组织病理学改变 ①光镜下,saline组在各时间点灰质和白质结构致密,神经元形态规则、轮廓清晰,内含有丰富的尼氏体,神经元纤维平行排列成束;S+B组、G+S组在注药后0、1、3、5、7、14 d,脊髓灰质和白质内均有大小和数量不等的空泡形成,神经元水肿或萎缩,且数量减少,细胞核固缩、深染,神经纤维排列紊乱;与相应时间点的S+B组相比,注药后5、7、14 d,G+B组脊髓灰质和白质结构较为致密,空泡减少,水肿程度减轻,神经元和轴突数量较多。②电镜下,saline组各时间点髓鞘致密,内质网形态正常,染色质染色均匀,胞核清晰完整;S+B组、G+B组给药后各时点均出现不同程度的脱髓鞘变化,轴浆萎缩,内质网肿胀、起泡,核膜皱缩、溶解,染色质边集。与相同时点S+B组的弥漫性轴浆萎缩和脱髓鞘变化相比,G+B组在5、7、14 d的轴突损伤程度较轻,且范围较为局限。见图1。③给药后各时点,S+B组、G+B组的组织损伤评分均比相应时点的saline组高(P<0.05)。给药后第5 d、7 d、14 d,G+B组SD评分比相应时点的S+B组低(P<0.05)。见表3。

表2 各组不同时点BBB评分比较[分,M(Q)]
注:与saline组比较,*P<0.05;与S+B组比较,#P<0.05。
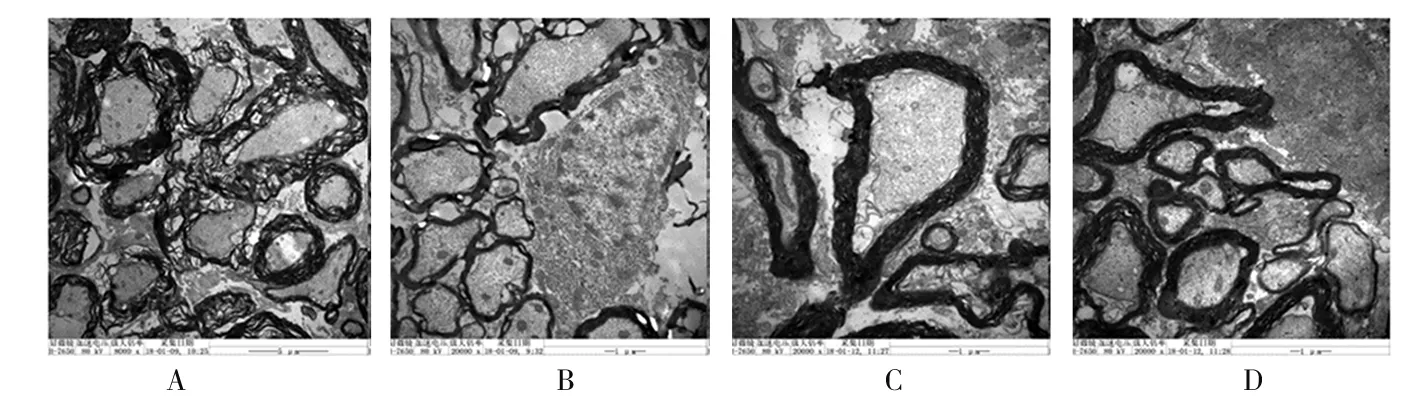
注:A为S+B组7 d时(×8 000);B为S+B组14 d时(×20 000);C为G+B组7 d时(×20 000);D为G+B组14 d时(×20 000)。
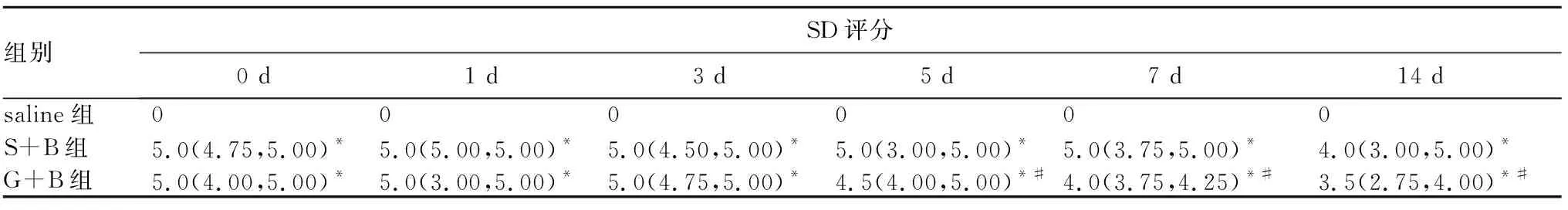
图1 各组脊髓组织超微结构表现(透射电镜法)
注:与saline组比较,*P<0.05;与S+B组比较,#P<0.05。
2.4 各组脊髓组织细胞凋亡率比较 给药后各时点,S+B组、G+B组脊髓细胞凋亡率均高于相应时点saline组(P均<0.05);给药后5、7、14 d,G+B组脊髓细胞凋亡率均低于相应时点S+B组(P均<0.05)。见表4。
2.5 各组脊髓组织p-JNK蛋白表达比较 S+B组、G+B组p-JNK相对表达量均高于相应时间点saline组(P<0.05);给药后第5、7 d,G+B组p-JNK相对表达量均低于相应时点S+B组(P均<0.05)。见图2、表5。
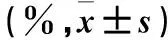
表4 各组脊髓组织细胞凋亡率比较
注:与saline组比较,*P<0.05;与S+B组比较,#P<0.05。
2.6 各组脊髓组织JNK mRNA表达比较 给药后各时点,S+B组、G+B组JNK mRNA相对表达量均高于相应时点saline组(P<0.05);给药后3、5、7 d,G+B组JNK mRNA相对表达量均高于相应时点S+B组(P<0.05)。见表6。
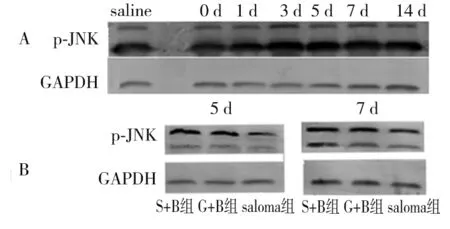
注:A为S+B组各时点蛋白表达量;B为S+B组、G+B组、saline组注药后5、7 d蛋白表达量。
图2各组脊髓组织p-JNK蛋白表达比较(Western blotting法)
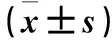
表5 各组脊髓组织p-JNK蛋白表达比较
注:与saline组相比较,*P<0.05;与S+B组比较,#P<0.05。
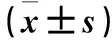
表6 各组脊髓组织JNK mRNA表达比较
注:与saline组比较,*P<0.05;与S+B组比较,#P<0.05。
3 讨论
5%布比卡因鞘内注射引起神经毒性的病理基础是诱导大鼠脊髓神经元的凋亡[1]。布比卡因导致的神经毒性是多机制多通路共同调控的过程:内质网应激凋亡通路[10]、p38 MAPK通路[11]等都参与其中。JNK信号通路是MAPK信号通路的一部分,与内质网应激凋亡通路密切相关。在内质网应激情况下,JNK蛋白磷酸化成为活性形式p-JNK蛋白[12]。p-JNK蛋白磷酸化并激活c-Jun蛋白,c-Jun蛋白作为激活蛋白-1(AP-1)的组成部分,参与激活与细胞凋亡相关的下游基因[13]。此外,p-JNK蛋白还可以调控内源性凋亡通路中Casepase-3[5]和Bcl-2家族[12]的表达,间接诱导细胞凋亡。
GM-1已被广泛应用于脊髓外伤[14]、脑缺血再灌注损伤[15]的治疗。研究表明,在注射5%布比卡因前,应用GM-1预处理,可以抑制内质网应激GRP78/PERK/eIF2α/ATF4通路[11],部分减轻5%布比卡因的脊神经毒性。但目前,GM-1对5%脊髓神经毒性的治疗作用和JNK信号通路是否有关联,尚未见报道。
本研究发现,注药后各时点saline组感觉和运动功能未见明显改变,脊髓组织无病变或神经元凋亡,表明置管操作未对大鼠脊髓造成伤害;S+B、G+B组的感觉运动功能均有不同程度的损害,组织损伤评分和细胞凋亡率高于相应时点的saline组,表明5%布比卡因脊神经毒性模型建立成功;各时点S+B组、G+B组JNK mRNA和p-JNK蛋白的表达量均高于相应时点的saline组,表明5%布比卡因激活了JNK信号通路,5%布比卡因导致脊神经毒性与JNK信号通路的激活相关。
本研究发现,给药后3、5、7、14 d时,G+B组感觉功能优于S+B组;5、7、14 d,G+B组运动功能优于相应时点的S+B组,组织损伤评分和细胞凋亡率低于相应时点的S+B组,表明GM-1预处理可以减轻5%布比卡因的神经毒性;给药后3、5、7 d,G+B组JNK mRNA的相对表达量低于相应时点的S+B组;给药后5、7 d,G+B组p-JNK的相对表达量低于相应时点的S+B组,表明GM-1预处理减轻5%布比卡因脊神经毒性的机制与抑制JNK信号通路的激活相关。本研究表明,GM-1预处理可以抑制5%布比卡因引起的JNK信号通路激活,减轻其脊神经毒性,表明GM-1具有神经保护作用,阐明其发挥神经保护作用的又一机制。
然而,本研究发现,与S+B组相比,G+B组在给药后3、5、7、14 d,有一定程度的好转,但JNK信号通路的功能执行者p-JNK蛋白的表达量在仅在给药后5、7 d有所降低。感觉运动功能恢复、细胞凋亡率降低、组织病理损伤程度减轻的时间,与JNK信号通路受到抑制的时间并不完全一致。提示JNK信号通路的抑制可能只是GM-1预处理减轻布比卡因脊神经毒性的机制之一,仍然有其他机制共同参与这一过程。
本研究发现,与saline组相比,给药后各时点G+B组的感觉运动功能、组织细胞结构受到不同程度的损伤,细胞凋亡率均升高,提示GM-1预处理仅能部分地减轻而不能完全消除布比卡因脊神经毒性。与saline组相比,给药后各时点G+B组JNK mRNA和p-JNK蛋白的相对表达量均升高,提示GM-1预处理仅能部分地抑制而不能完全消除JNK信号通路的激活。应用JNK特异性抑制剂SP600125完全抑制JNK信号通路,能否更大程度地减轻5%布比卡因的脊神经毒性,仍然有待进一步验证。
综上所述,GM-1预处理可以减轻大鼠鞘内注入布比卡因引起的脊神经毒性,改善大鼠的感觉、运动功能,减轻神经细胞凋亡和病变,其机制与抑制JNK信号通路的激活有关。
