PI3K/Akt通路在槲皮素后处理减轻心肌细胞缺氧/复氧损伤中的作用
2019-09-23王赟张宗泽张婧婧陈莹莹吴云王焱林
王赟,张宗泽,张婧婧,陈莹莹,吴云,王焱林
(武汉大学中南医院,武汉430071)
磷脂酰肌醇3-激酶/丝氨酸-苏氨酸蛋白激酶(PI3K/Akt)信号通路是细胞内重要的信号转导通路之一,在细胞的凋亡、存活以及增殖等活动中发挥重要的生物学功能[1]。槲皮素是一种广泛存在于植物和红酒中的黄酮类化合物,具有抗氧化、抗炎、抗血小板聚集、抗病毒和保护心肌等多种功效[2]。研究发现,槲皮素可通过激活PI3K/Akt信号通路,抑制脑缺血/再灌注损伤引起的神经细胞死亡[3]。无论在缺血前还是在再灌注初期,给予适量的槲皮素均可减小再灌注引发的心肌梗死面积,减轻心肌细胞损伤[4,5]。然而,PI3K/Akt信号路在槲皮素后处理心肌保护中的作用目前尚不清楚。2018年5~12月,本研究旨在利用体外心肌细胞缺氧/复氧(H/R)模型,模拟心肌缺血/再灌注损伤,观察槲皮素后处理对H/R诱导的心肌细胞凋亡的影响,并探讨其与PI3K/Akt通路的关系。
1 材料与方法
1.1 动物与试剂 新出生1~3 d的SD乳鼠(武汉大学动物中心提供)。槲皮素、MTT、Wortmannin和溴脱氧尿嘧啶核苷(Sigma公司,美国);DMEM培养基、胎牛血清和胰蛋白酶(Gibco公司,美国);Akt、p-Akt、Bcl-2和Bax兔抗鼠多克隆抗体(Santa Cruz,美国)。Annexin-V/PI凋亡试剂盒(Becton公司,美国);LDH试剂盒和BCA蛋白定量试剂盒(南京建成生物工程研究所,中国);其他化学试剂均为国产分析纯。
1.2 心肌细胞的原代培养 参照文献[7]的方法,无菌条件下分离乳鼠心室肌,剪成1 mm3碎块,加入0.125%胰酶消化碎块。将消化完全的细胞悬液加入含20%胎牛血清的DMEM培养液中进行培养,采用差速贴壁分离法纯化心肌细胞。同时加入0.1 mmol/L 5-溴脱氧核苷以抑制非心肌细胞的增殖。收集悬浮细胞,台盼蓝染色计数,调节细胞密度后接种于6孔板中,每孔置于37 ℃、5%CO2、95%O2培养箱内培养,3 d 后进行实验。
1.3 H/R模型制备 参照文献[7]并加以改进。心肌细胞培养3 d后,弃去含20%胎牛血清的DMEM高糖培养基,加入预先用95%N2+5%CO2饱和过的无血清无糖的DMEM培养基,并将细胞置于通有95%N2+5%CO2厌氧培养箱中培养2 h模拟缺氧。2 h后将无糖培养基换成含20%胎牛血清的DMEM高糖培养基,并将细胞放回37 ℃、5%CO2、95%O2培养箱内培养4 h模拟复氧。
1.4 实验分组及干预方法 心肌细胞随机分为正常对照组(Con组)、H/R组、H/R+槲皮素组(H/R+Que组)、H/R+槲皮素+抑制剂组(H/R+Que+W组)共4组。Con组细胞正常培养6 h;H/R组仅构建H/R模型;H/R+Que组于缺氧结束时,在含20%胎牛血清的DMEM培养基中加入终浓度为40 μmol/L的槲皮素,随即复氧4 h;H/R+Que+W组于缺氧结束时,在含20%胎牛血清的DMEM培养基中加入PI3K抑制剂Wortamannin 100 nmol/L和槲皮素40 μmol/L,余后处理同H/R组。
1.5 细胞存活率检测 采用MTT法。复氧4 h后,向培养在96孔板中的各组细胞培养液中加入MTT(5 mg/mL)20 μL,放入培养箱中培养4 h后,倒掉培养基,每孔加入200 μL DMSO,振荡10 min,在490 nm波长处测每孔的吸光度。按以下公式计算细胞存活率:细胞存活率(%)=(实验吸光度值/对照组吸光度值)×100。
1.6 心肌细胞培养液中LDH活性测定 复氧4 h后,收集各组细胞培养液200 μL,按照LDH试剂盒用RT-6000生化自动分析仪测定LDH活性。
1.7 心肌细胞凋亡检测 采用流式细胞仪。用0.25%胰酶消化收集各组细胞,2×105细胞2 000 r/min离心5 min,用PBS漂洗2次。用500 μL Binding Buffer重悬细胞后,加入FITC标记的Annexin V(40 μg/mL)和PI(50 μg/mL)各5 μL,避光反应15 min后用流式细胞仪检测。以早期凋亡细胞(LR)+晚期凋亡细胞(UR)所占比例表示细胞凋亡率(%)。
1.8 p-Akt、Akt、Bcl-2和Bax蛋白表达检测 采用Western blotting法。收集各组细胞,4 ℃ PBS洗涤2次。加入预冷的细胞裂解缓冲液,冰上裂解15 min,裂解产物4 ℃、10 000 g离心30 min。上清液用BCA法测定蛋白浓度。等量样品以12%SDS-聚丙烯酰胺凝胶电泳分离蛋白质。电泳后将蛋白转至硝酸纤维膜上,将膜用TBST(0.05%Tween-TBS)配制的5%脱脂奶粉溶液室温封闭1 h后,分别与一抗室温反应2 h,TBST清洗3次,每次15 min,再与过氧化物酶标记的二抗室温反应1 h,TBST清洗3次,每次10 min。加入ECL显色液,曝光显影。采用AlphaEaseFC4.0软件(AlphaInnotech公司,美国)进行分析。相对蛋白含量=目的条带吸光度值/β-actin条带吸光度值。

2 结果
2.1 各组细胞存活率比较 H/R组细胞存活率低于Con组,H/R+Que组细胞存活率高于H/R组,H/R+Que+W组细胞存活率低于H/R+Que组(P均<0.05)。见表1。
2.2 各组心肌细胞培养液中LDH活性比较 H/R组LDH高于Con组,H/R+Que组LDH低于H/R组,H/R+Que+W组LDH活性高于H/R+Que组(P均<0.05)。见表1。
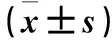
表1 各组心肌细胞存活率及LDH活性比较
注:与Con比较,*P<0.05;与H/R组比较,#P<0.05;与H/R+Que组比较,▲P<0.05。
2.3 各组细胞凋亡比较 与Con组相比,H/R组细胞凋亡增多(P<0.05);与H/R组相比,H/R+Que组细胞凋亡减少(P<0.05);与H/R+Que组相比,H/R+Que+W组细胞凋亡增多(P<0.05)。见表2。
2.4 p-Akt蛋白活性及凋亡蛋白Bcl-2、Bax表达比较 H/R及H/R+Que组p-Akt蛋白表达高于其他各组;而H/R+Que+W组p-Akt蛋白水平低于H/R+Que和H/R组。与H/R组比较,H/R+Que组Bcl-2表达增高、Bax表达降低,Bcl-2/Bax比例增高(P均<0.05)。与H/R+Que组比较,H/R+Que+W组Bcl-2表达降低、Bax表达增高,Bcl-2/Bax比例降低(P均<0.05)。见表2。
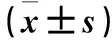
表2 各组心肌细胞凋亡率及p-Akt、Bcl-2、Bax蛋白表达比较
注:与Con比较,*P<0.05;与H/R组比较,#P<0.05;与H/R+Que组比较,▲P<0.05。
3 讨论
从体外细胞水平研究药物对心肌的保护作用可以排除动物实验模型中全身神经体液因素的影响,便于更好地阐明药物对心肌细胞的影响及其机制。通过减少心肌细胞氧供,并在一定的时间范围内恢复细胞的氧供,是模拟临床缺血性心脏病再灌注治疗常用的实验方法[6]。目前建立H/R的方法主要有物理性和化学性两种,尤其以物理性混合气体模型多见[6]。本实验参照已有的心肌细胞H/R模型[6],选择了不同时间的单纯性物理损伤方法构建细胞H/R模型,并结合MTT、LDH检测结果,最终选择了缺氧2 h复氧4 h,实验结束后,细胞存活率明显降低,细胞培养基LDH漏出量增高,表明细胞H/R模型构建成功。
本研究参照文献[7]选择槲皮素的给药浓度,结果显示,与H/R组比较,H/R+Que组心肌细胞存活率增高、LDH活性降低、细胞凋亡减少,提示槲皮素后处理可抑制H/R引起的心肌细胞凋亡。
Bcl-2蛋白家族是细胞凋亡过程中起着重要作用的一类蛋白,细胞凋亡程度与Bcl-2/Bax比值有关,Bcl-2/Bax比值增高促进细胞存活,Bcl-2/Bax比值降低促进细胞凋亡[8]。本研究结果显示,与H/R组比,H/R+Que组Bcl-2蛋白表达上调,Bax蛋白表达下调,Bcl-2/Bax比值增高,表明槲皮素后处理可减轻H/R引起的心肌细胞凋亡。
PI3K/Akt信号通路是细胞内重要的信号转导通路之一,通过磷酸化下游的许多功能蛋白、凋亡相关等效应因子而参与细胞凋亡、增殖、分化及存活等[1]。大量研究表明,PI3K/Akt信号通路的激活对心肌缺血/再灌注损伤发挥着至关重要的作用。缺血后处理可直接激活PI3K/Akt信号途径发挥其心肌保护作用。同时,药物后处理的心肌保护机制的研究也表明,PI3K/Akt信号通路的激活可有效减轻心肌损伤,抑制心肌细胞凋亡[9]。
槲皮素是一种广泛存在于植物和红酒中的黄酮类化合物,具有抗氧化、抗炎、抗血小板聚集、抗病毒和保护心肌等多种功效[2]。流行病学研究发现,槲皮素的摄入量与冠心病的发生呈明显负相关。无论在缺血前还是在再灌注初期给予适量的槲皮素,均可减小再灌注引发的心肌梗死面积,减轻心肌细胞损伤[4,5]。实验研究证实,槲皮素可通过减少氧自由基产生、抑制中性粒细胞浸润等途径发挥心肌保护作用[2]。本实验结果显示,与H/R组比较,H/R+Que组细胞内p-Akt活性增加,抗凋亡蛋白Bcl-2表达上调,促凋亡蛋白Bax表达下调;预先加入PI3K/Akt特异性抑制剂后,槲皮素后处理的保护作用明显受到抑制。提示槲皮素后处理可通过激活PI3K/Akt信号通路,进一步干预凋亡蛋白Bcl-2、Bax的表达,抑制心肌细胞凋亡的发生,减轻细胞损伤。
综上所述,槲皮素后处理对心肌细胞H/R损伤具有保护作用,其机制可能是通过激活PI3K/Akt信号通路实现的。
