黄连解毒汤调控apoE-/-小鼠粒细胞释放中性粒细胞捕捉网的研究*
2019-09-23孙慧娟朱镠娈马雅銮
孙慧娟,朱镠娈,张 玥,陈 冰,薛 欣,曾 辉,马雅銮△
(1. 中国中医科学院中医基础理论研究所,北京 100700; 2. 首都医科大学附属北京地坛医院传染病研究所,北京 100015; 3. 新发突发传染病研究北京市重点实验室,北京 100015)
高脂血症(hyperlipidemia, HP)可引起机体慢性炎症[1],导致动脉粥样硬化(atherosclerosis, AS)的发生发展。在这一过程中,单核细胞与其分化生成的巨噬细胞发挥了重要作用[2]。前期研究发现,黄连解毒汤干预可以降低高脂导致的炎症型单核细胞,减轻全身和血管局部炎症反应,最终抑制高脂饮食喂饲的apoE-/-小鼠AS斑块形成[3-4]。
在高脂血症引发AS发生发展的过程中,除单核细胞和巨噬细胞之外,其他免疫细胞也参与AS相关的炎症反应[5]。粒细胞是成人外周血比例最高的白细胞,也是天然免疫系统的第一道防线。但由于中性粒细胞主要功能是清除病原体和坏死组织,此类细胞在AS这种无菌性疾病中的作用并未引起足够重视。近期研究发现,中性粒细胞活化后,其胞内DNA、组蛋白和多种酶形成复合物,被主动释放到胞外,形成中性粒细胞胞外捕捉网(neutrophil extracellular traps, NETs)[6]。NETs可以能够捕获和杀灭病原体,同时也可以引起组织炎症损伤[6]。研究发现,NETs含量与AS严重程度相关[7]。
本研究关注apoE-/-小鼠外周血中粒细胞、淋巴细胞及中性粒细胞/淋巴细胞(neutrophil to lymphocyte ratio, NLR)变化以及粒细胞释放NETs水平,探讨黄连解毒汤能否改善高脂所致的NLR和NETs变化,减轻高脂造成的粒细胞活化,进一步揭示黄连解毒汤对高脂血症/AS的免疫调节机制。
1 材料与方法
1.1 动物
雌性8周龄C57BL/6及apoE-/-小鼠,体质量(20±2)g,所有实验用鼠均购于北京大学实验动物中心(动物许可证号SCXK(京)2016-0010),实验干预小鼠饲养于北京大学实验动物中心,SPF条件。
1.2 药物
黄连解毒汤由黄连、黄芩、黄柏、栀子按3∶2∶2∶3比例组成,饮片购于北京同仁堂药店,药材均经鉴定,按常规方法煎煮取汁,浓缩成相当于黄连解毒汤生药0.5 g/mL。阿托伐他汀20 mg/片(批号S36972),美国辉瑞制药有限公司生产。
1.3 试剂及仪器
TC、TG、LDL-C和HDL-C试剂盒,日本和光公司;Quan-iT PicoGreenTMdsDNA 检测试剂盒,美国Thermo公司;FACS Callibur流式细胞仪,美国BD公司;自动酶联免疫系统,美国Thermo公司;Beckman CX4全自动生化分析仪,美国贝克曼·库尔特公司。
1.4 动物分组及干预方法
实验动物分5组,每组10只小鼠。C57BL/6+普食为对照组(C57BL/6+CD);apoE-/-小鼠采用配对比较法随机分为apoE-/-+普食组(apoE-/-+CD)、apoE-/-+高脂组(apoE-/-+WD)、apoE-/-+高脂+黄连解毒汤组(apoE-/-+WD+HLJDT)、apoE-/-+高脂+阿托伐他汀组(apoE-/-+WD+Atr)。高脂饲料含78.85%基础饲料,0.15%胆固醇,21%脂肪。干预组小鼠根据体质量每天给予临床等效剂量(阿托伐他汀[3 mg/(kg·d)]、黄连解毒汤[5 g/(kg·d)]),其他小组采用等量纯净水灌胃。每周检测体质量变化,分别干预4周和18周。
1.5 检测指标及方法
干预4周的C57BL/6及apoE-/-小鼠异戊烷吸入麻醉,小鼠摘眼球采EDTA抗凝血,离心(800×g, 10 min)后取血浆,用于血脂和NETs检测;血细胞用于流式细胞仪检测。干预18周的C57BL/6及apoE-/-小鼠剥离胸腹主动脉,用于病理检测。
1.5.1 血脂水平测定 干预4周的C57BL/6及apoE-/-小鼠血浆采用过氧化酶法测定血浆胆固醇(cholesterol,TC);脂肪酶/甘油磷酸酯氧化酶-过氧物酶比色法测定甘油三酯(triglyceride,TG);直接法测定低密度脂蛋白(low density lipoprotein,LDL)和高密度脂蛋白(high density lipoprotein,HDL)。
1.5.2 外周血粒细胞及淋巴细胞比例检测 干预4周的C57BL/6及apoE-/-小鼠的血细胞加入获取血浆等量PBS,裂解红细胞后应用FACS Callibur流式细胞仪(美国BD公司)检测。根据前向散射角和侧向散射角分出粒细胞和淋巴细胞。
1.5.3 NETs cfDNA检测 干预4周的C57BL/6及apoE-/-小鼠血浆采用PicoGreen 法定量检测血浆中NETs cfDNA的含量。
1.5.4 病理染色 干预18周的C57BL/6及apoE-/-小鼠,剥离胸腹主动脉,用4%多聚甲醛固定, 20%蔗糖脱水,经油红O染色、分化后观察。
1.6 统计学方法
2 结果
2.1 血脂水平比较
表1显示,黄连解毒汤和阿托伐他汀干预后对高脂喂饲的apoE-/-模型小鼠血脂影响。与既往研究一致,黄连解毒汤干预后TC、TG、HDL和LDL的水平均未见显著改变(P>0.05)。
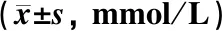
表1 各组动物血脂水平比较
注:与野生普食组比较:**P<0.001; 与apoE-/-高脂组比较:#P<0.05,##P<0.001
2.2 外周血粒细胞、淋巴细胞比例及NLR的变化
表2显示,与野生小鼠比较,普通饮食喂饲的apoE-/-小鼠外周血粒细胞比例显著升高,淋巴细胞比例降低,NLR升高(P<0.05)。4周高脂饮食后,apoE-/-模型小鼠外周血粒细胞比例进一步升高,淋巴细胞比例进一步降低,NLR显著升高(P<0.05)。黄连解毒汤和阿托伐他汀干预apoE-/-小鼠粒细胞降低,淋巴细胞比例升高,差异无统计学意义(P>0.05),但NLR明显降低(P<0.05)。

表2 各组动物外周血粒细胞、淋巴细胞比例及
注:与野生普食组比较:*P<0.05,**P<0.001;与apoE-/-高脂组比较:#P<0.05,##P<0.001
2.3 血浆NETs cf DNA含量比较
表3显示,NETs DNA可在血液中成为细胞游离DNA(cell free DNA,cfDNA)[8]。结果发现,与正常对照小鼠和普食apoE-/-小鼠比较,高脂饮食的apoE-/-小鼠血浆cfDNA水平显著增高(P<0.001)。经4周干预,黄连解毒汤显著下调cfDNA水平(P<0.05),阿托伐他汀无明显影响cfDNA水平(P>0.05)。

表3 各组动物血浆cfDNA 水平比较
注:与野生普食组比较:*P<0.05,**P<0.001;与apoE-/-高脂组比较:#P<0.05,##P<0.001
2.4 动物主动脉斑块形成情况
图1显示,饲养18周的apoE-/-普食组主动脉弓和主动脉干可见不规则零散粥样硬化斑块,高脂喂饲apoE-/-主动脉干斑块数量增多,面积增大,主动脉弓可见大片斑块;黄连解毒汤和阿托伐他汀干预后,主动脉血管斑块面积显著减小。

图1 油红O染色检测主动脉病理组织变化
3 讨论
长期高血脂引发机体免疫异常、系统性炎症反应,包括多种免疫细胞的数量和功能失常,炎症介质过量产生,导致脂质清除障碍,促进AS形成发展[2,5]。单核/巨噬细胞既是天然免疫细胞,又是血管AS斑块主要的组成细胞,在AS中起重要作用,受到极大关注[2]。黄连解毒汤出自《肘后备急方》,是清热解毒的经典代表方。近年越来越多临床与研究证明,黄连解毒汤对于高血脂导致的AS有治疗作用[3-4,9]。
中性粒细胞因其寿命短暂、更新迅速、表型不稳定、无特异性标记等,在AS病变过程中的作用一直未引起重视[10]。随着近年来粒细胞表型精准确定,粒细胞在AS中的作用逐渐受到重视。高脂血症及冠心病患者中性粒细胞数量增多[11],活化的中性粒细胞释放NETs含量与冠心病的严重程度相关[7]。中性粒细胞与淋巴细胞比值(NLR)升高会增加AS的患病率[12]。研究发现,中性粒细胞通过多种机制参与AS的病变[13-14]。首先,粒细胞是黏附于血管内皮的首发和主要白细胞,通过呼吸爆发产生细胞毒性和氧化活性,引发氧化应激和组织进行性损伤,导致内皮功能障碍和血管炎症,直接影响血管AS形成[15]。其次,NETs激活pDCs分泌IFN-a,扩大炎症促进AS斑块面积增大,增加斑块破裂的风险[16]。第三,粒细胞不仅引发炎症反应,还通过分泌炎性细胞因子募集活化单核细胞等其他免疫细胞,放大炎症反应,参与AS斑块的形成[17]。
本研究发现,与野生小鼠比较,apoE-/-小鼠外周血中粒细胞数目上升虽然没有显著差异,但NLR已经显著升高,提示造血系统向生成粒细胞倾斜。同时,尽管难以直接检测AS中的NETs,但考虑到高脂血症可以引发系统性炎症,因此检测NETs释放至血液中的cfDNA,发现高脂饮食apoE-/-小鼠血浆cf DNA显著增多,提示高脂导致NETs的大量生成[16]。前期研究已经发现,黄连解毒汤干预降低高脂引发apoE-/-小鼠外周血单核细胞及其炎症亚型比例[3-4]。本研究中,黄连解毒汤虽然没有显著降低高脂引发的粒细胞比例,但显著降低NLR,减少血浆cfDNA 即NETs含量。因此,黄连解毒汤还可能通过调节控制粒细胞功能,纠正NETs和NLR,抑制和延缓AS形成。在研究干预4周和18周内,未检测到血脂水平明显改善,可见黄连解毒汤的免疫调节作用不依赖于其降脂作用。
综上所述,本研究发现黄连解毒汤干预可以通过调控粒细胞免疫,抑制炎症反应,降低高脂引发的免疫损伤,抑制AS斑块形成。
由于粒细胞是AS炎症反应的始发细胞,且人体粒细胞占循环白细胞比例与小鼠粒细胞比例有很大差异,我们检测到小鼠粒细胞只占循环白细胞10%~15%,而人体循环中粒细胞比例高达50%~70%[14]。由此推测,粒细胞的异常在人体免疫及AS中的作用应该更为显著。因此本研究认为,调控失常的粒细胞,对预防和治疗AS有很好的前景。
